大鼠细小病毒VP2原核表达及间接ELISA方法建立
霍 娜,姚 威,于婉琪,魏晓锋,萧 飒, 陈鸿军
(1. 西北农林科技大学,杨凌 712100;2. 中国农业科学院上海兽医研究所,上海 200241;3.上海实验动物研究中心,上海 2012033)
大鼠细小病毒(Rat parvovirus,RPV)是对实验大鼠危害最为严重的病毒之一,属单股线状无囊膜DNA病毒,分类上属细小病毒科,细小病毒属,包括Kilham大鼠病毒(Kilham rae parvovirus,KRV),Toolan病毒(Toolans H-1 virus),大鼠细小病毒a型(RPV-1a)和大鼠微小病毒(Rat minute virus,RMV)4种毒株[1,2]。RPV在实验大鼠和野生大鼠中有较高的感染率,无任何临床症状和病理变化,但在细胞内持续性感染,并可致种鼠群繁殖率下降,污染肿瘤移植物和细胞系,对实验研究造成严重干扰,是实验动物国标中SPF级大鼠病毒必检项目之一[2-4]。
RPV的VP蛋白是结构性或衣壳蛋白,包括VP1、VP2和VP3。VP1是次要衣壳蛋白,其编码序列包含特殊的N端残基和VP2蛋白。而VP2是主要的衣壳蛋白,参与衣壳组装,释放大约85%的病毒粒子。VP2蛋白还决定了人肿瘤细胞对于H-1毒株的易感性。VP3蛋白是VP2的裂解产物[5-7]。
为检测大鼠细小病毒、大鼠微小病毒和细小病毒NS-1株感染的抗体水平,本研究参考这3种病原基因组DNA序列,设计引物,克隆大鼠细小病毒VP2抗原的特异性表位,原核表达后,以纯化蛋白为包被抗原,建立间接ELISA方法,可有效地用于大鼠细小病毒血清抗体检测。
1 材料与方法
1.1 质粒、菌种及试剂表达载体pET30a、大肠杆菌BL21(DE3)由本实验室保存。Balb/c小鼠购自上海西普尔-必凯实验动物有限公司。
1.2 血清和试剂大鼠细小病毒RPV、H-1和KRV毒株阳性血清和待检血清由上海实验动物研究中心提供。RPV VP2小鼠单克隆抗体2E7由本实验自制。HRP标记羊抗大鼠IgG(H+L)购自上海翊圣生物科技有限公司;Phanta®Max Super-Fidelity DNA聚合酶购自南京诺唯赞生物公司,T4 DNA连接酶、限制性内切酶BamH I、XhoI均购自英国NEB公司,其他试剂均为分析纯。
1.3 VP2基因克隆及原核表达
1.3.1 基因分析与引物设计 根据NCBI发表的大鼠细小病毒RPV(GenBank登录号:ACV32720)、H-1株(GenBank登录号:AFR44451.1)、KRV株(GenBank登录号:AAB38328.1)、RMV(GenBank登录号:AGG38825)和MVM株(GenBank登录号:ABB01355.1)的VP2蛋白序列进行比对分析,找出了一段特异的378 bp片段编码RPV-VP2的成熟肽:5'-ATGGCTGCTAGA GTTGAGAGAGCAGCTGACGGCAGTGGAGGC TCTGGTGGTGGTGGTGGTGGTGGTAATGGTG GTGTTGGGGTTTCTACGGGGAGCTTTGATAA CCAAACGCACTATGACTTCCTTGGAGGGGGG TGGGTCCGTATCACAGCGTATGCTTCGCGAC TTGTTCATATAAATATGCCTGCTTCTGAAGA GTACCATAGAATTTTTGTTAGAAATAATACT GATACTGGTCAAAAGGGAAAGATGTCTTTG GATGATGTGCACACACAGATCTGGACTCCAT GGAGTCTGGTAGATGCTAATGCATGGGGCT GTTGGTTTCAGCCAAGTGACTGGCAGTTTAT TCAAAACTCTATGGCTGAACTTAATCTT-3'。根据该序列设计特异性引物,上游引物序列:5'-CGCGGATCC ATGGCTGCTAGAGTTGAGAGAG-3',下游引物:5'-GCCCTCGAG TCAAAGATT AAGTTCAGCCATAG -3',下划线分别为BamH I和XhoI位点,斜体部分为保护性碱基。
1.3.2 VP2基因的扩增与克隆 以合成的基因为模板,特异性引物扩增VP2基因,1%琼脂糖凝胶电泳鉴定PCR反应产物。纯化后与pET30a载体连接,酶切鉴定正确后命名pET30a-VP2,重组质粒送至苏州金唯智公司进行测序。
1.3.3 重组蛋白的诱导表达与纯化鉴定 将测序正确的pET30a-VP2重组质粒接种于Kan+抗性培养基中,37℃培养至OD值达为0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG,37℃诱导约8 h。同时设pET30a载体为空白对照。于4℃离心收集细菌培养物,进行15% SDS-PAGE鉴定。确认表达后利用Ni-琼脂糖凝胶6FF(His标签纯化树脂)对表达产物进行纯化, 具体方法按说明书进行。纯化后产物进行SDS-PAGE和免疫印迹分析,用本实验室制备的VP2单克隆抗体作为一抗,二抗为HRP标记的羊抗鼠IgG,用ECL发光液显色。
1.4 小鼠阳性血清的制备纯化后的VP2蛋白与等体积完全弗氏佐剂混合并完全乳化,腹腔注射,50 μg/只免疫6周龄的Balb/c小鼠;7 d后二免,免疫途径、剂量同一免,用弗氏不完全佐剂;14 d后三免,不加佐剂,腹腔注射,50 ug/只。5 d后收集血清测抗体效价。
1.5 间接ELISA方法的建立
1.5.1 最佳抗原包被浓度和血清稀释度的确定 采用方阵滴定法将纯化的VP2重组蛋白用pH9.6的碳酸盐缓冲液按照1∶50、1∶100、1∶200、1∶400、1∶800、1∶1000、1∶2000、1∶4000的梯度稀释,每个稀释度包被一竖行,100 μL/孔,4℃包被过夜;次日弃液,TBST洗涤3次,5 min/次,甩干;5%脱脂奶粉37℃封闭2 h;弃脱脂奶,洗涤同上,甩干;小鼠阴阳性血清分别按照1∶200、1∶500、1∶1000、1∶2000、1∶4000、1∶8000、1∶16 000的梯度稀释,每个稀释度加一横行,100 μL/孔,37℃孵育60 min;洗板同上,甩干;加入羊抗鼠酶标二抗(1:5000),100 μL/孔,37℃孵育45 min;洗板同上,甩干;加入100 μL/孔TMB显色液,室温避光显色15 min;最后加入50 μL/孔2 mol/L H2SO4终止显色;酶标仪测定OD450。以P/N值最大的稀释度为抗原与血清的最佳稀释度。
1.5.2 临界值的确定 将经进口全病毒间接ELISA试剂盒判定为阴性的55份大鼠血清在最适反应条件下,按问接LISA程序进行测定,求出OD450平均值X和标准差SD。根据统计学原理,OD450≥ X+3SD时,判为阳性;OD450< X+3SD时,判为阴性。
1.5.3 交叉反应试验 以纯化重组蛋白作为抗原包被ELISA板,检测H-1、KRV阳性血清,确定重组抗原与其他大鼠病毒阳性血清是否发生交叉反应。
1.5.4 敏感性试验 将RPV毒株阳性血清按照1∶50、1∶100、1∶500、1∶1000、1∶2000、1∶4000、1∶8000的梯度稀释,检测建立的间接ELISA方法的灵敏度。
1.5.5 重复性试验 (1)批内重复试验:抽取血清样品10份,每份血清样品平行做5孔,用建立的间接ELISA方法检测,计算其变异系数。(2)批间重复试验:在相同的试验条件下,用2批重组VP2包被ELISA板,对10份血清进行ELISA检测,计算其变异系数。
1.5.6 样品检测 采用本试验建立的iVP2-ELISA方法对上海实验动物中心提供的165份待检血清进行检测,计算样品阳性率。
2 结果
2.1 VP2重组蛋白的表达与纯化鉴定将合成的VP2片段克隆入pET30a载体中,挑取测序正确的重组菌,经IPTG诱导表达,SDS-PAGE结果见图1A。0.5 mmol/LIPTG诱导的重组菌在20 kDa左右处可发现特异性的条带。经His镍柱纯化后可见明显的单一表达条带,纯化后的重组蛋白经Bradford法测定浓度为0.28 mg/mL。将纯化后产物和空载体菌转移至NC膜,利用本实验室制备的2E7单抗进行Western blot检测,结果图1B。在20 kDa左右,重组纯化蛋白具有明显的反应条带。
2.2 间接ELISA方法的建立
2.2.1 最佳抗原包被浓度和血清稀释度的确定 方阵实验结果表明,当抗原包被最佳稀释倍数为1∶1000(此时蛋白质量浓度为0.28 μg/mL)、待检血清以1∶2000稀释时,P/N值最大,结合阴阳性血清的OD450值,确定抗原最佳包被质量浓度为0.28 μg/mL(即28 ng/孔),血清最适稀释度为1:2000。
2.2.2 临界值的确定 用初步确定的条件,对55份(1∶100倍稀释)RPV阴性血清样本的OD450测定后计算得平均值X和标准差SD分别为0.263与0.079。计算出RPV VP2间接ELISA的判断标准:样本 OD450≥0.5为阳性;样本OD450<0.5为阴性。
2.2.3 交叉反应试验 采用iVP2-ELISA方法检测H-1、KRV阳性血清,结果见表1。结果表明, 上述血清均为阳性,说明制备的VP2抗原与上述病原存在一定的交叉反应。
2.2.4 敏感性试验 采用建立好的iVP2-ELISA方法检测不同稀释倍数的RPV阳性血清时,可看出当阳性血清稀释到2000倍时仍能检测到(表2),表明本实验建立的ELISA检测方法灵敏度较高。
2.2.5 重复性试验 (1)批内重复性试验:选取10份血清样品,用建立的VP2-ELISA进行5次批内重复检测,结果见表3。批内重复性试验的变异系数集中在2.175%~5.567%,表明建立的检测方法具有较好的重复性。(2)批内重复性试验:用建立的VP2-ELISA,取10份血清样品分别用3个不同批次包被的酶标板进行检测,结果见表4。3次检测的阴、阳性结果完全一致。

图1 SDS-PAGE和Western blot检测pET30a-VP2重组蛋白的表达与纯化Fig.1 Identi fication of the recombinant protein by SDSPAGE and Western blotting analysis
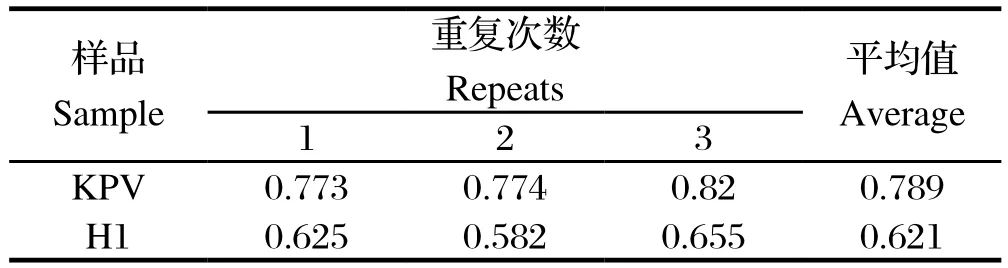
表1 交叉反应试验结果Table 1 The result of cross-reaction

表2 敏感性试验结果Table 2 The result of sensitivity test

表3 批内重复性试验结果Table 3 The result of intra-assay of indirect ELISA
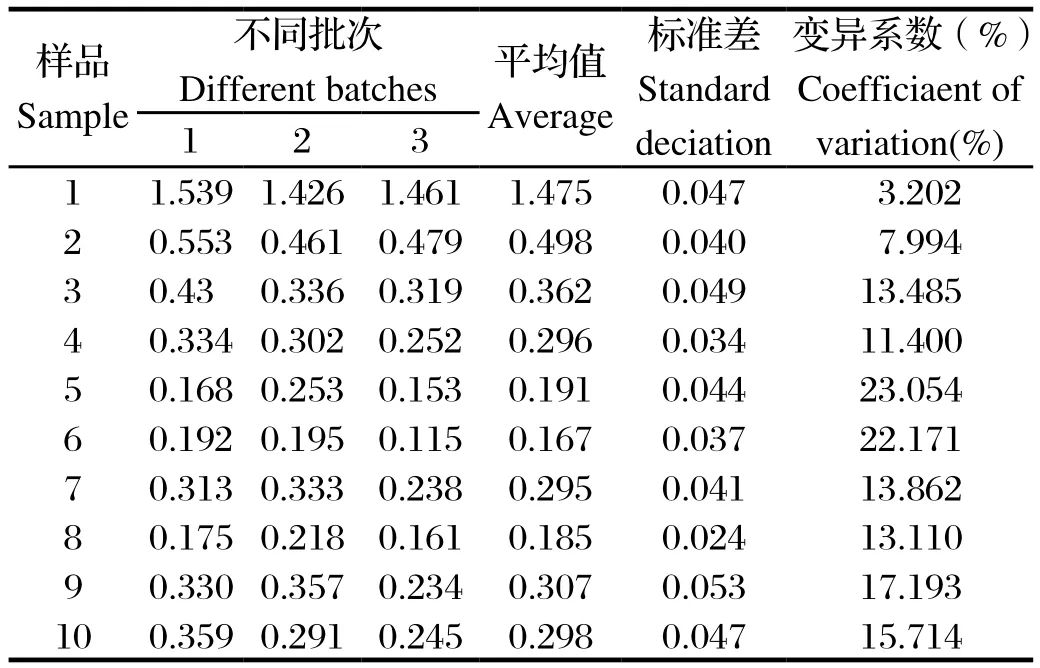
表4 批间重复性试验结果Table4 The result of inter-assay of indirect ELISA
2.2.6 样品检测结果 采用本试验建立的iVP2-ELISA方法对上海实验动物中心提供的165份待检血清进行检测,编号为31的样品为阳性,阳性率为0.61%。
3 讨论
RPV在鼠群中感染非常普遍,且可长期带毒,这给动物生产和动物实验带来了严重干扰。因此,研制一种操作简便、快速、敏感性高、特异性好,适用于检测大规模样品的ELISA诊断方法具有重要意义。
细小病毒的VP2蛋白是一种重要的结构蛋白,能诱导宿主产生免疫应答[8]。有报道显示,缺失VP2基因的猪细小病毒突变体均丧失了对宿主细胞的再感染性,而且VP2蛋白是PPV中和抗体的靶蛋白[9,10]。Ball-Goodrich 等[5]研究结果表明在RPV的感染过程中大鼠体内产生了抗VP2蛋白的特异性抗体。因此,VP2在诊断细小病毒的感染和对其进行免疫预防都具有重大意义。
本研究分析比对大鼠细小病毒RPV株、H-1株、KRV株、RMV和MVM株的VP2蛋白序列,原核表达了一段特异的RPV-VP2成熟肽,以纯化表达产物为抗原,建立间接ELISA方法。该方法在重复性和敏感性方面优于HI法, 且血清样品不需特殊处理和特殊设备,适于大批量样品的检测[11,12]。
但是,本研究也存在一定的不足,因为所选取的靶蛋白氨基酸序列与KRV、H-1、MVM和RMV株的同源性在70%~79%,所建立的iVP2-ELISA方法对于H-1和KRV株的阳性血清存在轻微的交叉反应。其次,以原核表达产物为包被抗原所建立的间接ELISA法极易受到原核表达系统中杂蛋白成分的干扰而产生假阳性结果,降低了方法的特异性。为弥补这些不足,本研究还在制备多株VP2单抗,拟在下一步将VP2单抗作为竞争抗体,建立检测大鼠细小病毒中和抗体的阻断ELISA检测方法。该方法能大大提高检测抗体的特异性,为大鼠细小病毒、大鼠微小病毒和细小病毒感染的鉴别诊断提供可靠的技术基础。

