四重荧光qRT-PCR检测猪腹泻相关病毒方法的建立
包雯骏,张 强,李树清,林颖峥,李 健,严亚贤
(1.上海交通大学农业与生物学院,上海200240;2.上海出入境检验检疫局,上海200135)
近年来,规模化猪场猪腹泻类疫病复杂程度日益增加,给养猪业造成了严重的经济损失,在世界范围内受到越来越多关注。猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)和猪delta冠状病毒(Porcine deltacoronavirus,PDCoV)同属于冠状病毒科(Coronaviridae),3种病毒均可引起以腹泻、呕吐,脱水、仔猪高死亡率为主要特征的高度接触性肠道传染病[1,2],此3种病毒感染引起的疫病是我国从国外引进种猪重点关注的腹泻类疫病。猪捷申病毒(Porcine teschovirus,PTV)是小RNA病毒科捷申病毒属成员,原属肠道病毒,可引起以猪脑脊髓灰质炎、母猪繁殖障碍、腹泻、心包炎、心肌炎、皮肤损伤等多症状为特征的病毒性传染病[3]。捷申病毒有13个血清型,而只有PTV-1引起的捷申病毒性脑脊髓炎在国际活动物贸易中受到关注,而其他血清型引起的腹泻等疫病常被忽略,研究证实国内猪场均存在广泛的PTV感染[4,5]。
PEDV、TGEV、PDCoV和PTV同属肠道类病毒,常混合感染,4种病毒在流行病学、临床症状上相似,临床鉴别困难。建立同时鉴别诊断这4种病毒的方法对猪腹泻性疫病病因确诊、流行病学调查、入境口岸检疫和疫病防控具有重要意义。多重荧光RT-PCR能够在同一反应体系中同时检测多个靶标基因,而且具有特异性强、灵敏度高、扩增时间短等优势,对于混合感染疫病,特别是具有相似临床症状和流行病学特征的疫病更具有重要的意义,在快速分子诊断方面拥有良好的应用前景。本研究利用四重荧光定量RT-PCR技术建立同时检测PEDV、TGEV、PDCoV和PTV的方法,为这4种病毒病的临床诊断及流行病学调查提供快速检测技术。
1 材料和方法
1.1 毒株及质粒猪流行性腹泻病毒(PEDV)、传染性胃肠炎病毒(TGEV)、猪捷申病毒(PTV)、猪呼吸道冠状病毒(Porcine respiratory coronavirus,PRCV)、猪轮状病毒(Rotavirus,RoV)、猪圆环病毒2型(Porcine circoviruses type 2,PCV2)、猪伪狂犬病毒(Pseudorabies virus,PRV)和带有PEDV N基因、TGEV S基因、PDCoV M基因和PTV 5'非编码区基因的标准质粒 pMD-PEDN、pMD-TGES、pMD-PDM和pMD-PT由本实验室保存;猪口蹄疫O型病毒(Foot and mouth disease virus,FMDV)灭活疫苗、猪细小病毒(Porcine parvovirus,PPV)疫苗、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)活疫苗和猪瘟病毒(Classical swine fever virus,CSFV)活疫苗购自商业化疫苗公司,疫苗毒核酸作为阳性检测样品。100份临床健康猪粪拭子采自华东地区三家猪场及两个国家进口种猪。
1.2 主要试剂和仪器磁珠法总核酸提取试剂盒购自Magen公司,dNTPs、RNA酶抑制剂、反转录酶(AMV)、Premix ExTaq(Probe qPCR)购自宝生物(大连)有限公司。Lifetechnologies ViiA7荧光定量PCR仪和Kingfisher 磁珠核酸提取仪(ML)购自Thermo fisher公司。
1.3 引物和探针根据GenBank中登录的病毒基因组信息,选取PEDV N基因、TGEV S基因、PDCoV M基因和PTV相对保守的5'非编码区基因作为靶标基因。分别使用Clustal W程序对基因序列进行比对,选取保守区域使用Beacon Designer 8.0软件设计和筛选四套简并引物和探针。PEDV探针5'标记ROX荧光基团,3'标记BHQ2基团;TGEV探针5'标记CY5荧光基团,3'标记BHQ3基团;PDCoV探针5'VIC标记R,3'BHQ1标记;PTV探针5'标记FAM荧光基团,3'标记BHQ1基团(见表1)。引物和探针由上海生工生物技术公司合成,配制成工作浓度为10 μmol/L-20℃保存备用。
1.4 标准曲线的绘制取pMD-PEDN、pMD-TGES、pMD-PDM和pMD-PT 4种标准质粒10 μL分别加入到含有90 μL TE 的1.5 mL EP管中,分别按照10倍梯度稀释到10-10。取其中5个稀释度作为标准模板,使用矩阵法优化引物和探针的浓度及退火温度,进行荧光qRT-PCR反应,计算循环阈值(Ct)并绘制标准曲线。
1.5 特异性试验应用建立起来的荧光qRT-PCR方法对PEDV、TGEV、PRCV、PTV、RoV、PCV2、PRV、CSFV、FMDV、PPV、PRRSV进行特异性试验。使用总核酸提取试剂盒按其说明提取总核酸,再进行逆转录获得cDNA备用。逆转录体系:5×AMV 缓冲液4 μL,dNTPs 2 μL,RNA酶抑制剂1 μL,反转录酶(AMV)1 μL,RNA模板 10 μL,其余用无Nuclease-Free Water补足20 μL。逆转录程序:42℃ 30 min,95℃ 10 min。
1.6 敏感性试验用10倍梯度稀释的4种标准质粒作为检测模板,按10-1~10-10稀释度混合模板进行四重荧光qRT-PCR敏感性试验,同时进行单一荧光qRTPCR敏感性比对验证。
1.7 临床样本检测对100份猪粪便样品使用磁珠法抽提总核酸,再进行逆转录获得cDNA保存备用。采用建立的四重荧光qRT-PCR对临床样本同时进行PEDV、TGEV、PDCoV和PTV检测,并设立阴阳性对照,当RT-PCR仪收集到明显扩增信号,出现特异性扩增曲线并且Ct≤35时判定为阳性;荧光信号不明显35<Ct≤40时判定为可疑,可疑样品需复检,复检结果仍35<Ct≤40判为阳性;无荧光信号判为阴性。同时使用单一荧光qRT-PCR进行检测。分别统计PEDV、TGEV、PDCoV和PTV的检出率,比较多重荧光qRT-PCR和单一荧光qRT-PCR的差异性。
2 结果
2.1 体系优化 使用矩阵法调整引物浓度(0.5 μL、1 μL和1.5 μL)、探针浓度(0.3 μL、0.5 μL和0.8 μL)和退火温度(54℃、56℃、58℃和60℃)对四重荧光qRT-PCR反应条件进行优化。最终确定的四重荧光qRT-PCR反应体系(40μL):Premix ExTaq(Probe qPCR)20 μL,4对上、下游引物各1 μL,4种探针各0.5 μL,4种标准质粒模板各1 μL,其余用ddH2O补足;若使用20 μL体系,各组分减半。四重荧光qRT-PCR最佳反应条件:95℃预变性5 min;95℃ 变性30 s、56℃退火 1 min,40个循环,退火阶段收集荧光信号。
2.2 标准曲线以10倍系列稀释的标准质粒为模板,选取5个稀释度,每个稀释度设定3个平行,通过四重荧光qRT-PCR进行检测,得到扩增曲线和标准曲线。模板稀释度在10-3~10-7内与Ct值呈现良好的线性关系。以标准质粒拷贝数为横坐标,Ct值为纵坐标绘制标准曲线,得到标准曲线(图1)。
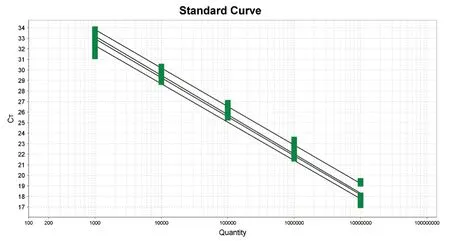
图1 PEDV、TGEV、PDCoV和PTV多重标准曲线Fig.1 Standard curve of PEDV, TGEV, PDCoV and PTV
2.3 特异性试验 应用建立起来的荧光qRT-PCR方法对PEDV、TGEV、PDCoV、PTV、PRCV、PCV-2、PRV、CSFV、FMDV、PPV、PRRSV基因组进行特异性检测。使用磁珠法提取总核酸,逆转录后进行荧光qRT-PCR检测,同时设置阴性对照,结果见图2。四重荧光qRT-PCR方法仅对PEDV、TGEV、PDCoV和PTV 4种病毒出现特异性扩增曲线,而阴性对照和其他病毒核酸均无Ct值,无特异性扩增曲线,表明本方法具有良好的特异性。
2.4 敏感性试验将10倍系列稀释的标准质粒通过本研究建立的四重荧光qRT-PCR方法进行检测,结果见图3。PEDV最低检出浓度为141拷贝/μL,TGEV为68拷贝/μL,PDCoV为8拷贝/μL,PTV为11拷贝/μL。单一荧光qRT-PCR时PEDV最低检出浓度为14.1拷贝/μL,TGEV为68拷贝/μL,PDCoV为8拷贝/μL,PTV为11拷贝/μL。
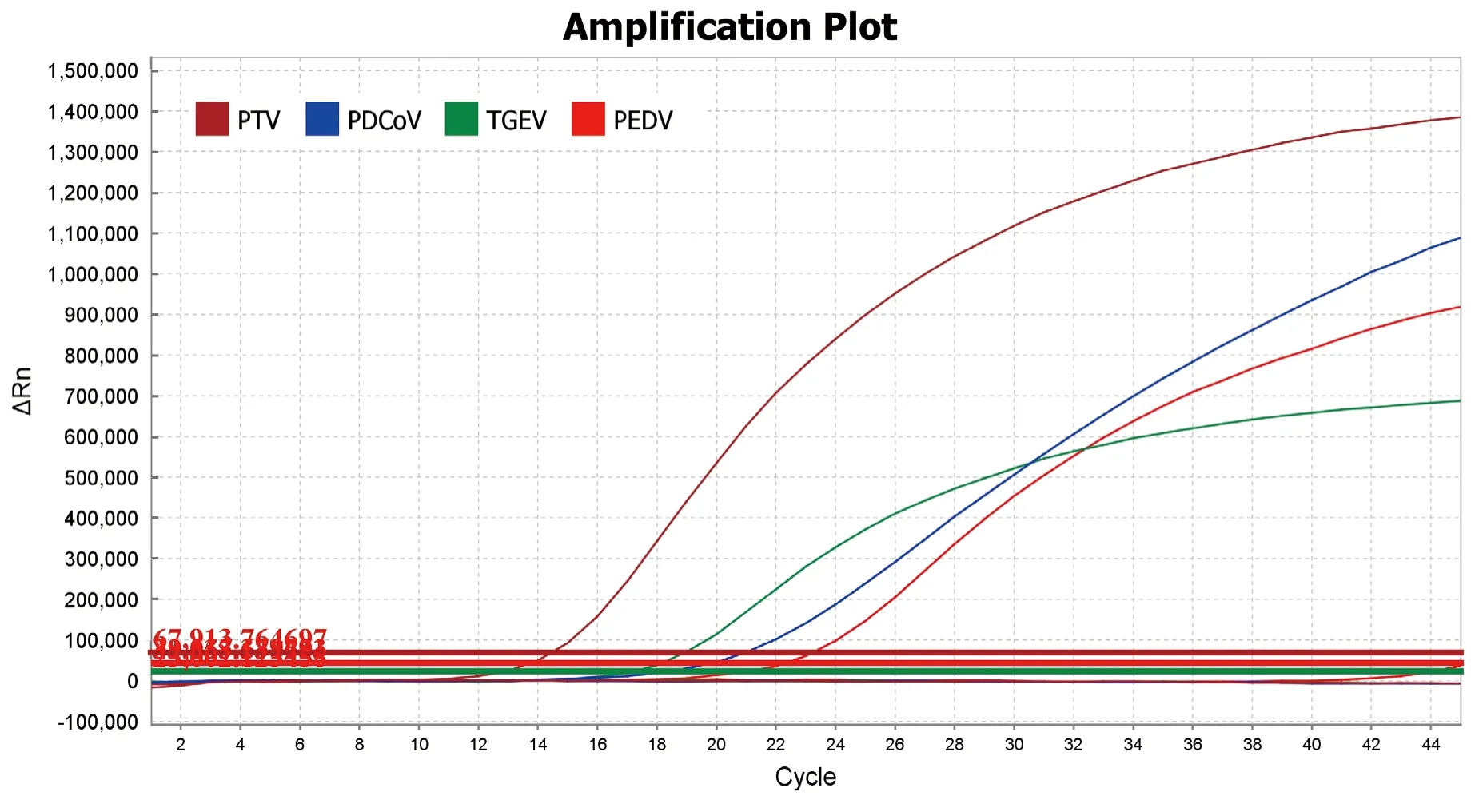
图2 PEDV、TGEV、PDCoV和PTV四重荧光qRT-PCR特异性结果Fig.2 Speci ficity vesults of qRT-PCR for PEDV, TGEV, PDCoV and PTV

图3 PEDV、TGEV、PDCoV和PTV四重荧光qRT-PCR敏感性结果Fig.3 Sensitivity results of qRT-PCR for PEDV, TGEV, PDCoV and PTV
2.5 临床样品检测分别使用建立起来的四重荧光qRT-PCR方法和单一荧光RT-PCR方法同时对100份粪拭子进行检测,阳性样品通过基因测序确认。四重荧光qRT-PCR方法PEDV、PTV、TGEV、PDCoV检出率分别为10%、6%、2%和55%;单一荧光RTPCR方法PEDV、PTV、TGEV、PDCoV检出率分别为8%、6%、2%和55%。从结果可以看出四重荧光RT-PCR方法与单一荧光RT-PCR相比,除PEDV检出率稍低外,其他三种疫病敏感性一致。国内猪场和进口种猪PTV总体检出率很高,达55%,有的猪场高达85%;国外进口种猪PEDV、TGEV和PDCoV均未检出。
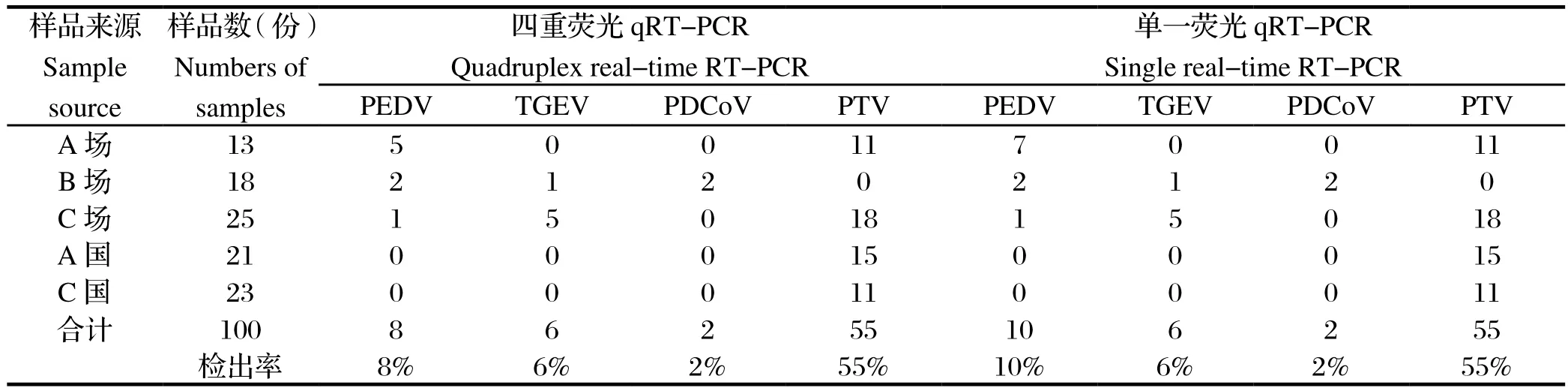
表2 临床粪拭子荧光qRT-PCR样本检测结果Table 2 The testing results using real-time RT-PCR for clinical fecal samples
3 讨论
近年,猪腹泻类疫病频繁发生,造成巨大经济损失,广受社会关注。国内外针对腹泻病原检测开展了一系列研究,主要针对传染性胃肠炎(TGEV)、流行性腹泻(PEDV)、猪delta冠状病毒(PDCoV)、轮状病毒(RoV)、捷申病毒(PTV)、博卡病毒、星状病毒等病原开展PCR或多重RT-PCR研究[6-9]。本研究选择PEDV、TGEV、PDCoV和PTV作为研究对象,考虑到重要猪腹泻类疫病诊断的同时,还兼顾进口种猪隔离检疫工作的实际需要。
本研究中使用TGEV S基因作为检测靶基因,主要是考虑TGEV与PRCV毒株的同源性很高,研究认为PRCV是TGEV的基因缺失突变物,最主要的差别在于PRCV在S基因缺失了621~681个nt[10,11]。PRCV在国内外的猪场感染很常见,PRCV可引起猪呼吸道亚临床感染或轻微的呼吸道症状,不随粪便排出,一般认为PRCV单独作为病原的意义不大。因此,不管是病原学方法还是血清学方法诊断技术,尤其在对隔离检疫的外表健康动物实施检疫的过程中,区分TGEV和PRCV感染非常重要。本研究针对TGEV的引物探针是基于PRCV S基因缺失的核苷酸设计,确保检测到的基因来自TGEV毒株,而不是其突变物PRCV。
探针荧光PCR技术跟常规PCR相比,特异性更强,敏感度更高,还可对样本进行精确定量,目前在临床疫病诊断上已得到广泛应用。但受荧光PCR设备光学通道、荧光基团可检测波长以及引物探针错配等因素影响,目前的技术条件下,多重荧光PCR易受干扰,尤其是四重以上的PCR方法,难以形成敏感性、特异性俱佳的技术方案。本研究是首次使用四重荧光qRT-PCR技术建立了猪腹泻类病原检测方法。建立的四重荧光qRT-PCR方法,特异性好,仅可特异性检出PEDV、TGEV、PDCoV和PTV,不会检出其他猪病毒性病原;最低核酸检测线分别为141拷贝/μL、68拷贝/μL、8拷贝/μL和11拷贝/μL,灵敏性较高。使用该方法对采集的100份临床健康猪粪拭子进行检测,共检出PEDV阳性样品10例、TGEV阳性6例、PDCoV阳性2例和PTV阳性55例,说明本研究建立的四重荧光RT-PCR方法可用于临床样品的检测诊断。而且本研究建立的四重荧光qRT-PCR方法与单一荧光qRTPCR相比,敏感性并未大幅降低,更加快捷简便。目前我国国外进口种猪的原农场生物安全管理措施有效,PEDV、TGEV和PDCoV等常见腹泻病原均未检出;PTV血清型较多,国内猪场感染率也很高,进口种猪检出率高,而未发现PTV-1引起的捷申病毒性脑脊髓炎。
本研究为PEDV、TGEV、PDCoV和PTV 4种猪腹泻类病毒的检测诊断、流行病学调查和疫病防控提供了有效技术方法,对疫病快速诊断、防止疫情扩散和维护国门生物安全有较大的应用价值。

