不同颜色花生种皮色素提取工艺研究
林 茂,赵景芳,郑秀艳,孟繁博,李国林,黄道梅,陈 曦,蒋 力
(贵州省现代农业发展研究所/贵州省农产品加工研究所,贵州 贵阳 550006)
花生(ArachishypogaeaL.)是豆科作物,最早起源于南美洲热带和亚热带地区,约16世纪初由葡萄牙人传入我国,在19世纪末期得到了空前发展[1]。迄今,全世界已有100多个国家种植花生,总种植面积超过2000万公顷,主要分布于亚洲、非洲和美洲,而欧洲和大洋洲仅有零星种植[2]。2017年我国花生种植面积540万hm2[3],产量预计为20 Mt,其中接近50%的花生用于榨油,加工过程中必然会产生花生外壳和种皮等副产物,全世界每年约有750 kt花生种皮产生[4],而我国约有600 t。在我国,花生种皮中只有少部分被用来制药,大部分均被当作饲料使用,造成资源极大浪费[5]。花生种皮中除了含有多种营养成分外,还富含白藜芦醇、原花色素、花色苷等多种生理活性成分,具有清除自由基、抗癌、降血压等作用[6-10]。对花生种皮进行深入的研究,将其多种活性成分分离提取出来应用于其他相关领域,不仅可提高花生的综合利用价值,而且可变废为宝,增加花生的经济价值,增加农民的收入。
花生种皮色素和其他植物色素的提取方法一样,主要有溶剂提取、超声波提取、微波提取、超临界提取等[11-13]方法,其中溶剂提取法是最常用的。本研究针对粉红色和紫黑花生种皮色素的提取,采取单因素和响应面设计进行提取工艺优化,为不同种皮花生色素的提取工艺优化和利用奠定基础。
1 材料与方法
1.1 材料、试剂与仪器设备
1.1.1 材料
2种不同种皮颜色花生由贵州省农业科学院农作物品质资源研究所提供,分别是种皮颜色为粉红色的铜仁珍珠花生和种皮颜色为紫黑色的紫魁花生;2种试验花生全部在贵州省农业科学院试验地种植繁殖。种植方式:每个材料种植30行,每行10穴,行距40 cm,穴距18 cm,双粒播种,小区设3个重复,田间采用相同管理。待花生成熟后,两端除去边际效应的两穴,其余材料全部收获。收获的材料自然晾干(水分含量<10%),除去外壳表层杂质,选取果形大小和成熟度一致的荚果,装入密封玻璃瓶中,置于低温低湿种子柜中(温度5~8℃、湿度40%~50%)密封保存备用。
1.1.2 试剂
乙醇、甲醇、甲酸为国药集团化学试剂有限公司生产;抑制超氧阴离子试剂盒、总抗氧化性试剂盒和抑制羟自由基试剂盒为南京建成生物工程研究所生产。
1.1.3 仪器设备
FA2004分析天平:上海精密科学仪器公司;UV-2600紫外可见分光光度计:上海科学仪器有限公司;ModulyoD真空冷冻干燥器:Thermo Fisher公司;RE-52C旋转蒸发仪:上海亚荣生化仪器厂;SHZ-Ⅲ循环水多用真空泵:上海亚荣生化仪器厂;TYS-100粉碎机:浙江永康市红太阳机电公司;HH-6恒温水浴锅:江苏智金富华仪器有限公司。
1.2 方 法
1.2.1 花生种皮制备
参考曹凯光等[5]关于花生种皮制备方法,首先将花生籽仁经50℃烘干,人工剥离种皮后用粉碎机粉碎,放置4℃冰箱备用。
1.2.2 色素得率的计算
花生种皮在相应提取方法下提取色素,提取液浓缩后真空冷冻干燥,称质量。按下列公式计算色素得率:

式中m种皮为种皮质量,m色素为真空冷冻干燥后色素的质量。
1.2.3 提取溶剂筛选
考察乙醇、水、甲醇和丙酮对花生种皮色素提取的影响,以色素得率为指标筛选出最适提取溶剂,固定提取时间70min,料液比1∶50,温度60℃。
1.2.4 单因素实验
依据提取溶剂筛选结果,选择乙醇为最适提取溶剂,考察不同乙醇浓度(20%、30%、40%、50%、60%、70%、80%)、不同提取温度/℃(30、40、50、60、70、80)、不同提取时间/min(40、60、80、100、120、140)和不同料液比/mL(100、200、300、400)对色素得率的影响,提取液浓缩后真空冷冻干燥,称质量。每组实验重复3次。
1.2.5 Box-Behnken响应面优化实验
根据单因素试验得到的结果,设计响应面试验对色素提取工艺进行优化。紫魁花生种皮色素提取条件的优化:在单因素实验的基础上,根据Box-Behnken中心组合设计的实验原理[14],选取对色素得率影响较大的乙醇浓度(A1)、提取温度(B1)、提取时间(C1)、料液比(D1)4个因素为变量,每一个自变量取高(1)、中(0)、低(-1)三个水平进行编码,以色素得率为响应值(Y紫魁),进行四因素三水平共29个实验点的响应面分析实验,对紫魁花生种皮色素的提取工艺进行优化,因素水平编码见表1。
铜仁珍珠花生种皮色素提取条件的优化:在单因素实验的基础上,根据Box-Behnken中心组合设计的实验原理,选择对色素得率具有显著影响的乙醇浓度(A2)、温度(B2)、时间(C2)、料液比(D2)4个因素为变量,每一个自变量取高(1)、中(0)、低(-1)三个水平进行编码,以色素得率为响应值(Y铜仁珍珠),进行4因素3水平共29个实验点的响应面分析实验,对铜仁珍珠花生种皮色素的提取工艺进行优化,因素水平编码见表2。
1.2.6 试验数据处理方法
试验结果以均值±标准误差表示。用SPSS 19.0统计软件进行方差分析,Origin 8.1软件画图。
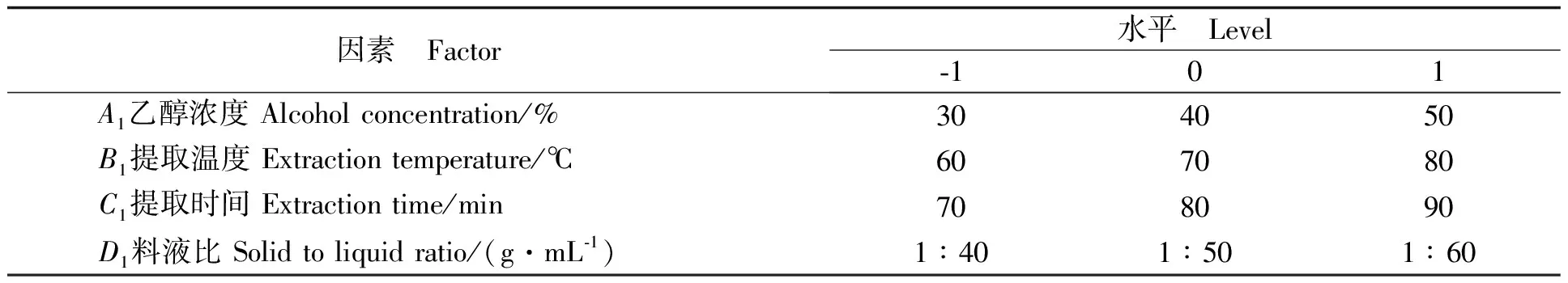
表1 紫魁花生种皮色素响应面实验因素水平编码表
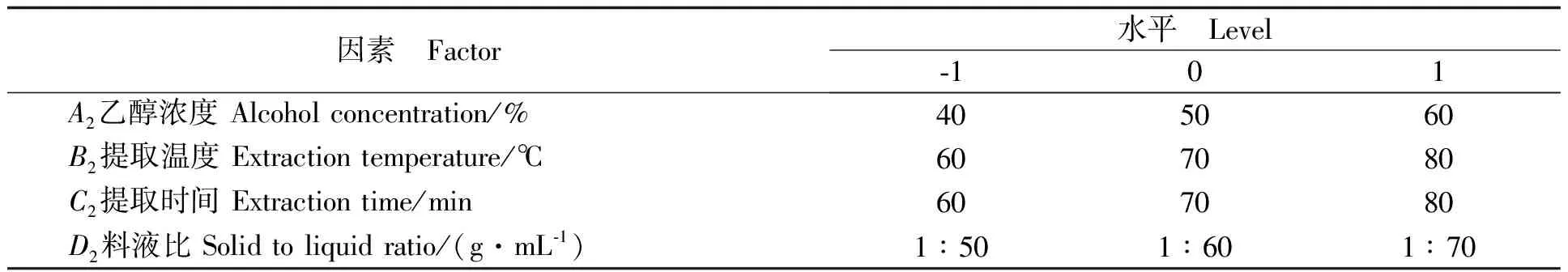
表2 铜仁珍珠花生种皮色素提取响应面实验因素水平编码表

图1 不同提取溶剂对花生种皮色素得率的影响Fig.1 The effect of solvents on pigments extraction rate
2 结果与分析
2.1 不同提取溶剂对花生种皮色素提取的影响
分析了水、乙醇、甲醇和丙酮作为提取溶剂提取花生种皮色素的影响(图1),结果表明,不同提取溶剂对种皮色素的提取具有一定差异。水作为提取溶剂时,色素得率最低,而甲醇、丙酮和乙醇作为溶剂时,差异不明显,从安全性和环保角度考虑,选用乙醇作为最适提取溶剂。刘大川等[15]的原花色素的提取试验中,提取溶剂的选择也有相同的结论。
2.2 不同提取因素对花生种皮色素提取效果的影响
通过分析不同乙醇浓度、提取温度、提取时间和料液比对色素得率的影响(图2),结果表明,紫魁花生种皮色素提取中可知,乙醇浓度为30%~60%的色素得率明显高于20%、70%,组间显著性差异分析同样表明,乙醇浓度为30%、40%、50%、60%与20%、70%具有显著性差异,综合考虑选择乙醇浓度范围为30%~50%;提取时间范围设置为40、60、80、100、120、140 min。从图中提取时间的考察数据显示,80~140 min时色素得率较高,组间差异性分析表明60 min和80 min之间存在显著性差异,而80~140 min之间没有显著性差异,因此,选择提取时间范围为70~90 min进行响应面试验设计进行工艺优化;从图2中提取温度对紫魁花生种皮色素提取得率的影响可知,70 ℃和80 ℃的提取效果最佳,并且与60 ℃具有显著性差异,因此选择提取温度范围为60~80 ℃进行响应面试验优化;从料液比对色素提取效果的影响看,1∶60的提取效果最佳,并且1∶60与1∶40和1∶80具有显著性差异,从节约提取溶剂方面考虑,选择料液比范围为1∶40~1∶60。铜仁珍珠花生的种皮色素提取工艺中可知,乙醇浓度为50%的色素得率明显高于其他浓度,组间差异性分析也表明50%乙醇浓度提取色素得率与40%和60%具有明显差异,综合考虑选择乙醇浓度范围为40%~60%;提取时间/min 范围设置为40、60、80、100、120、140。从图中提取时间的考察数据显示,80 min时色素得率较高,组间差异性分析表明60 min与80 min之间没有显著性差异,但是80 min与40 min之间存在显著性差异,因此,选择提取时间范围为60~80 min进行响应面试验设计进行工艺优化;从图2中提取温度对铜仁珍珠花生种皮色素提取得率的影响可知,70 ℃和80 ℃的提取效果最佳,并且与60 ℃具有显著性差异,因此选择提取温度范围为60~80 ℃进行响应面试验优化;从料液比对色素提取效果的影响来看,1∶80的提取效果最佳,并且1∶80与1∶60和1∶100具有显著性差异,从节约提取溶剂方面考虑,选择料液比范围为1∶50~1∶70。

图2 单因素试验结果Fig.2 Result of single factor test
2.3 不同种皮颜色花生种皮色素提取响应面试验设计及结果
2.3.1 紫魁花生种皮色素提取响应面设计及结果
在单因素试验结果的基础上,选择乙醇浓度30%~50%(A1)、提取温度60~80℃(B1)、提取时间70~90min(C1)和料液比1∶40~1∶60g/mL(D1)4个因素为变量,以色素得率为响应值,采用Box-Behnken的中心组合试验设计原理,设计四因素三水平试验优化紫魁种皮色素提取条件。响应面试验方案及结果见表3,方差分析见表4。
利用Design Expert 8.0.6.1软件处理所得数据[16],得到紫魁种皮色素提取预测的二次多元回归模型为:Y紫魁=0.418-0.042A1+0.17B1+0.39C1+0.17D+0.075A1B1+0.15A1D1+0.32B1C1-0.15B1D1-0.10C1D1-0.70A12-0.66B12-0.90C12-0.34D12。
由表4可知,模型p<0.0001,F=53.15>F0.01(14,4)=14.24,表明该模型极显著;模型的R2=98.15%,说明该模型可以预测98.15%响应值的变化;变异系数(CV)反映模型的置信度,CV值越低模型的置信度越高,本研究中的CV值为4.02%,说明模型方程能够较好地反映真实的实验值;铜仁珍珠种皮色素提取模型的信噪比(Adeq Precision)为23.640>4,说明模型可以用于实际预测;失拟项p=0.1752>0.05,F=2.70
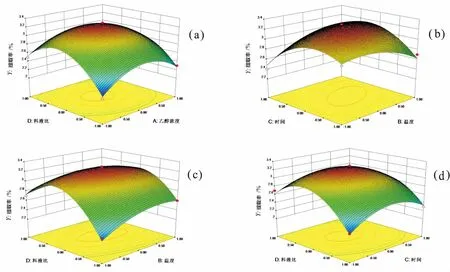
根据回归模型作出相应的响应曲面图(图3),曲面图的形状可反应出因素间交互作用对色素得率的影响,曲面越陡峭,影响越显著,拟合的响应面图和等高线图比较直观地反映了各因素间的交互作用。等高线的形状反映出交互效应的大小,圆形表示两因素交互作用不显著,椭圆形则表示两因素交互作用显著。等高线的颜色变化也能反映交互效应的强弱大小,颜色对比强烈,说明交互作用显著。此外,响应面最高点与对应等高线的最小椭圆中心点即极值点,而且回归方程中的系数有正有负,说明存在极大值点[19]。图3a中可看出,乙醇浓度与料液比的交互作用显著,图3b中可看出提取温度与提取时间的交互作用极显著,图3c可看出温度与料液比的交互作用显著。
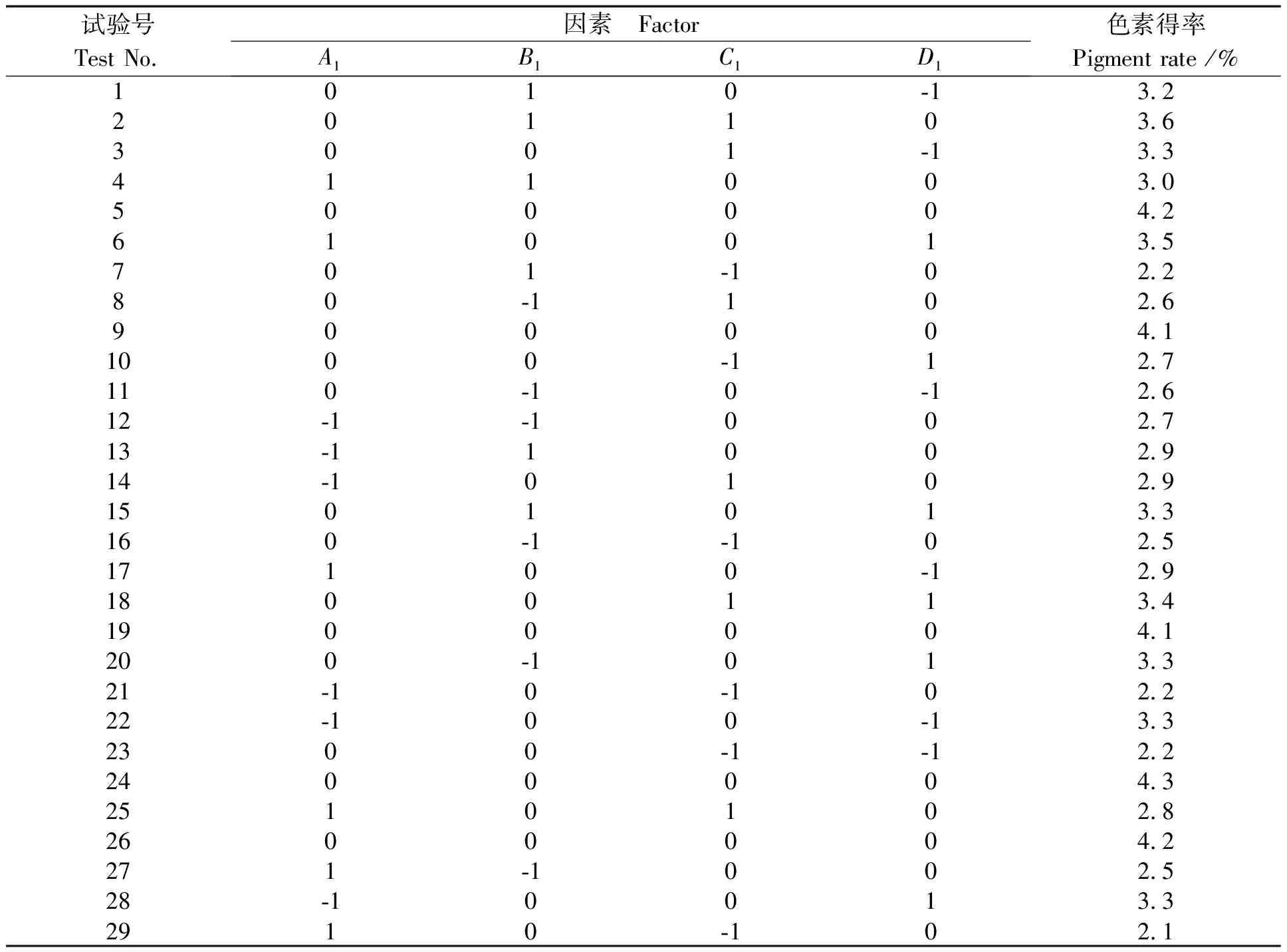
表3 紫魁种皮色素提取响应面试验设计结果
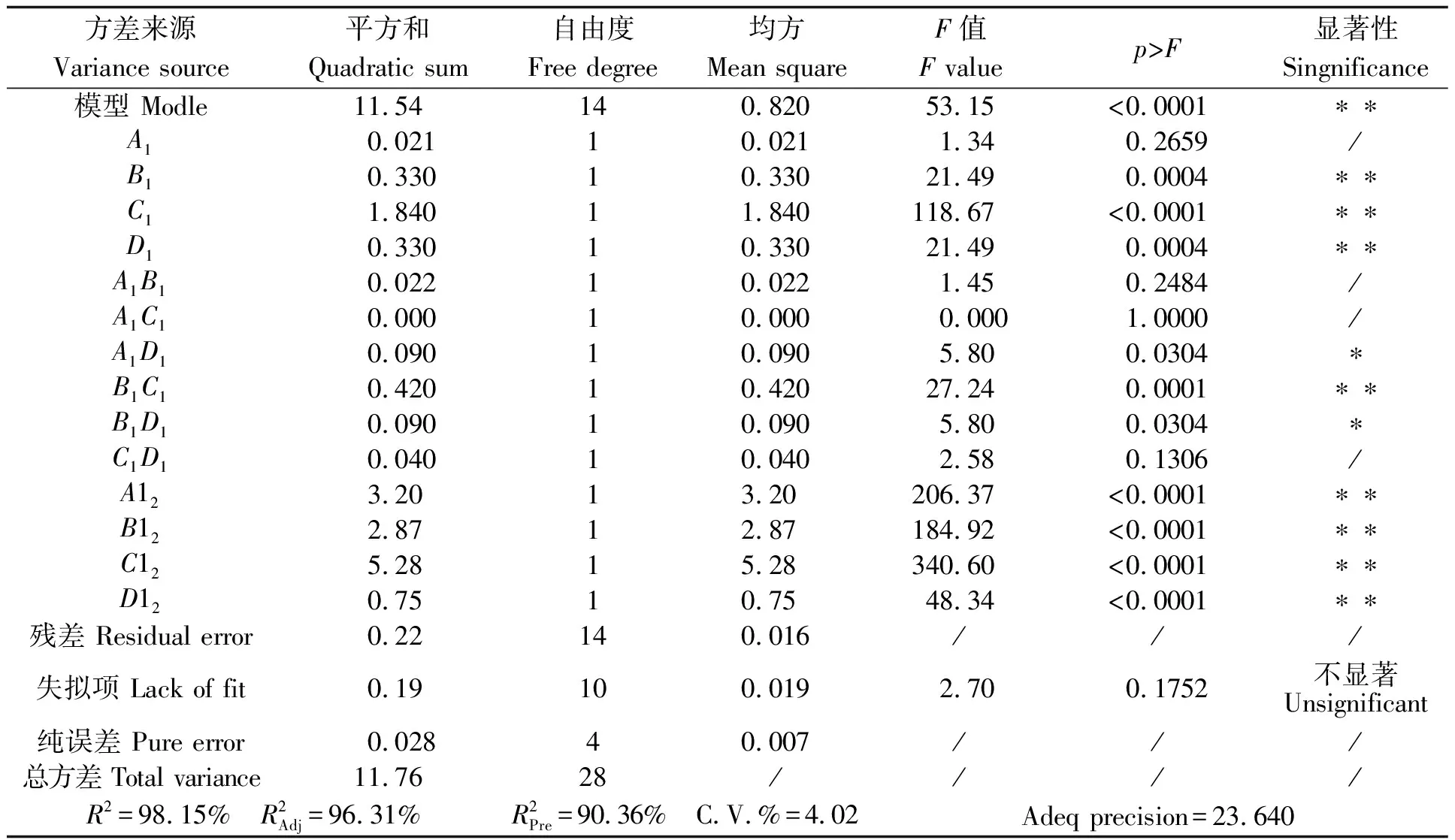
表4 紫魁种皮色素提取响应面结果方差分析
注:**表示差异极显著(p<0.01),*表示差异显著(0.01 Note: ** indict significance of difference atp<0.01, and * indict significance of difference at 0.01 图3 紫魁种皮色素提取条件中各因素的交互作用影响的响应面图Fig.3 The interactive effects among the factors of pigments extraction of ZiKui peanut skin 根据二次多元回归模型,优化得到紫魁种皮色素提取的最佳工艺条件为:乙醇浓度39.98%、提取温度71.64 ℃、提取时间84.74 min、料液比1∶53.48,在该条件下,依据模型,预测紫魁种皮色素得率为4.25%。为便于实际试验操作,将紫魁种皮色素得率的最佳工艺条件修正为:乙醇浓度40%、提取温度72 ℃、提取时间85min、料液比1∶54,在此条件下紫魁种皮色素得率为4.18%,与理论值4.25%相比,相对误差为1.67%。因此,通过采用响应面法来优化紫魁种皮色素的提取条件,所得最佳工艺参数准确可靠。 2.3.2 铜仁珍珠花生种皮色素提取响应面设计及结果 表5 铜仁珍珠种皮色素提取响应面试验设计及结果 表6 铜仁珍珠种皮色素提取响应面结果方差分析 在单因素试验结果的基础上,选择乙醇浓度40%~60%(A2)、提取温度60~80℃(B2)、提取时间60~80min(C2)和料液比1∶50~1∶70(D2)4个因素,以色素得率为响应值,采用Box-Behnken的中心组合试验设计原理,设计四因素三水平试验优化铜仁珍珠花生种皮色素提取条件。响应面试验方案及结果见表5,方差分析见表6。 利用Design Expert 8.0软件处理所得数据,得到色素得率预测的二次多元回归模型为:Y铜仁珍珠=3.24-0.03A2+0.05B2-0.025C2+0.12D2-0.025A2B2-0.025A2C2-0.075A2D2+0.20B2C2-0.13B2D2-0.10C2D2-0.37A22-0.16B22-0.32C22-0.54D22。 表6可知,模型p<0.0001,F=46.58>F0.01(14,4)=14.24,表明该模型极显著;R2=97.90%,说明该模型可以预测97.90%响应值的变化;变异系数(CV)反映模型的置信度,CV值越低模型的置信度越高,本研究中的CV值为2.2%,说明模型方程能较好的反映真实的实验值;铜仁珍珠种皮色素提取模型的信噪比(Adeq Precision)为25.829>4,说明模型可用于实际预测;失拟项p=0.2989>0.05,F=1.81 图4 铜仁珍珠花生种皮色素提取条件中各因素的交互作用Fig.4 The interactive effects among the factors of pigments extraction of Tongren peanut skin 根据回归模型作出相应的响应曲面图。分析了乙醇浓度和料液比交互作用的响应曲面图(图4a),从其等高线可以直观的看出两因素的交互作用显著,等高线沿料液比轴变化相对密集,说明料液比对色素得率的影响比乙醇浓度大;分析了提取时间和提取温度交互作用的响应曲面图(图4b),从其等高线可以直观的看出两因素的交互作用显著,等高线沿温度轴变化相对密集,说明提取温度对色素得率的影响比时间大;分析了提取温度和料液比交互作用的响应曲面图(图4c),从其等高线可以直观地看出两因素的交互作用显著,等高线沿料液比轴变化相对密集,说明料液比对铜仁珍珠花生种皮色素得率的影响比提取温度大;分析了料液比和提取时间交互作用的响应曲面图(图4d),从其等高线可以直观地看出两因素的交互作用显著,等高线沿料液比轴变化相对密集,说明料液比对色素得率的影响比提取时间大。 根据二次多元回归模型,优化得到铜仁珍珠花生种皮色素提取的最佳工艺条件为:乙醇浓度49.76%、提取温度71.06 ℃、提取时间69.59 min、料液比1∶61.99,在该条件下,模型预测色素得率为:3.24%。为便于实际试验操作,将铜仁珍珠花生种皮色素的最佳工艺条件修正为:乙醇浓度50%、提取温度71℃、提取时间70min、料液比1∶62。在此条件下测得种皮色素得率为3.19%,与理论值3.24%相比,相对误差为1.54%。因此,进一步证实采用响应面法优化铜仁珍珠花生种皮色素的提取条件,所得最佳工艺参数准确可靠。 实验通过单因素试验和响应面优化试验,确定了铜仁珍珠花生和紫魁花生种皮色素溶剂提取的最佳工艺。紫魁花生种皮色素最佳提取工艺为:乙醇浓度40%、提取温度72 ℃、提取时间85 min、料液比1∶54,在此提取条件下色素得率为4.18%;铜仁珍珠花生种皮色素最佳提取工艺为:乙醇浓度50%、提取温度71 ℃、提取时间70 min、料液比1∶62,在此提取条件下色素得率为3.19%。结果显示,紫黑色花生种皮和粉红色花生种皮色素提取工艺条件有一定差异,且紫黑花生种皮色素含量较粉红色花生种皮色素高。


3 讨论与小结

