“圆头”和“尖头”两种典型蛹虫草主要农艺特征比较
刘敏祥,鲍大鹏,何华奇,王 荣,汪 滢*
(1国家食用菌工程技术研究中心,农业部南方食用菌资源利用重点实验室,上海市农业遗传育种重点实验室,上海市农业科学院食用菌研究所,上海201403;2 安徽科技学院农学院,凤阳233100)
蛹虫草[Cordycepsmilitaris(Fr.)Link]又名北虫草或北冬虫夏草[1],因具有较高的药用价值,在国家食品药品监督管理局注册的蛹虫草保健食品目前已有40多种[2]。据中国食用菌协会统计,2015年度我国蛹虫草产量达到7.4万t。由于相应的质量分级标准还没有出台,消费者往往依据一些表观指标来衡量蛹虫草子实体的价值。
市售蛹虫草根据外观形态可以分成“圆头”和“尖头”两种类型,消费者通常认为“圆头”蛹虫草营养和药用价值高,因而相应的价格也高;而认为“尖头”蛹虫草营养和药用价值低,价格也相对便宜[3]。现有研究表明,蛹虫草属于二极性异宗配合真菌,只有不同交配型的单孢菌株混合培养才能产生含子囊壳和子囊孢子的成熟子座,但部分单孢菌株或者同一交配型的混合单孢菌株也能产生无子囊壳的子座[4-9],分别对应市场上“圆头”和“尖头”的蛹虫草。
蛹虫草的交配型由同源异型基因MAT-alpha和MAT-HMG控制。MAT-alpha基因包含两个连锁的交配型基因MAT1-1-1和MAT1-1-2;MAT-HMG基因仅含有一个交配型基因MAT1-2-1[4]。通过鉴定MAT1-1-1和MAT1-2-1基因的有无就可确定蛹虫草交配型。已有研究表明,培养条件[10-13]和菌落表型特征[14]均影响蛹虫草虫草素和腺苷的含量。尽管人工培养条件和菌落表型特征都影响蛹虫草虫草素和腺苷含量,但子实体的交配型与产量及主要活性物质含量的关系未见报道。本试验以收集的46株蛹虫草菌株为材料,通过PCR鉴定交配型,并分析“圆头”和“尖头”两种典型蛹虫草主要的农艺特征,以期为开展蛹虫草育种和质量检测提供科学依据。
1 材料与方法
1.1 供试菌株
本试验共收集46株蛹虫草菌株,主要来源为辽宁、山东、江苏等地,所有材料均由上海市农业科学院食用菌研究所菌种保藏中心保存。
1.2 供试培养基
PDA培养基:土豆(去皮)200 g、葡萄糖20 g、琼脂18 g、水1 000 mL;沙氏液体培养基(美国BD公司):沙氏培养基3 g、水100 mL;大米培养基:大米30 g、蚕蛹粉0.6 g、水45 mL。
1.3 蛹虫草交配型鉴定
蛹虫草交配型分子鉴定参考前期研究[15],PCR反应体系(20 μL):Mix 10 μL,引物(表1)各1 μL,模板DNA 1 μL,ddH2O 7 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55—60 ℃(温度根据引物Tm确定)退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳检测。

表1 蛹虫草交配型基因检测引物
1.4 蛹虫草栽培方法
在46株蛹虫草平板边缘处取绿豆大小菌块接入摇瓶液体培养基中,于25 ℃、150 rmin摇床培养10 d,无菌滤纸过滤得到孢子液,接种于大米培养基中,每瓶接入孢子液5 mL,每个菌株重复3瓶。25 ℃避光培养10 d,之后移入光照培养箱(10 h光照24 ℃,14 h黑暗22 ℃,湿度85%—90%)培养,直至采收[16]。
1.5 蛹虫草农艺品质测定
待蛹虫草子实体顶端膨大,不再增长,采下全部子实体统计单瓶鲜重,再于55 ℃干燥箱中烘6 h,取出称干重。生物转化率=子实体干重培养料鲜重×100%。
自接种日起至原基形成的天数即原基期时间,自接种日至采收时的天数即栽培周期。
2 结果与分析
2.1 蛹虫草菌株交配型鉴定结果
蛹虫草菌株交配型鉴定结果与其子实体“圆头”和“尖头”外观表型完全对应,分子鉴定含有两种类型交配型基因的菌株其子实体顶端膨大,表面覆盖毛刺即子囊壳,市场称之为“圆头”蛹虫草(表2、图1A);而鉴定含有一种类型交配型基因的菌株其子实体顶端较尖细,表面光滑无子囊壳,市场称之为“尖头”蛹虫草(表2、图1B)。
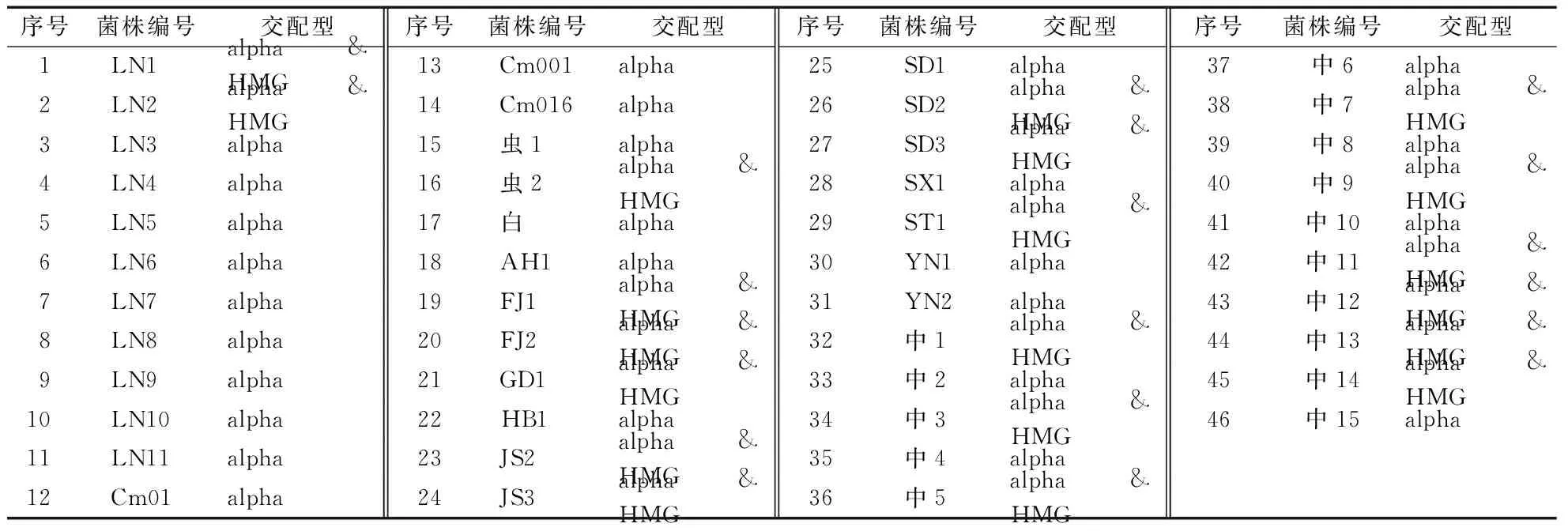
表2 蛹虫草菌株的交配型

图1 两种典型蛹虫草 Fig.1 Two typical C.militaris
2.2 不同表型蛹虫草农艺特征分析
2.2.1 生长周期
参试46株菌株中有13株培养至80 d仍未形成原基和子实体,故仅统计33株可形成子实体的蛹虫草农艺性状(图2)。“圆头”(双交配型)蛹虫草平均原基期为17 d,栽培周期大多在65—70 d;而“尖头”(单交配型)蛹虫草平均原基期为19 d,栽培周期一般为70—75 d。SD2和FJ1两株双交配型菌株(“圆头”型)不仅原基期最短,栽培周期也仅55 d;而“尖头”蛹虫草的栽培周期最短为62 d(中15)。
2.2.2 生物量
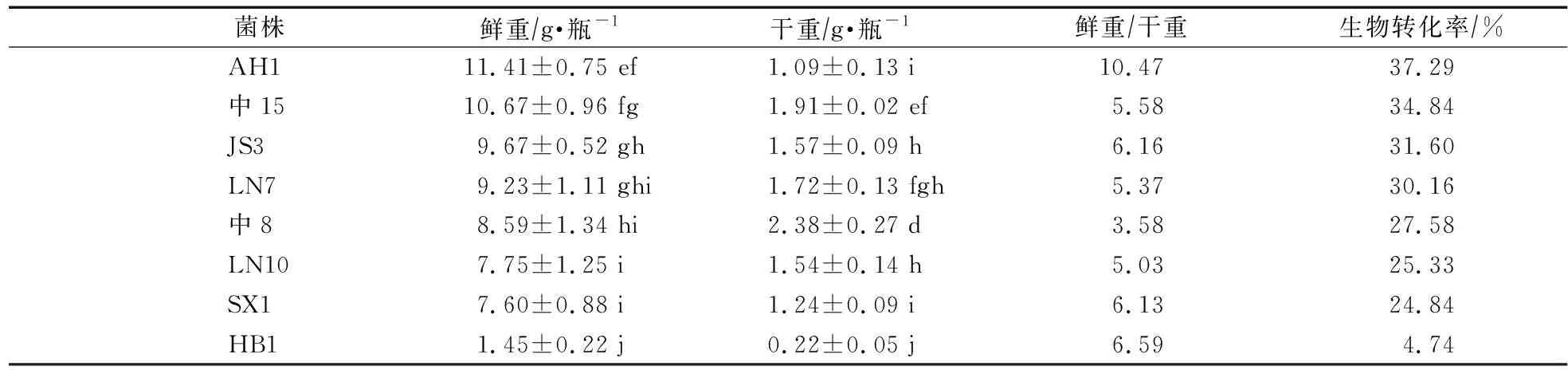
不同蛹虫草菌株其子实体产量相差较大,单瓶鲜重为1.45—18.96 g,生物转化率4.74%—61.96%,单瓶干重为0.22—3.22 g,子实体鲜重和干重比为3.58—10.47,可见不同蛹虫草子实体含水量差异较大(表3)。“圆头”蛹虫草中,GD1菌株单瓶鲜重最高,但干重却显著低于FJ1菌株;“尖头”蛹虫草中,LN8菌株鲜重和干重均最高,但与LN4、LN5菌株没有显著差异。
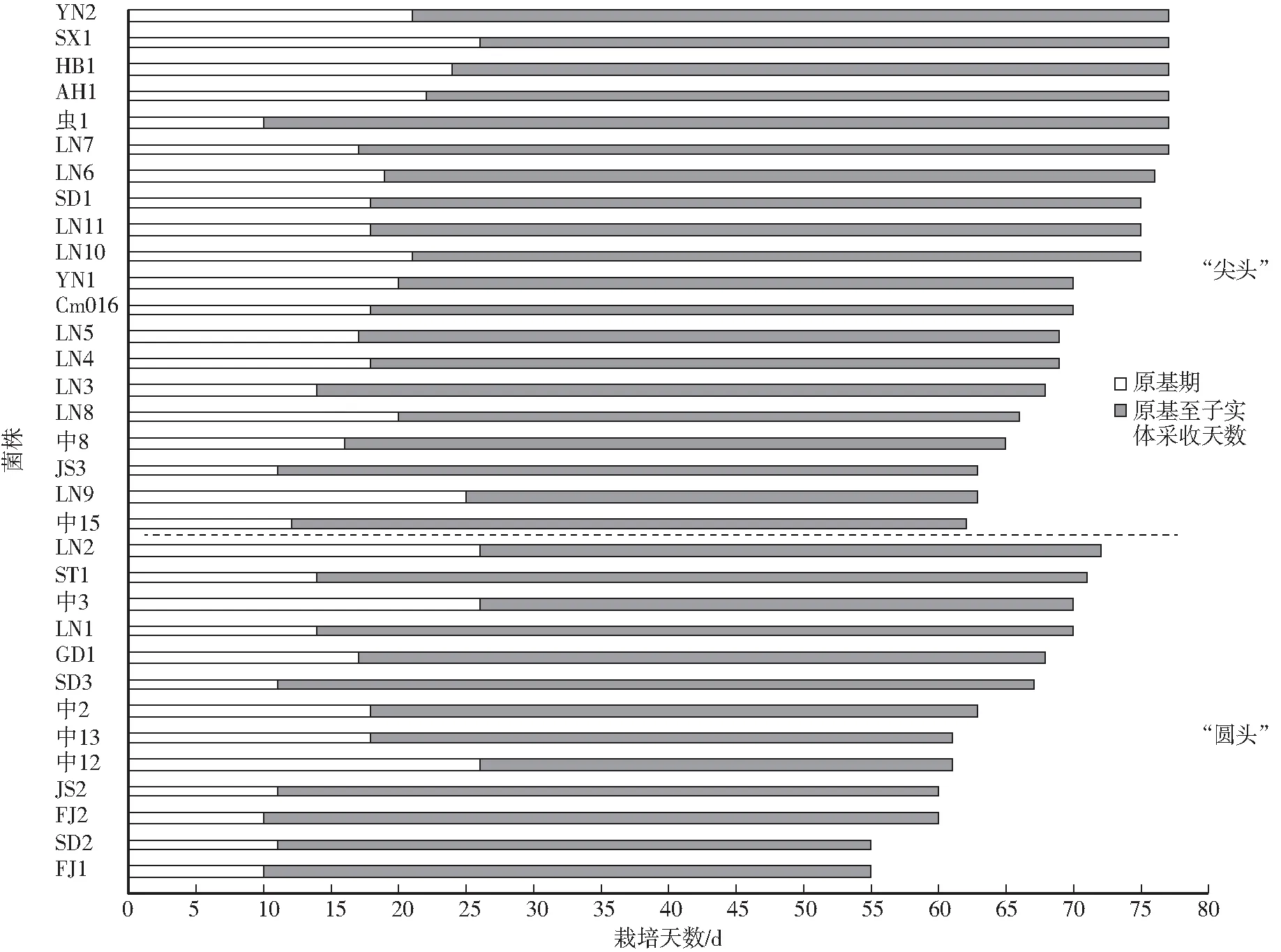
图2 不同交配型蛹虫草栽培周期Fig.2 The culture cycle of different mating type C.militaris

菌株鲜重∕g·瓶-1干重∕g·瓶-1鲜重∕干重生物转化率∕%“圆头”GD118.61±0.13 a2.44±0.01 bc7.6360.82FJ217.01±0.90 b2.73±0.06 ab6.2355.59SD216.00±0.50 bc2.50±0.09 b6.4052.29FJ115.34±0.30 c2.86±0.14 a5.3650.13JS212.59±1.13 d2.20±0.38 c5.7241.14ST111.92±1.49 de1.63±0.20 d7.3138.95中1310.69±0.48 e1.65±0.14 d6.4834.93SD310.64±1.04 e1.64±0.21 d6.4934.77中126.08±0.43 f0.96±0.03 e6.3319.87中35.10±1.05 fg1.00±0.16 e5.1016.67LN25.05±0.53 fg0.58±0.07 f8.7116.50LN14.53±0.48 gh0.56±0.04 f8.0914.80中23.22±0.74 h0.50±0.06 f6.4410.52“尖头”LN818.96±0.99 a3.22±0.11 a5.8961.96LN517.80±0.94 ab3.16±0.01 a5.6358.17LN417.52±0.60 abc3.22±0.10 a5.4457.25LN316.48±0.70 bc2.73±0.05 b6.0453.86YN116.06±1.59 c2.66±0.23 bc6.0452.48Cm01615.94±0.62 c2.00±0.20 e7.9752.09YN213.42±1.13 d1.64±0.10 gh8.1843.86LN1113.01±0.83 de2.28±0.12 d5.7142.52LN612.96±1.53 de2.03±0.10 e6.3842.35虫112.59±1.02 de1.89±0.22 efg6.6641.14SD112.55±1.07 de2.45±0.27 cd5.1241.01LN911.75±1.20 def2.40±0.23 d4.9038.40
(续表1)
2.2.3 虫草素和腺苷含量
参试蛹虫草子实体中虫草素含量差异较大,为0.320—4.776 μgmg(图3)。“尖头”蛹虫草子实体中虫草素含量(平均值2.599 μgmg)明显高于“圆头”蛹虫草中虫草素含量(平均值0.869 μgmg),两者间达到极显著差异。栽培菌糠中虫草素含量为0.177—3.013 μgmg,较子实体中虫草素含量略微偏低,且“尖头”蛹虫草菌糠中虫草素含量(平均值1.651 μgmg)与“圆头”蛹虫草菌糠中虫草素含量(平均值1.007 μgmg)也具有显著差异。
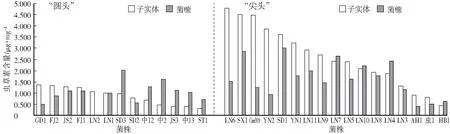
图3 蛹虫草子实体和菌糠中虫草素含量Fig.3 The cordycepin content in C.militaris fruiting body and spent substrate

图4 蛹虫草子实体和菌糠中腺苷含量Fig.4 The adenosine content in C.militaris fruiting body and spent substrate
3 结论与讨论
市售蛹虫草根据外观可以分成“圆头”和“尖头”两种类型,目前对这两种类型蛹虫草之间的差异和成因的研究还很少。本研究发现“尖头”蛹虫草中虫草素含量显著高于“圆头”蛹虫草虫草素含量,可为高虫草素菌株选育和蛹虫草质量分级提供依据。
“圆头”蛹虫草栽培周期较“尖头”蛹虫草短5—10 d。较短的栽培周期,一方面可以提高栽培场所的利用效率,另一方面也会降低管理成本,增加经济效益。试验发现,菌糠中虫草素含量与子实体中含量相差不大,少数菌株菌糠中虫草素含量反而高于子实体中含量,下一步应积极探索菌糠综合利用方式[17-18],努力提高效益回报率,避免资源浪费。
“圆头”蛹虫草基本为双交配型菌株,能进行完整的生活史;而单交配型(“尖头”蛹虫草)菌株无法产生孢子,缺少有性生殖阶段。本试验中多数“尖头”蛹虫草子实体中虫草素含量明显高于“圆头”蛹虫草子实体中虫草素含量,是否是由于有性生殖阶段消耗了较多的营养物质[19],进而导致虫草素合成减少还有待进一步验证。无论是子实体还是菌糠,腺苷含量都较为稳定。子实体中腺苷含量显著高于菌糠中含量,是否是由于子实体是合成腺苷的主要组织或是菌丝合成的腺苷向子实体转移的结果,有待进一步研究。

