影响金花茶组织培养芽增殖生长的几种因素
龙 敏,沈 遐,刘 芳,俞建妹,包 晗
(南宁树木园,广西 南宁 530031)
1 引言
金花茶(CamellianitidissimaC. W. Chi),属于山茶科山茶属,是目前为止发现的唯一一种开金黄色的山茶花,是世界珍稀观赏树种和种质资源,与银杉、桫椤、珙桐等珍贵“植物活化石”齐名,被誉为“植物界的大熊猫”,“茶族皇后”。金花茶除了有观赏价值外,药用和保健价值也被人们广泛认可,此外,还含有特殊的色泽遗传基因,具有较高的科研价值[1]。随着金花茶价值不断被开发利用,市场上对金花茶苗木的需求不断增加,而其传统的种子和扦插繁殖育苗材料有限、育苗周期长[2],因此金花茶组织培养技术研究就成了其发展的新风向。国内对金花茶组织培养相关研究已有一些报道。庄承纪和程金水等从金花茶子叶诱导胚状体再生成完整植株;廖汉刃等以茎段为外植体成功培育出试管无根苗并与油茶苗砧嫁接形成完整植株,继代增殖率2.8~6.2;颜慕勤等研究了广西7种金花茶组织培养技术,验证了适合大多数茶科的基本培养基为改良ER培养基,并成功应用于杂交金花茶幼胚的早期培养;黄昌艳等以防城港金花茶种胚诱导成功培育出组培苗,增殖系数3.79,并进行壮苗培养后直接移栽;李桂娥等建立了金花茶组培快繁体系,增殖系数4.2,生根率达86%。可见,金花茶组织培养研究已取得一定进展,但仍有待完善。本试验旨在研究影响金花茶组织培养芽增殖生长的几种因素,为金花茶组培苗产业化生产提供技术支撑。
2 材料与试验方法
2.1 材料
供试材料来源于广西南宁树木园金花茶基因库中优选的生长健壮、花朵繁多,花产量较高的金花茶植株当年生嫩枝,通过茎段消毒灭菌、初代培养获得的组培继代芽。
2.2 试验方法
2.2.1 不同生长调节剂及浓度配比对芽的增殖
在Q (MS+50 mg/L Na2SO4)的基本培养基基础上,采用双因素正交试验设计,添加不同浓度6-BA(2.0 mg/L 、3.0 mg/L、 4.0 mg/L)配以IAA和NAA,后两者浓度梯度均为0 mg/L,0.5 mg/L,1.0 mg/L。每处理接种10瓶(500 mL三角瓶,以下试验相同),每瓶接种6丛丛芽(5~7颗芽/丛,以下试验同),重复3次,接种40 d统计芽增殖情况。
2.2.2 不同浓度水解酪蛋白对不定芽的增殖
在Q+6-BA3.0 mg/L+NAA1.0 mg/L培养基基础上添加水解酪蛋白,浓度梯度为0 mg/L ,100 mg/L,300 mg/L,500 mg/L,700 mg/L,900 mg/L。每处理接种10瓶,每瓶接种6丛丛芽,重复3次,接种40 d观察记录芽增殖数量和质量的情况。
2.2.3 芽褐化现象的遏制
在Q+6-BA3.0 mg/L+NAA1.0 mg/L+CH 300 mg/L培养基基础上分别添加核黄素15 mg/L、抗坏血酸10 mg/L和活性炭500 mg/L,每处理接种10瓶,每瓶接种6丛丛芽,重复3次,接种40d观察记录芽增殖过程中的褐化情况。
2.2.4 温度条件对不定芽的增殖
在Q+6-BA3.0 mg/L+NAA1.0 mg/L+CH 300 mg/L+抗坏血酸10 mg/L培养基上接种健壮继代芽,置于不同培养温度条件下进行培养,试验的温度梯度为15~20℃、21~25℃、26~30℃,每处理接种10瓶,每瓶接种6丛丛芽,重复3次,接种后不断观察继代芽生长情况。
2.3 培养条件
上述所有培养基添加蔗糖30 g/L,琼脂4.5 g/L,pH值5.8,培养基经高温高压( 121 ℃,0.14 MPa) 灭菌15 min。除试验外,继代芽在光照强度800~2000 Lx的条件下培养7~10d,再置于4000~6000Lx的光照条件下培养,光照时间12~14 h/d,培养室温度21~25 ℃。光照主要来源于太阳散射光。
2.4 数据统计与分析
采用Microsoft Office Excel 2007,SPSS统计分析软件对数据进行处理。公式如下:
芽增殖系数=新增芽数/接种芽总数。
3 结果与分析
3.1 不同生长调节剂及浓度配比对金花茶组培芽增殖的影响
在组织培养中,人工添加不同生长调节剂种类及浓度配比,会共同影响芽增殖的数量和生长情况。正交试验结果见表1、2。
表1生长调节剂正交试验设计及结果
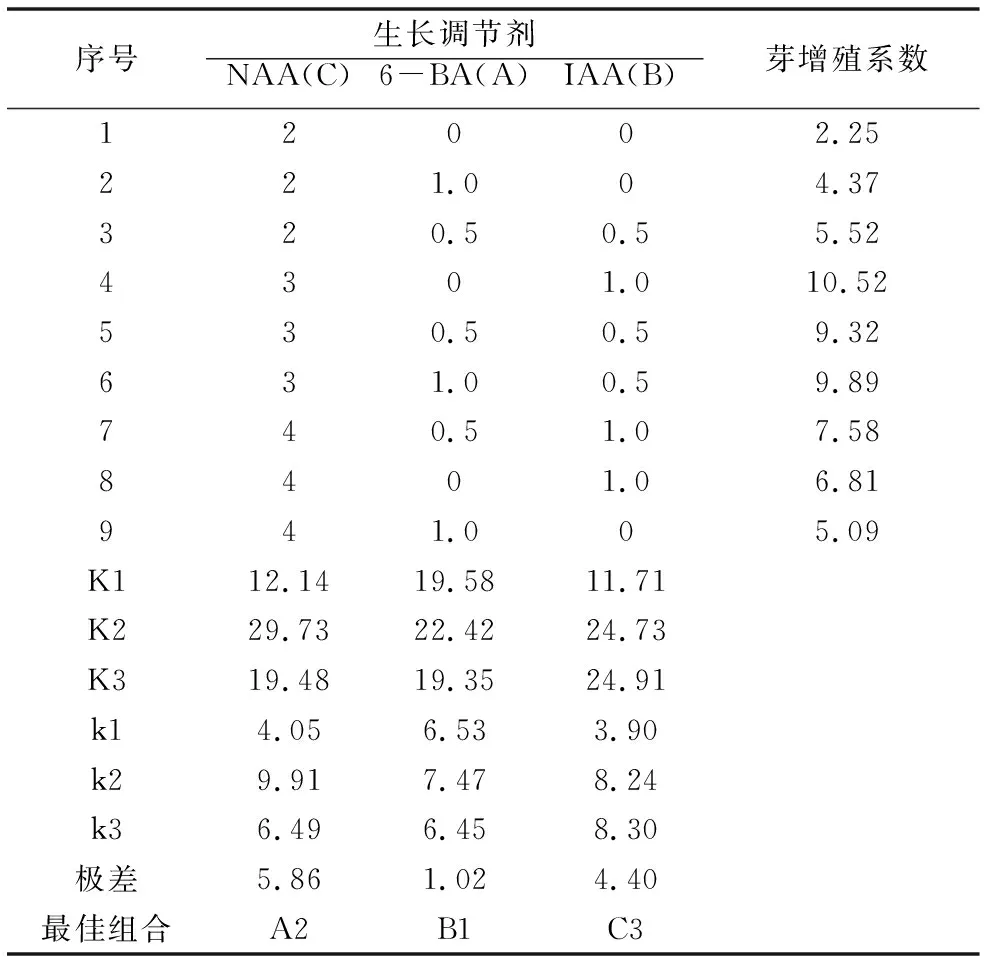
序号生长调节剂6-BA(A)IAA(B)NAA(C)芽增殖系数12002.25221.004.37320.50.55.524301.010.52530.50.59.32631.00.59.89740.51.07.588401.06.81941.005.09K112.1419.5811.71K229.7322.4224.73K319.4819.3524.91k14.056.533.90k29.917.478.24k36.496.458.30极差5.861.024.40最佳组合A2B1C3
表2主体间效应的检验因变量y

源III 型平方和自由度均方F值P值校正模型61.180a610.19761.3150.016截距418.2021418.2022514.7470.0006-BA(A)14.29527.14842.9800.023IAA(B)2.60521.3027.8310.113NAA(C)7.19223.59621.6250.044误差0.33320.166总计479.7159校正的总计61.5138
由表1和表2的检验结果综合分析表明,因素A和因素C的P值为0.023和0.044,都小于0.05,说明6-BA和NAA对芽增殖的作用显著,其中起主导作用的是6-BA,其次是NAA,两者协同作用,是影响金花茶芽增殖的重要因素。因素B的P值为0.113,大于0.05,显示IAA在试验各水平中对金花茶芽增殖作用不显著,这可能是由于IAA在植物体内运输缓慢导致。试验结果显示最佳的组合为A2 +C3+B1即6-BA3.0 mg/L+NAA1.0 mg/L+IAA0 mg/L,其平均增殖系数最高为10.52。
由表3多重比较可知,6-BA的水平2和1、3水平差异显著,1、3水平间差异不显著,6-BA浓度以3.0 mg/L芽增殖效果最好,芽平均增殖系数达9.910,试验中最高芽增殖系数达13。NAA水平2、3和水平1差异显著,2、3水平之间差异不显著,NAA的水平3与6-BA的水平2浓度配比增殖效果最好。
试验还发现培养基中单纯添加细胞分裂素6-BA2.0 mg/L继代芽有一定的增殖,但是芽密集粗短,玻璃化严重。这说明一定浓度的细胞分裂素可以促进细胞分裂和芽的分化,但欲使芽生长良好,在继代培养过程中必须要有生长素协同作用。

表3 金花茶芽增殖单因素方差分析结果
3.2 水解酪蛋白对芽增殖的影响
水解酪蛋白含有氨基酸、多肽和蛋白质等丰富的营养物质,其作为一种有机添加物被广泛应用于组织培养中[3],对不定芽的分化有良好的促进作用。试验中发现芽增殖系数较高的培养基培养的芽高生长缓慢,活性不强,为了促进芽健康生长,本试验在上述Q+6-BA3.0mg/L+NAA1.0 mg/L组合的基础上添加不同浓度的CH,培养40d芽形态变化、新芽增殖和芽的生长状况详见表4。

表4 不同浓度水解酪蛋白对芽增殖影响
表4结果显示,不同浓度的CH对芽增殖和生长效果不一致,增殖系数大小排序为CH-4>CH-3>CH-2>CH-1>CK>CH-5,其中CH-2、CH-3、CH-4的芽增殖系数较高,分别为12、13、15,当浓度低为CH-1时,芽的长势差,增殖系数偏低;CH-4芽增殖系数虽然最大,但芽粗短密集,容易出现玻璃化,CH-3芽增殖系数也较高,但继代芽连续培养3代后,同样也出现玻璃化芽;当浓度达到CH-5时,芽粗短且玻璃化严重最后褐化死亡。因此试验结果表明较为适宜的水解酪蛋白添加浓度为CH-2(即300 mg/L),其增殖芽生长健康,扦插生根率高。
3.3 不同添加物对芽褐化现象遏制的效果
金花茶组培芽在继代培养过程中,芽体褐化现象比较明显。褐化是完整组织和细胞受到物理伤害,酚类化合物外溢,在酶作用下迅速氧化,形成褐色醌类物质,进一步与组织中的蛋白质发生聚合,导致组织代谢紊乱,甚至死亡的现象[4]。褐化是植物组织培养中常见的问题,相关研究发现,添加适当的抗氧化剂或吸附剂可以达到降低或抑制褐化的作用。
本试验在上述试验优选的培养基基础上分别添加核黄素15 mg/L、抗坏血酸10 mg/L以及活性炭500 mg/L,并在接种后每天观察记录芽体褐化的程度和芽的生长情况,接种40 d各添加物对芽褐化遏制的效果见图1。

图1 不同添加物对芽褐化的遏制效果
图1中,轻度褐化表示接种后单颗芽顶芽褐化,褐化部分小于1/3;中度褐化表示单颗芽的1/3~1/2褐化;重度褐化表示单颗芽的1/2以上褐化。
图1显示培养基中添加15 mg/L核黄素对抑制芽的褐化效果不明显,全部出现不同程度的褐化,其中轻度褐化的芽仅占瓶内芽数的5%,而中度、重度褐化共占95%,以中度褐化为主;添加抗坏血酸,无褐化和轻度褐化占97%,表明10 mg/L抗坏血酸对金花茶继代芽的增殖过程中出现的褐化现象抑制效果较好;添加活性炭可在一定程度上抑制褐化,无褐化占25%,轻度褐化占26%,中度、重度褐化占49%,其对褐化的抑制作用仍低于抗坏血酸,且活性炭虽然能够吸附芽体释放的褐化物质,但也会吸附培养基的有效成分。由此可见,添加抗坏血酸10 mg/L遏制芽褐化的效果比较理想。
3.4 温度对金花茶芽生长的影响
适宜的温度是保障植物正常生长的重要条件。金花茶性喜温凉但惧炎热的环境。本试验将接种的继代芽置于不同温度条件下培养40d芽增殖和生长结果见表5。
表5显示,T1温度15~20℃条件下继代芽增殖系数偏低,芽生长缓慢,原因可能是因长时间培养室温度偏低导致植株的生理活性降低;T2温度21~25℃条件下芽的增殖系数最高达12.3,芽生机勃勃,平均株高3.8 cm,是最适合金花茶组培芽的增殖和生长的温度范围;当温度提高到26~30 ℃时,继代芽接种第3 d即有叶片发黄现象,第7 d后逐渐出现枯叶落叶,甚至整株芽的叶片全部落光至死,大部分的继代芽无新芽增殖,因此,芽的增殖系数最低,分析其原因主要是培养温度过高导致植株体内代谢紊乱,生长失衡。
3 结论与讨论
随着6-BA浓度提高,芽增殖系数先上升后下降,试验中6-BA浓度3.0 mg/L的增殖系数最高,这与黄昌艳(2016)在金花茶种子萌发与快速繁殖技术研究结果相类似,本试验还研究了6-BA与生长素协同作用于金花茶组培芽的增殖,增殖系数10以上,就增殖系数而言,较优于国内有关的金花茶组织培养研究结果。
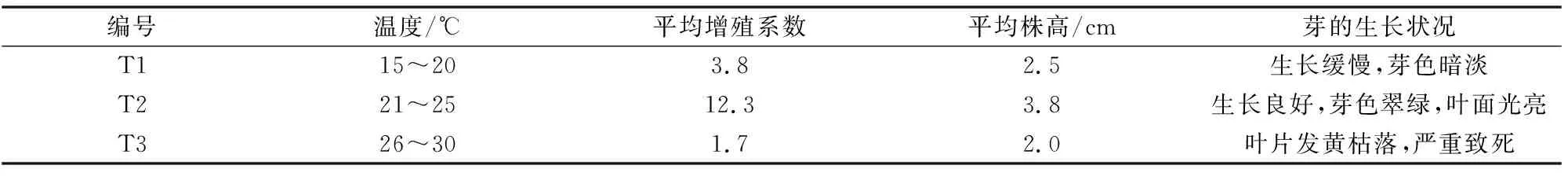
表5 不同培养温度对金花茶组培芽增殖和生长
对于金花茶组培芽褐化的遏制,抗坏血酸的作用优于核黄素和活性炭,因为抗坏血酸是一种普遍存在于植物组织的抗氧化物质,其作为自由基消除剂,可以成为初级抗氧化物直接清除单线态氧、超氧化物和羟自由基[5],而植株体产生的酚类化合物正是由羟自由基与芳烃核(苯环或稠苯环)直接相连形成的有机化合物,因此添加抗坏血酸能较好的与酚类化合物结合,阻止醌类褐化物质产生,因而起到调节金花茶组培芽体内的氧化还原代谢的作用,同时基本上对培养基的有效成分无影响,因此选择抗坏血酸作为添加物以抑制芽体的褐化效果良好。
金花茶喜欢温凉环境,本试验最适温度范围21~25 ℃,在实际生产中要同时考虑到成本问题,尤其是高温季节室外温度一般在28~35 ℃,培养室温度长期控制在21~25 ℃耗电大成本高,因此是否可以将温度基本控制在25 ℃±2 ℃,在此温度区间内金花茶组培芽能否正常生长,有待进一步研究。

