锰胁迫对不同基因型玉米幼苗抗氧化酶活性及丙二醛含量的影响
张 迪,吕思琪,张婉婷,姜佰文
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江省肥料工程技术研究中心,哈尔滨 150086)
锰是维持植物生长发育所需微量元素之一,是多种酶的活化剂,锰缺乏影响植物生长发育和代谢,主要表现在碱性土壤和沙土上,土壤中可被作物吸收利用的锰不足以维持作物正常生长。植株缺锰可出现叶片失绿,根部不发达,成熟期无法正常开花结果[1]。由于锰移动性较差,缺锰首先表现在新叶上,严重时出现黄斑病。适量锰可增强植物光合能力、提高抗逆性和产量[2]。但锰过量会降低产量及品质,甚至导致植物死亡[3-4]。受外界胁迫时,植物具有抗氧化酶类组成的保护系统,可抵御外界伤害,降低损伤程度。
玉米是锰富集植物,锰缺乏和过量均会对玉米造成胁迫。研究表明,玉米缺锰时,破坏叶绿体结构,无法在维管束鞘细胞中形成淀粉粒,降低玉米光合能力[5]。李青军等研究表明,适量硫酸锰浸种,有效加快玉米种子新陈代谢,促进种子萌发,发芽势和发芽率大幅增高,浸种玉米幼苗叶绿素含量明显高于对照,内芽和根呼吸速率也显著增强,加快玉米苗期生长[6]。张铁强等发现,适量锰施用有效增强玉米叶片气孔导度、光合能力和水分利用,干旱状况下效果最为显著[7]。适量锰可有效提高作物抗逆能力,杜新民研究表明,适量锌锰肥配施提高小白菜抗氧化酶活性,降低丙二醛(MDA)含量,增强小白菜抗逆能力,延缓小白菜衰老[8]。适量锰硼肥显著提高黄瓜超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)含量,降低MDA含量,有效提高黄瓜产量[9]。
本试验以5种玉米基因型为研究对象,探讨不同水平锰处理下玉米苗期生长发育、锰含量及抗氧化酶活性和丙二醛含量差异,评价土壤锰胁迫下不同基因型玉米对不同剂量锰耐受程度,为锰肥合理施用提供理论依据。
1 材料与方法
1.1 材料
本试验于2016~2017年在东北农业大学网室内自然光下,沙培培养,塑料盆内径17 cm,高度13.5 cm,盆内装高温灭菌并经饱和硫酸钙溶液浸过的沙子和蛭石(体积比1:1)。5种供试玉米基因型分别为垦粘1号(K)、双玉201(S)、东青1号(D)、吉农大516(J)和先玉335(X)。
1.2 方法
试验设置5种玉米基因型Mn1、CK、Mn2、Mn3、Mn4,对照锰浓度(0.005 mmol·L-1),4次完全重复随机设计,5个处理氯化锰(MnCl2·4H2O)浓度分别为0、0.00099、0.99、1.98和3.96 g·L-1。选取尺寸一致5种基因型种子育种,出芽1 cm后移栽,每盆定植幼苗4株。待植株一叶一心期后,每3 d分别浇灌霍格兰营养液(硝酸钙:945 mg·L-1,硝酸钾:506 mg·L-1,硝酸铵:80 mg·L-1,磷酸二氢钾:136 mg·L-1,硫酸镁:49 mg·L-1,铁盐溶液:2.5 mL·L-1,微量元素:5 mL·L-1)50 mL。各处理浇灌的营养液除锰含量不同外,其他营养元素用量一致。去离子水浇灌以保证植株正常生长发育,保持沙中70%含水量。
1.3 测定项目及方法
植株生长至20 d取样,分离地上和地下部分,去离子水彻底清洗。取鲜样分析抗氧化酶活性和丙二醛含量,剩余根和地上部分放入105℃烘箱杀青30 min,于65℃至恒重测定生物量。SOD活性测定采用氮蓝四唑(NBT)法[10],POD活测定性采用愈创木酚法[11],CAT活性测定采用比色法[12],MDA含量测定采用硫代巴比妥酸(TBA)法[13]。测定根系构型采用万深公司LA-S根系分析系统及根系扫描仪分析测定,每组根系样品利用蒸馏水洗净,置于30 cm×40 cm树脂玻璃槽内,槽内注水3~4 mm,待根系充分散开,双面光源扫描。
1.4 统计及分析
采用Excel 2011和SPSS 17.0软件处理和分析数据。
2 结果与分析
2.1 锰胁迫对不同基因型玉米苗期株高的影响
由图1可知,在锰缺乏时期,各基因型株高相对于CK均有不同程度下降,差异显著,说明适量施锰增加株高。随锰浓度升高,株高呈下降趋势,K基因型Mn2、Mn3、Mn4较CK分别下降3.23、7.08、13.88 cm;J基因型下降2.85、3.53、0.75 cm;S基因型下降5.5、11.08、16 cm;D基因型下降8.38、12.13、18.13 cm;X基因型下降2.03、3.1、6.4 cm;J基因型随浓度升高株高下降较平缓,其次是X基因型。D、S基因型随锰浓度增加株高下降明显,各处理差异显著,S是株高最矮基因型。随锰毒害增强,J基因型变化平稳,为耐受基因型,S基因型受锰胁迫株高变化最大,为锰敏感基因型。
2.2 锰胁迫对不同基因型玉米苗期根系构成的影响
不同基因型玉米Mn4胁迫水平下玉米苗期根系扫描图像见图2,不同基因型玉米苗期Mn4水平下根系扫描相关参数见表1。

图1 不同浓度锰对不同玉米幼苗株高的影响Fig.1 Effectsof different manganeseconcentrationson seedling height of different maizegenotypes

图2 不同浓度锰对不同基因型玉米根系构成的影响Fig.2 Effects of different manganese concentrationson seedling root structures of different maizegenotypes

表1 不同浓度锰对不同玉米幼苗发育的影响Table1 Effectsof different manganeseconcentrationson seedling developmentsof different maizegenotypes
由表1和图2可知,各基因型根长均较CK下降,其中X基因型下降最多,达32.7%,其次为基因K,下降27.3%。锰毒害对D基因型根长影响相对较小,较CK下降23.8%。在Mn4浓度下,X基因型根表面积133.11 cm2,较CK下降最大,达49.9%,其次为J基因型下降45.4%,D基因型根表面积较CK下降最少,为11.2%。X基因型根体积2.76 cm3,较CK下降66.0%,平均直径0.42 cm,较CK下降最大,为27.6%。D基因型根体积、平均直径、根尖数均较CK处理略有增加。由此说明,D基因型根部抗性较强,X基因型根部对锰敏感。
2.3 锰胁迫对不同基因型玉米苗期生物量的影响
由图3可知,在CK锰浓度下地上部分生物量明显高于不施锰处理,除K基因型外均差异显著,K基因型CK较Mn1升高11.76%,说明施用适量锰可增加玉米地上部分生物量。而后随锰浓度增加,地上部分生物量呈下降趋势。J基因型为地上生物量最高基因型,S为地上生物量最低基因型。根部生物量变化基本和地上部生物量变化基本一致,但下降趋势较为平缓。J、D基因型在Mn2浓度之前均呈上升趋势,且Mn3、Mn4浓度间无显著差异。说明锰浓度变化对根部生物量影响较小。J基因型为根部生物量最大基因型。
2.4 锰胁迫对不同基因型玉米苗期锰含量的影响
2.4.1 锰胁迫对不同基因型玉米苗期地上部锰含量的影响
由图4可知,K、J、S、D基因型在Mn1浓度下锰含量略高于CK,但无显著差异。CK浓度下各基因型玉米地上部分锰含量差异小。Mn2浓度下K基因型地上部分锰含量为最高值,分别高于J(52.12%)、S(63.50%)、D(38.06%)、X(56.42%)。Mn3浓度下K基因型地上部锰含量显著高于其他基因型,差异显著,分别高于J(38.86%)、S(38.32%)、D(37.68%)、X(35.75%)。Mn4浓度下K基因型地上部锰含量分别高于J(41.86%)、S(8.56%)、D(33.06%)、X(39.40%)。可见,K、S基因型为地上部锰吸收较好基因型,J基因型为随锰浓度升高变化最缓慢基因型。
2.4.2 锰胁迫对不同基因型玉米苗期根部锰含量的影响
由图5可知,K、X基因型为根部锰含量最高基因型,K基因型CK和Mn1浓度下无显著差异,Mn2、Mn3、Mn4浓度下随浓度升高根部锰含量明显上升,差异显著。J基因型在锰浓度由10 mmol·L-1升至20 mmol·L-1时根部锰浓度变化较小,无显著差异,且J、X基因型在20 mmol·L-1锰浓度时根部锰含量为最低处理,与其他处理差异显著。
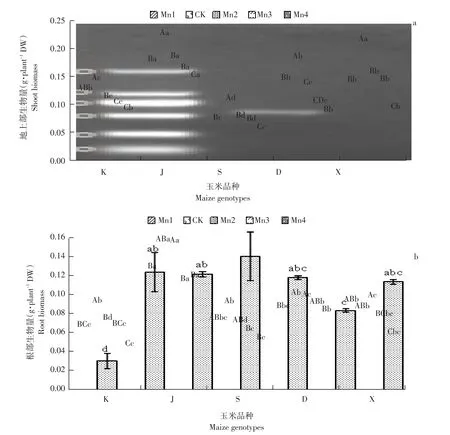
图3 不同浓度锰对玉米幼苗地上部和根部生物量的影响Fig.3 Effects on different manganeseconcentrations seedling shoot and root biomass of different maize genotypes

图4 不同浓度锰对不同玉米幼地上部锰含量的影响Fig.4 Effectsof different manganeseconcentrationson seedling shoot Mn contentsof different maizegenotypes

图5 不同浓度锰对不同玉米幼苗根部锰含量的影响Fig.5 Effects of different manganese concentrations on seedling root Mn contents of different maize genotypes
2.5 锰胁迫对不同基因型玉米苗期超氧化物歧化酶活性的影响
K基因型随锰浓度上升,SOD活性随之增加。与对照相比,Mn2、Mn3、Mn4分别升高58.42%、78.45%、115.44%。J基因型与对照相比Mn2、Mn3、Mn4分别升高166.91%、271.69%、223.16%,锰浓度达20 mmol·L-1时,SOD活性下降,但与Mn3无显著差异,此时已达锰胁迫临界值。S基因型与对照相比,Mn2、Mn3、Mn4分别升高131.97%、165.31%、315.65%,随锰浓度变化,S基因型变化明显,D基因型SOD活性较高。
相同锰浓度胁迫下,各基因型玉米SOD活性存在差异。在锰缺乏时期K、S、D、X较J增加174.67%、14.62%、210.93%、246.98%。在CK浓度下K、S、D、X较J增加53.08%、8.09%、146.32%、157.80%。在Mn2浓度下K、J、D、X较S增加53.08%、6.45%、30.35%、47.27%。在Mn3浓度下K、J、D、X较S增加50.77%、29.62%、65.64%、62.52%。在Mn4浓度下K、S、D、X较J增加61.52%、39.02%、79.74%、73.16%。随锰浓度增加,各基因型间差值呈先降后升趋势,Mn2浓度下差值最小。

图6 不同浓度锰对不同基因型玉米幼苗SOD酶活性的影响Fig.6 Effectsof different manganese concentrationson seedling SOD activitiesof different maize genotypes
2.6 锰胁迫对不同基因型玉米苗期过氧化物酶活性的影响
D基因型随锰胁迫增强POD活性随之升高,且锰浓度在10和20 mmol·L-1时差异显著,分别高于CK 28.05%和47.11%。K和X基因型随锰胁迫增强呈先升后降趋势,在Mn3浓度下达最大值,之后回落。K基因型Mn3和Mn4浓度下无显著差异,较Mn3降低6.67%,下降幅度较小,而X基因型Mn3和Mn4浓度下差异显著,较Mn3降低19.89%,下降较为明显。J和S基因型在Mn2浓度下达最大值,而后开始下降,Mn3与Mn2无显著差异,与Mn4差异显著。J基因型Mn3、Mn4较Mn2下降4.29%、14.81%;S基因型下降3.55%、19.62%。D基因型在不同锰胁迫下POD活性均高于其他基因型,说明D基因型过氧化物酶活性较强,对锰胁迫抗性较强。S基因型对锰胁迫变化不明显,过氧化物酶活性处于最低值,因此S为抗性较弱基因型。

图7 不同浓度锰对不同基因型玉米幼苗POD活性的影响Fig.7 Effects of different manganese concentrations on seedling POD activities of different maizegenotypes
2.7 锰胁迫对不同基因型玉米苗期过氧化氢酶活性的影响
K、S和X基因型在Mn2浓度时达最大值后开始下降,K、S基因型在Mn3浓度后CAT活性变化较小,基本趋于稳定,K基因型Mn3、Mn4浓度下分别下降32.54%、24.60%;S基因型下降28.57%、26.79%,K、S基因型Mn2和Mn3、Mn4差异显著。X基因型呈阶梯状下降,较Mn3、Mn4分别下降9.84%、13.22%,Mn2、Mn3、Mn4无显著差异。J基因型在Mn3浓度时达最大值,在锰胁迫加强时CAT活性下降。D基因型随锰胁迫增强,CAT活性呈明显上升趋势,Mn2、Mn3、Mn4分别较CK上升7.41%、29.17%、62.96%。D基因型在不同锰浓度下CAT活性均远高于其他基因型,说明该基因型清除过氧化氢能力较强,D为抗性较强基因型。
2.8 锰胁迫对不同基因型玉米苗期丙二醛含量的影响
随锰浓度增加,各基因型MDA含量随之增加。K和D基因型变化较一致,呈阶梯状升高,K基因型Mn2、Mn3、Mn4分别较CK增加17.14%、40.06%、54.90%,上升较缓慢,Mn3、Mn4和Mn2差异显著。D基因型Mn2、Mn3、Mn4分别较CK增加38.32%、47.40%、116.07%,各浓度间差异显著。J、S、X基因型在Mn4浓度下,MDA含量急剧升高,分别较Mn3增加91.47%、232.36%、158.73%,说明当锰浓度达20 mmol·L-1时,该基因型细胞膜已严重破坏。在不同锰浓度下D基因型MDA值最小,说明细胞膜受破坏最小,抗性较强。S基因型受破坏程度最严重,抗性较弱。

图8 不同浓度锰对不同基因型玉米幼苗CAT活性的影响Fig.8 Effectsof different manganese concentrations on seedling CAT activities of different maize genotypes

图9 不同浓度锰对不同基因型玉米幼苗MDA含量的影响Fig.9 Effects of different manganese concentrations on seedling MDA contents of different maize genotypes
3 讨论
锰缺乏影响植物代谢功能,锰过量显著降低植株生物量[14]。植株生长状况可反映植株受环境胁迫伤害程度,锰胁迫抑制植株生长发育,降低地上部高度和根部长度,减少植株干重和鲜重,对植株各部分影响程度不同。本试验结果表明,高浓度锰对植株生长发育抑制作用明显。文珂等研究表明,随锰浓度升高,青葙幼苗根长、芽长降低,幼苗总生物量下降[15]。地上部受锰胁迫较根部严重,说明锰毒害先影响地上部分,其次是根部,与锰胁迫下油菜叶片出现症状结果一致[16]。说明锰毒害首先在地上部表达,区别于其他重金属的根部表达。随锰浓度增加,各基因型地上部和根部锰含量均上升,根部对锰吸收较好。J基因型对锰含量吸收较弱,含量较低,不易对玉米造成抑制。
在植株正常生理状态下,植株体内活性氧产生和清除间达动态平衡。当植株受到锰胁迫时,体内自动调节,对细胞膜酯产生氧化反应,损伤细胞膜结构,使膜脂过氧化物MDA大量累积,抑制作物生长发育[17]。为清除逆境胁迫产生的过氧化物,增加SOD、POD、CAT活性,以维持细胞正常生理活动,植株体内抗氧化酶活性升高表明植株在积极抵抗外界胁迫。本研究结果表明,随锰浓度不断增加,植株体内SOD活性随之增强,POD和CAT活性在10 mmol·L-1时呈下降趋势,植株自身调节有限,超过植株最大承受力后开始下降。刘秀春等发现,八棱海棠砧木的苹果幼树受锰胁迫后叶片SOD、POD、CAT活性显著提高[18]。王丹娟等发现,在低浓度锰胁迫中,SOD、POD、CAT活性均随锰浓度增加而增加[19],耐性基因型高浓度下增加更显著。MDA含量随锰浓度增加而升高,20 mmol·L-1时明显升高,说明胁迫对植株损伤程度超出抗氧化酶抵御范围,植株无法维持正常生理活动。王佳等研究表明,高锰胁迫使植物叶片有不同程度MDA积累[20]。综合各项生理指标和抗氧化酶活性可知,D基因型为耐受基因型,具有较高抵御锰胁迫能力。
4 结论
低锰和高猛胁迫使玉米植株株高、根长、生物量较CK降低。玉米株高较CK下降2.83~18.13 cm;在Mn4条件下根长较CK下降200.27~434.77 cm,根表面积下降14.82~132.85 cm2。随锰胁迫增强,地上和地下部分生物量均下降,根部生物量下降较为缓慢。随锰浓度增加,地上部和根部锰含量均增加,根部对锰吸收较好,J基因型吸收锰能力较弱。
在一定锰浓度范围内,SOD、POD、CAT随锰浓度增加而增加,在达到该基因型最大承受能力时均有不同程度下降。D基因型为SOD活性较高基因型,S基因型的SOD活性较低。随锰胁迫增强,仅D基因型POD活性不断上升,其他基因型在Mn2或Mn3浓度时达临界值。CAT是受锰浓度变化影响最大的酶,D基因型CAT活性高于其他基因型。锰胁迫加重增加各基因型MDA含量,S基因型MDA含量最高,为锰敏感型基因型,D基因型MDA含量较低,为锰较强抗性基因型。

