低温和短光周期对笃斯越橘叶绿素荧光特性和光合作用相关蛋白的影响
乌凤章
(大连大学现代农业研究院,辽宁 大连 116622)
温度和光周期是控制北方多年生植物生长及抗性反应的主要环境因子[1]。秋季低温和短光周期引起植物生理生化和分子改变,增强对不利环境的适应性[2]。低温引起光合作用相关膜蛋白、电子传递和卡尔文循环有关蛋白丰度和活性发生变化,或使冷敏感蛋白活性丧失,但光合作用的生物物理反应(光子捕获和激发能量传递)受温度影响较小,光化学、电子传输和代谢间能量不平衡,增加PSⅡ激发压力[3],降低以PSⅡ水平为主的光合器官光吸收能力[4]。光周期调节叶片活动,单独诱导植物停止生长和休眠[5],或与低温共同作用诱导植物休眠,进入低温锻炼状态,提高低温锻炼效果[6]。Bauerle等研究表明,在恒温和长光周期下北方落叶树保持较高光合能力,但恒温和自然缩短的光周期下光合活性下降[7]。使植物暴露在低温锻炼条件下,引发部分光合机构蛋白重构,碳固定相关蛋白重调,光合能力发生变化,使植物适应环境变化[8]。Renaut等研究发现,低温下消失或下调表达的蛋白与光合能量代谢相关[9]。刘慧民等在不同低温和缩短的光周期下分别鉴定绣线菊(Spiraea)叶片中涉及能量代谢与运输的17种显著变化的光合作用相关蛋白[10]。
笃斯越橘(Vacciniumuligiuosum L.)主要分布在我国长白山及大小兴安岭,果实比栽培的高丛越橘抗氧化成分更高,抗冻性极强,可耐受-35℃低温。因此作为重要的野生经济植物资源和越橘属植物遗传改良亲本材料受关注。乌凤章研究表明,在低温锻炼期间笃斯越橘叶片可溶性糖和可溶性蛋白含量受低温影响明显增加,低温环境的适应能力提高[11],但低温和短光周期对笃斯越橘叶绿素荧光参数和光合蛋白丰度影响情况尚不清楚。因此,本文以3年生笃斯越橘苗木为试验材料,利用iTRQ蛋白质组技术研究低温下不同光周期对叶片光合蛋白表达的影响,结合叶绿素荧光参数测定结果,以期从蛋白质水平揭示笃斯越橘光合作用对低温和光周期的响应机制,为相关研究提供参考。
1 材料与方法
1.1 材料及试验处理
试验材料来源于黑龙江省黑河市嫩江县多宝山镇,为3年生盆栽(高16 cm、上口径16 cm)扦插苗,平均高40 cm,栽培基质为草炭土。
预处理:选取生长良好且规格相对一致的100株露地生长笃斯越橘盆栽苗。2017年9月10日将苗木置于人工气候室(PQX-1000 C,宁波东南仪器制造厂)中预处理。处理温度23℃,使用LED光源,光照强度14 400 lx,光周期10 h/14 h(昼/夜),空气湿度为75%/65%(昼/夜)。
低温锻炼期不同日照处理:预处理21 d后,分别将50株苗木置于两个人工气候室中,人工气候室温度4℃,光照强度14 400 lx,空气湿度75%/65%(昼/夜),日照处理分别为短日照10 h/14 h(昼/夜)和长日照14 h/10 h(昼/夜)。对于低温处理,以每小时下降2℃速率从预处理温度降至处理温度。处理期间,适时浇水,使栽培基质保持湿润。分别在低温下不同日照处理0、7、14和21 d时测定叶绿素荧光参数。经低温锻炼0 d(对照组)和不同日照处理21 d试验材料中随机选取15个单株,按照对角线法随机采集位于中上部的当年生枝条第2~8片生长最佳叶片,分别采集2~5 g叶片,液氮快速处理后保存于-80℃冰箱,用于蛋白质提取和鉴定。
1.2 叶绿素荧光参数测定
分别在每个处理中选择生长良好的5个植株作为待测植株。待测植株测量前在人工气候室中经2 h暗适应后,使用LI-6400-XT光合测定系统仪(LCF荧光探头,LI-6400-40)分别测定不同处理时期初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、PSⅡ潜在活性(Fv/Fo)和PSⅡ最大光化学效率(Fv/Fm),随后打开LI-6400-40活化光对同一叶片光活化,根据测定叶片平行高度上的平均光强设定活化光强度为14 400 lx。每个处理共重复15次。测定指标包括PSⅡ光量子产量(ΦPSⅡ)、电子传递速率(ETR)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)。其中ETR=活化光强度×ΦPSⅡ×0.5×0.84;NPQ=Fm/Fm′-1。其余参数由仪器测定,取平均值。
1.3 笃斯越橘叶片蛋白组分析
1.3.1 iTRAQ标记
采用丙酮沉淀法提取笃斯越橘幼苗叶片蛋白质。提取后蛋白样品作还原烷基化处理,用考马斯亮兰法测定蛋白浓度,经SDS-PAGE检测后,将样品取等量蛋白用Trypsin酶酶解。iTRAQ 119和121标记未经低温处理的叶片蛋白,iTRAQ 113、114和115标记4℃和短日照10 h/14 h(昼/夜)处理的叶片蛋白,iTRAQ116、117、118标记4℃和长日照14 h/10 h(昼/夜)处理的叶片蛋白,即2个处理分别为3次重复,对照为2次重复。最后将标记的8组样品室温静止2 h后等量混合。应用强阳离子交换色谱方法预分离混合后的肽段,再作液相分离和质谱分析。
1.3.2 差异蛋白选择
如果某个蛋白差异倍数(Fold change)≥1.20或≤0.83,同时经统计检验P<0.05,则认为是差异蛋白。
1.4 数据处理和统计分析
应用SPSS22统计软件对数据作差异显著性分析与多重比较;应用Excel 2010绘制数据图表。采用Mascot 2.3.02软件与选定蛋白质序列数据库比对,得到最终蛋白鉴定结果。数据库来源为笃斯越橘转录组、NCBInr和Swiss-Prot数据库。使用KEGG数据库分析光合作用及碳固定相关差异蛋白富集途径(http://www.genome.jp/kegg/)。
2 结果与分析
2.1 低温下不同日照长度对叶绿素荧光参数的影响
由图1A可知,当低温锻炼7 d时,长日照处理下Fo与对照相比显著升高,而短日照处理下与对照差异不显著,之后两种处理下缓慢升高,至21 d时短日照和长日照处理Fo值分别比对照显著提高18.57%和21.46%,但二者间差异不显著,表明低温锻炼后PSⅡ反应中心受损伤,主要由低温诱导引起。低温锻炼7 d时,两种处理下植株叶片Fm降低不显著,随低温锻炼时间延长,Fm均逐步下降,显著低于对照(见图1B),表明低温锻炼减弱植株PSⅡ反应中心电子传递能力,产生光抑制。随低温锻炼时间延长,两种日照处理下Fv/Fo均呈快速下降趋势,显著低于对照,但二者间差异不显著(见图1C);Fv/Fm均呈缓慢下降趋势(见图1D),低温锻炼7 d时与对照差异较小,之后显著低于对照,上述结果表明低温锻炼期间PSⅡ受损,PSⅡ潜在活性比最大光化学效率对环境变化响应快,且减弱程度较大。
由图1E和F可知,与对照相比,低温锻炼7 d时植株叶片ΦPSⅡ和ETR显著降低,之后缓慢降低或保持稳定,但不同光周期处理间无显著差异,说明表观光合量子传递效率和光合效率降低主要由低温引起。低温锻炼期间qP变化趋势与ΦPSⅡ相似,但在低温长日照处理下降幅更大(见图1G),说明qP主要受低温影响,PSⅡ受体侧电子传递受损,PSⅡ光合活性降低。本试验低温长日照处理7 d时,NPQ降低不明显,而低温短日照处理下显著低于对照;处理21 d时,两种光周期处理下叶片NPQ均显著低于对照(见图1H),表明低温下不同日照处理均未表现自我保护机制。
2.2 笃斯越橘叶片响应低温和短日照的蛋白质定量鉴定
2.2.1 蛋白质定量鉴定
为确定差异蛋白,将iTRAQ分析结果分为3种不同比率(比较组),包括SD/CHU(低温短日照条件与对照相比),LD/CHU(低温长日照条件与对照相比)和SD/LD(低温短日照与低温长日照相比)。SD/CHU和LD/CHU表示低温与日照组合对蛋白表达的影响,SD/LD表示低温下短日照效果。共鉴定出50个差异表达的光合作用相关蛋白,包括PSⅡ反应中心蛋白、PSⅠ反应中心蛋白、捕光叶绿素蛋白复合物、卡尔文循环和C4循环相关蛋白(见表1~4)。
2.2.2 叶片中光合作用蛋白表达变化
本试验结果表明,PsbE的α亚基DL/CHU和LL/CHU均显著下调,SD/LD显著上调,说明PSⅡ核心复合体受低温和光周期影响,其中受低温短日照影响程度显著小于低温长日照;放氧增强蛋白1(PsbO)、放氧增强蛋白2(PsbP)和放氧增强蛋白3(PsbQ)在低温短日照下显著下调表达,在低温长日照下PsbO和PsbP丰度稳定,PsbQ下调,表明低温短日照对放氧增强蛋白的不利影响大于低温长日照;推测光系统Ⅱ修复蛋白PSB27-H1和PsbH受低温影响显著下调。上述结果说明低温和光周期对PSⅡ复合体不同种类蛋白丰度影响不同,但多数蛋白受低温短日照影响较大。捕光复合物Ⅱ叶绿素a/b结合蛋白21(LHCb1)、捕光叶绿素a/b结合蛋白151(LHCb2)、捕光叶绿素a/b结合蛋白13(LHCb3)、捕光叶绿素a/b结合蛋白CP29.1(LHCb4)、捕光叶绿素a/b结合蛋白CP26(LHCb5)和捕光叶绿素a/b结合蛋白CP24 10A(LHCb6)的SD/CHU和LD/CHU均显著下调,其中LHCb2、LHCb3、LHCb4、LHCb5和LHCb6的SD/LD显著上调(见表1),捕光天线蛋白丰度受低温短日照影响程度小于低温长日照。LHCII下调降低光能吸收能力,影响光合作用。

图1 光周期对低温锻炼期笃斯越橘叶绿素荧光参数的影响Fig.1 Effect of photoperiod on chlorophyll fluorescenceparameters in bog bilberriesduring cold acclimation stage
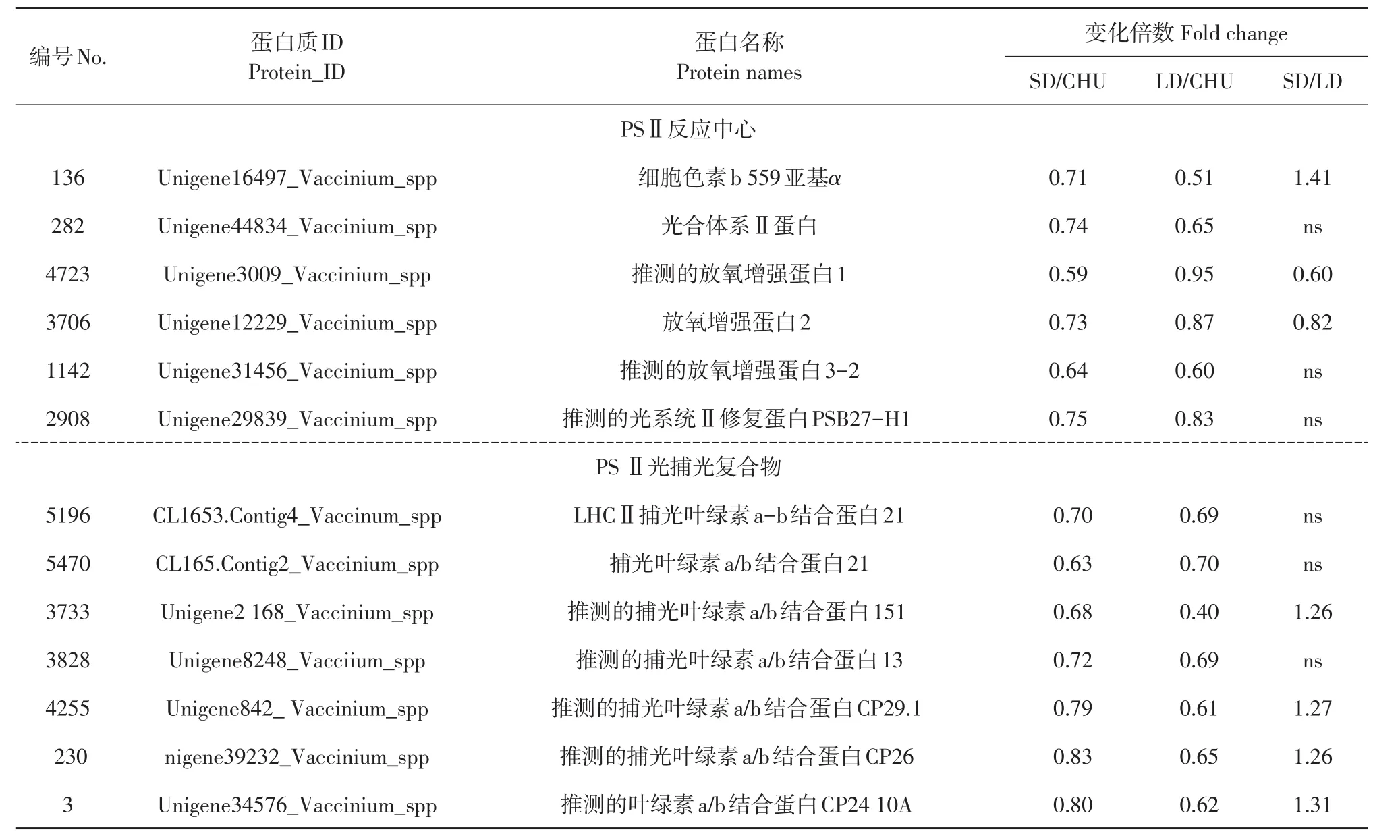
表1 鉴定的笃斯越橘叶片响应低温和不同光周期差异表达的PSⅡ反应中心蛋白和PSⅡ光捕光复合物Table1 Identified differential expression of photosystem IIreaction center protein and PSⅡlight harvesting complexⅡin leaves of bog bilberry in response to low temperature and different photoperiod
本研究中,PsaE在低温长日照下与对照无差异,而P700叶绿素a脱辅基蛋白A2(PsaB)、PSⅠ反应中心亚基Ⅲ(PsaF)、PsaK和Ⅺ(PsaL)、Ⅳ(PsaE)、V(PsaG)、O 亚基(PsaO)、N 亚基(PsaN)在低温短日照和长日照处理后均显著下调,其中PsaK和PsaN下调仅受低温影响,其余亚基在低温短日照下降幅显著小于低温长日照(见表2),说明不同种类PSⅠ复合体亚基丰度受低温和光周期影响程度不同,多数亚基受低温长日照影响较大。PSⅠ复合体重构,影响光合电子传递,降低光合速率。在低温短日照下质体蓝素(PC)和铁氧还原蛋白(Pd)丰度下调,低温长日照下丰度未发生变化或上调,说明低温短日照严重影响光合电子传递和光合作用。
本研究中两种低温锻炼条件下ATP合酶β、γ、δ、ε和b亚基丰度均下调,其中δ亚基的SD/LD下调,b亚基的SD/LD上调,其余亚基SD/LD无显著差异(见表3),上述结果说明ATP合酶大多数亚基受低温影响丰度下调,而δ亚基和b亚基受光周期影响较大。ATP合酶亚基丰度降低,影响ATP合成,进一步影响光合作用卡尔文循环,降低光合速率。
参与卡尔文循环的核酮糖二磷酸羧化酶小链、3-磷酸甘油醛脱氢酶(胞质)、果糖1,6-二磷酸醛缩酶、果糖1,6-二磷酸酶和转酮醇酶丰度均受低温短日照影响而显著增加;其中3-磷酸甘油醛脱氢酶(胞质样)、果糖1,6二磷酸酶(叶绿体)增加幅度大于低温长日照;叶绿体3-磷酸甘油醛脱氢酶(GAPCP1)和核酮糖二磷酸羧化酶小链增加幅度小于低温长日照,其余两种酶仅受低温影响而上调。卡尔文循环相关酶3-磷酸甘油酸激酶、3-磷酸甘油醛脱氢酶A亚基和B亚基、丙糖磷酸异构酶和核糖5-磷酸异构酶丰度均受低温短日照影响而显著降低,其中与低温长日照相比,3-磷酸甘油醛脱氢酶A亚基降幅较小,丙糖磷酸异构酶降幅较大,其余3种酶仅受低温影响(见表4)。
由表4可知,低温短日照下NAD-依赖的苹果酸酶59 ku同工型和天冬氨酸转氨基酶丰度上调(前者与低温长日照无显著差异,后者显著高于低温长日照),利于CO2和丙酮酸形成,而NADP依赖性苹果酸酶和丙酮酸磷酸二激酶在低温短日照下调(下调程度接近或低于低温长日照),影响CO2形成和磷酸烯醇式丙酮酸(PEP)生成改变C4循环。结果说明笃斯越橘存在的C4循环受低温锻炼环境的影响,其中低温短日照下影响较小;推测NAD-依赖的苹果酸酶和天冬氨酸转氨基酶上调,说明其在低温抗性反应中发挥作用。

表2 鉴定的笃斯越橘叶片响应低温和不同光周期差异表达的PSⅠ反应中心蛋白Table 2 Identified differential expression of photosystem I reaction center proteins in leaves of bog bilberry in response to low temperature and different photoperiod

表3 鉴定的笃斯越橘叶片响应低温和不同光周期差异表达的光合电子传递蛋白和ATP合成酶亚基Table 3 Identified differential expression proteins involved to photosynthetic electron transpor and subunit of ATPsynthasein leaves of bog bilberry in response to low temperature and different photoperiod

表4 鉴定的笃斯越橘叶片响应低温和不同光周期的光合生物碳固定相关差异表达蛋白Table4 Identified differential expression proteinsrelated to carbon fixation in photosynthetic organisms in leaves of bog bilberry in response to low temperature and different photoperiod
3 讨论与结论
3.1 低温和短日照对笃斯越橘叶绿素荧光参数的影响
秋季低温和缩短光周期是树木停止生长和(或)降低光合作用的信号,不同物种对环境信号反应不同[12]。低温可引起植物叶片光合机构损伤,影响PSⅡ反应中心光合电子传递和光合磷酸化过程,引起碳反应相关酶变化[13]。光周期也是引起木本植物秋季光合作用下降的重要信号。本研究中两种低温锻炼条件均使笃斯越橘叶片Fo显著上升,Fv/Fm和Fv/Fo显著下降,ΦPSⅡ、有效电子传递效率ETR和qP显著降低,说明低温导致PSⅡ反应中心发生部分失活或伤害,降低反应中心对激发能捕获能力和光合电子由PSⅡ反应中心向质体醌(QA、QB、PQ)库传递效率,影响光合速率。
3.2 低温短日照对笃斯越橘光合相关蛋白表达的影响
光合作用是植物体内复杂的生理生化代谢过程,包括光能捕获与转化、水光解、电子传递、光合磷酸化、碳同化及同化物转化与运输等。本研究发现受低温和短日照影响,笃斯越橘光合电子传递相关蛋白丰度显著下调,大量参与卡尔文循环的蛋白上调,这可能是对低温胁迫的特殊反应,保护植物免受光抑制。
3.2.1 低温和短日照对笃斯越橘光合机构及光合电子传递相关蛋白表达的影响
通过KEGG分析得知,经低温锻炼后植株光合作用PSⅡ反应中心和LHCⅡ、PSⅠ反应中心蛋白及光合电子传递相关蛋白显著下调,说明低温可能导致ROS积累,破坏光合机构。本试验结果表明,放氧增强蛋白1(PsbO)、放氧增强蛋白2(PsbP)和放氧增强蛋白3(PsbQ)在低温短日照下丰度显著下调表达,在低温长日照下PsbO和PsbP稳定,PsbQ下调;此外低温锻炼环境导致笃斯越橘叶片PSⅡ复合体反应中心Cytb559α亚基和捕光叶绿素蛋白复合物LHCb1、LHCb2、LHCb3、LHCb4、LHCb5和LHCb6蛋白均下调表达,其中低温短日照下蛋白下降幅度小于低温长日照。本试验结果表明,低温和短日照组合环境严重破坏PSⅡ反应中心和捕光叶绿素蛋白复合物结构,使类囊体膜受损,光捕获能力和光合电子传递能力降低,与前文通过笃斯越橘叶绿素荧光参数变化测定结果一致。低温锻炼引起1个PSⅠ叶绿素脱辅基蛋白和8个PSⅠ反应中心亚基下调表达,表明低温导致笃斯越橘PSⅠ发生光抑制,降低光合能量生成能力,间接导致其后续光合产物合成量减少,影响其低温适应能力[14]。与低温长日照相比,PSⅠ反应中心对低温短日照适应能力较强。ATP合酶参与光合磷酸化和氧化磷酸化反应,利用与电子传递耦联的跨膜质子动力势将ADP和无机磷合成ATP。低温短日照下白桦(Betula platyphylla Suk)ATP合酶β亚基表达显著下调[15]。本研究笃斯越橘ATP合酶β、γ和ε亚基受低温影响下调表达;与低温长日照相比,δ亚基受低温短日照影响下调程度较大,而b亚基受低温短日照影响下调程度较小。ATP合酶不同亚基下调表达可能影响光合磷酸化产生ATP,间接影响卡尔文循环,减少抗寒保护物质可溶性糖合成量,降低笃斯越橘叶片低温适应能力。
3.2.2 低温和短光周期对笃斯越橘碳固定途径相关蛋白表达的影响
光合作用关键酶R ubisco小亚基参与CO2与Mg2+对酶的活化,维持和稳定酶的活化构象,影响Rubisco催化活性和专一性[16]。低温胁迫下两种绣线菊Rubisco小链含量显著增加[10];果糖-1,6-二磷酸醛缩酶参与糖酵解、卡尔文循环等代谢过程,是植物体糖代谢、可溶性糖积累关键酶之一;植物转酮醇酶(TK)也是植物卡尔文循环中起关键作用的酶类,参与1,5-二磷酸核酮糖再生及光合过程糖类转化与运输。本研究中Rubisco小链、果糖-1,6-二磷酸醛缩酶和酮醇酶受低温短日照影响上调,此外参与卡尔文循环的3-磷酸甘油醛脱氢酶、果糖1,6二磷酸酶与上述3种酶呈相同变化趋势,酶丰度上调可增加细胞可溶性糖浓度,有利于提高低温抗性;而3-磷酸甘油酸激酶、3-磷酸甘油醛脱氢酶A亚基和B亚基、丙糖磷酸异构酶和核糖5-磷酸异构酶丰度则受低温短日照影响显著降低。说明低温短日照下笃斯越橘通过调整卡尔文循环相关酶水平以应对低温对能量代谢的不利影响,可能是低温适应机制的一部分。
C3植物中存在C4循环[17],标志细胞有可能通过“CO2泵”的方式提高光合碳循环CO2浓度,使1,5-二磷酸核酮糖羧化酶催化方向朝有利于形成碳水化合物的方向运转。丙酮酸磷酸双激酶(PPDK)、天冬氨酸转氨基酶和NAD(P)-苹果酸酶是C4循环关键酶。在C4循环中,线粒体NAD-苹果酸酶(NAD-ME)和NADP-苹果酸酶(NADP-ME)是催化L-苹果酸脱羧的酶,其底物和产物参与光合作用[18];PPDK是C4途径限速酶,对光合功能具有重要调节作用。本研究中,低温短日照下NADP-苹果酸酶和PPDK显著下调表达,表明环境变化已严重影响笃斯越橘C4循环,而天冬氨酸转氨酶和NAD依赖性苹果酸酶59 ku上调表达降低上述不利影响,维持C4循环。
综上所述,在低温短日照处理后,笃斯越橘叶片中PSⅡ复合体反应中心Cytb559α亚基、放氧增强蛋白、光捕获复合体Ⅱ蛋白及PSⅠ反应中心亚基、质体蓝素、铁氧还蛋白3和ATP合酶亚基β、γ、δ、ε和b亚基含量均显著降低,导致光合机构受损及光合电子传递功能降低;笃斯越橘通过显著上调参与卡尔文循环核酮糖-1,5-二磷酸羧化酶小链、3-磷酸甘油醛脱氢酶、果糖1,6-二磷酸醛缩酶、果糖1,6-二磷酸酶和转酮醇酶的表达,显著下调3-磷酸甘油酸激(叶绿体)、3-磷酸甘油醛脱氢酶A亚基和B亚基、丙糖磷酸异构酶和核糖5-磷酸异构酶的表达以适应低温环境。低温短日照下与C4循环有关的酶上调或下调表达间接影响光合碳同化。

