真核翻译起始因子4G1在非小细胞肺癌中的表达及意义
陆 英, 虞珊珊, 马 钻, 白宝鑫, 王光学, 徐增光
(同济大学附属东方医院转化医学研究中心,上海 200120)
肺癌是高死亡率的恶性肿瘤,分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)两大类,其中NSCLC占80%~85%[1]。目前,传统的治疗手段(手术及放化疗)在提高NSCLC的5年生存率方面遇到了瓶颈,而随着近年转化医学的研究推进,一些靶向药物开始应用于临床[2]。如靶向表皮生长因子受体(epidermal growth factor receptor, EGFR)、Kirsten鼠肉瘤原癌基因同源体(kirsten rat sarcoma viral oncogene homolog, KRAS)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等[3-4]能延长晚期NSCLC患者的无进展生存期,但最终会出现耐药,因此迫切需要寻找新的分子靶标[5]。最近研究发现,真核翻译起始因子4G1(eukaryotic translation initiation factor 4 gamma 1, EIF4G1)与肿瘤的发生发展密切相关。EIF4G1是转录起始因子复合物EIF4F的组成蛋白之一[6],该复合物最重要的功能是将mRNA募集到核糖体上,从而启动蛋白质合成。在蛋白质翻译过程中,EIF4G1作为支架蛋白,使其他与翻译起始有关的因子与之结合并发挥各自的作用[7]。已有报道显示,EIF4G1基因在卵巢癌、鼻咽癌、乳腺癌中表达明显增高,促进肿瘤细胞蛋白翻译、肿瘤血管生成、细胞恶性转化和抗凋亡[8-11]。EIF4G1位于染色体3q27上,在50%的肺癌中检测到该区域有非正常的扩增[12]。本研究通过检测NSCLC组织中EIF4G1 mRNA和蛋白表达水平,分析其与NSCLC疾病发生及临床病理特征的关系,为NSCLC的诊断及靶向治疗提供新思路。
1 材料与方法
1.1 一般资料
选取2015年10月至2017年12月在同济大学附属东方医院行手术切除治疗的NSCLC患者81例,其中男性49例,女性32例,取其癌组织和癌旁组织进行实验。患者年龄43~79岁,中位年龄63岁;病理类型: 鳞癌25例,腺癌46例,其他类型10例(包括大细胞癌3例、腺鳞癌3例、肉瘤样癌1例、类癌2例和未分类癌1例)。采用1997年国际抗癌联盟(UICC)规定的肺肿瘤TMN分期标准进行分期。分化程度: 高分化9例,中分化30例,低分化42例。纳入标准: (1) NSCLC标本来源于本院心胸外科手术后标本并经病理学证实;(2) 术前均未接受放疗或化疗;(3) 各项临床资料完整;(4) 项目获同济大学附属东方医院伦理委员会批准,患者按伦理要求已签署知情同意书。
1.2 标本采集
每位患者取手术切除的新鲜肺癌组织及癌旁组织0.1~0.2g各2份,1份立即置于200μL RNAlater®Solution(美国Ambion公司)溶液中,4℃冰箱过夜后,置于-80℃冰箱保存,用于RNA提取。另1份置于10%的中性甲醛中,4℃保存,用于免疫组化染色。
1.3 NSCLC癌和癌旁组织总RNA提取
将组织样本从-80℃冰箱取出,吸干RNAlater®Solution后,加入500μL TRIzol试剂,用高速乳化分散机将组织块充分匀浆后,按照5∶1比例加入氯仿(TRIzol 500μL∶氯仿100μL),于漩涡振荡器剧烈震荡,颠倒混匀,置于冰上静置10min。4℃ 12000r/min,离心半径5cm,离心15min,吸取上层水相溶液,加入等体积异丙醇,于冰上静置10min,4℃ 12000r/min离心10min。弃上清液,加入1mL预冷的75%乙醇,4℃ 12000r/min,离心5min。弃上清液,室温放置3~5min,待乙醇完全挥发后,加入20~60μL预冷的不含DNA酶/RNA酶的双蒸水(DEPC-ddH2O),溶解RNA。
1.4 NSCLC癌和癌旁组织RNA纯度和浓度测定
使用预混了GelRed的1%琼脂糖凝胶,加1×TAE电泳缓冲液至液面覆盖凝胶。在超净工作台上,用移液器吸取总RNA样品4μL于封口膜上,再加入5μL 1×TAE电泳缓冲液及1μL的10×载样缓冲液,混匀后,加入点样孔。将电压调节至100V,电泳30min后,在紫外透射检测仪上观察RNA电泳结果。使用ADU 600紫外分光光度仪测定260、280nm吸光度值(A260、A280),采用A260/A280>1.8的RNA纯度较好的标本。
1.5 cDNA的合成
采用日本TaKaRa公司反转录试剂盒,总RNA 0.5μg,5×PrimeScript缓冲液2μL,反转录酶复合物(PrimeScript RT Enzyme Mix)0.5μL,Oligo dT Primer(50μmol/L)0.5μL, Random 6 mers(100μmol/L)0.5μL,总体积为10μL。反转录反应,37℃,15min。反转录酶失活反应,85℃,5s。将得到的反转录(RT)反应液加入到下一步的实时聚合酶链反应(real-time PCR)体系中。
1.6 real-time PCR反应检测EIF4G1 mRNA表达水平
采用日本TaKaRa公司real-time PCR试剂盒,美国ABI公司7500 real Time PCR仪。2×SYBR Primix Ex Taq 10μL,PCR Primer(10μmol/L)0.4μL,50×ROX Reference Dye Ⅱ 0.4μL,DNA模板2.0μL,总反应体积20μL。反应条件为: 95℃预变性30s,接着进行40个循环,95℃变性5s,60℃退火延伸34s。引物序列: 以甘油醛-3-磷酸脱氢酶(GAPDH)为内参照,正向引物5′-GTGTCCAGCCT-GAATTCCACT-3′,反向引物: 5′-CACCCTGTTGC-TGTAGCCAAA-3′。EIF4G1正向引物: 5′-TTGTG-GATGATGGTGGCT-3′,反向引物: 5′-TTATCTGT-GCTTTCTGTGGGT-3′。采用比较CT值的相对定量法(ΔΔCt法)来比较mRNA表达的差异: ΔCt=Ct(EIF4G1)-Ct(GAPDH)表示目的基因(EIF4G1)表达的相对拷贝数,ΔCt值越低,实际拷贝数越高。ΔΔCt=ΔCt癌组织-ΔCt癌旁组织,以N=2-ΔΔCt表示癌组织EIF4G1的表达相对于癌旁组织的变化倍数。
1.7 免疫组织化学染色检测EIF4G1蛋白表达
手术切除的肺癌组织及癌旁组织经10%的中性甲醛中固定,石蜡包埋,然后切成5μm厚切片。将切片置于抗原修复溶液中(丹麦Dako公司),95℃加热20min。加入小鼠抗人单克隆抗体EIF4G1(1∶200,英国Abcam公司),4℃孵育过夜。IgG抗体作为阴性对照。辣根过氧化物酶结合的山羊抗鼠二抗(丹麦Dako公司试剂盒)在室温下孵育30min。最后,用二氨基联苯胺(DAB)底物试剂盒显色、中性树胶封片后,光学显微镜镜检。
1.8 EIF4G1蛋白表达的半定量评分
组织细胞的胞质或胞膜呈清晰棕黄色颗粒的瘤细胞定为阳性细胞,每张切片选择3个区分别在400倍视野下连续计数200个瘤细胞,半定量分析0~4计分标准: 0分=无阳性细胞,1分=阳性细胞占比≤25%,2分=阳性细胞占比25%~≤50%,3分=阳性细胞占比50%~≤75%,4分=阳性细胞占比75%~100%。
1.9 统计学处理
2 结 果
2.1 EIF4G1 mRNA在NSCLC癌和癌旁组织中的表达特点
NSCLC癌组织中ΔCt值(6.91±1.87)明显低于癌旁组织的ΔCt值(8.33±1.69),差异有统计学意义(t=7.01,P<0.001)。鳞癌、腺癌和其他类型肺癌组织的ΔCt的值分别为7.40±1.69、6.70±1.92和6.22±2.18,均明显低于其相应癌旁组织的8.26±1.58、8.35±1.75和8.86±2.52(t=-2.82,-6.58、-4.19,均P<0.05),见表1。
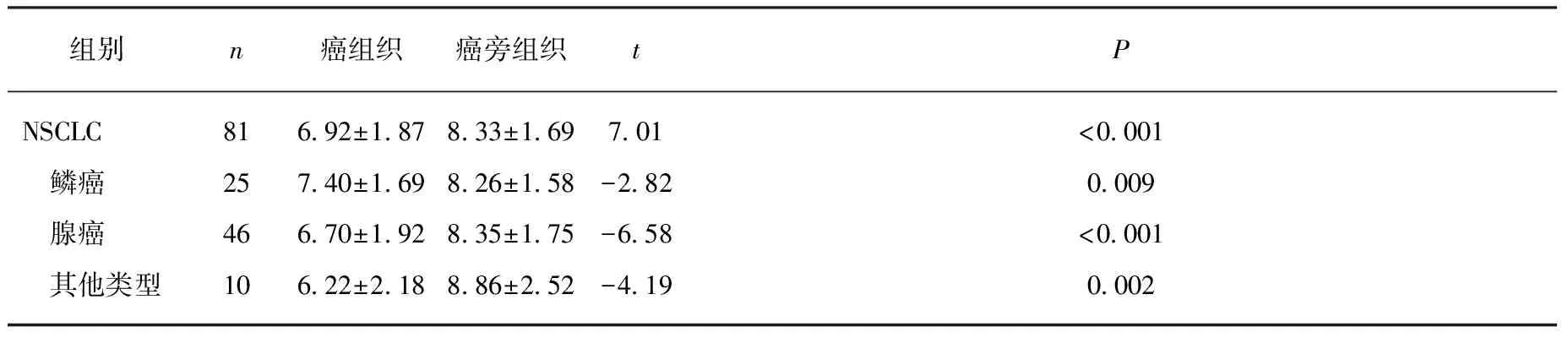
表1 EIF4G1 mRNA在NSCLC癌组织和癌旁 组织中的表达差异
2.2 EIF4G1 mRNA表达强度与NSCLC临床病理特征的关系
EIF4G1 mRNA在低分化癌中的表达强度明显高于中分化癌和高分化癌(F=14.034,P<0.001),而其在中分化癌和高分化癌中表达的差异无统计学意义(P>0.05);EIF4G1 mRNA在临床分期Ⅳ期的表达强度明显高于Ⅰ、Ⅱ、Ⅲ期(F=11.84,P<0.001),而其在Ⅰ、Ⅱ、Ⅲ之间的表达差异无统计学意义(均P>0.05)。年龄、性别及病理组织分型间EIF4G1 mRNA的表达强度差异无统计学意义(均P>0.05),见表2。
进一步将EIF4G1 mRNA在癌组织和癌旁组织中的表达升高倍数2-ΔΔCt值≥2作为EIF4G1 mRNA在癌组织中高表达,进行Logistic回归分析,结果显示: 癌组织的分化程度与EIF4G1的高表达密切相关(OR=23.74,P<0.001)。而年龄、性别、组织类型和临床分期与EIF4G1的高表达无明显相关性(均P>0.05),见表3。
2.3 NSCLC组织中EIF4G1蛋白水平与NSCLC细胞分化程度的关系
免疫组化法结果显示EIF4G1在NSCLC癌细胞胞质中呈特异性高表达(图1),通过对NSCLC癌组织中EIF4G1含量进行半定量评分发现: EIF4G1在低分化的鳞癌和腺癌中的表达强度分别为3.2±0.5和2.9±0.4,明显高于在中分化(2.1±0.3,t=8.20;2.3±0.4,t=3.35,均P<0.05)和高分化癌中的表达(1.2±0.2,t=22.36;1.3±0.2,t=17.89,均P<0.05)。
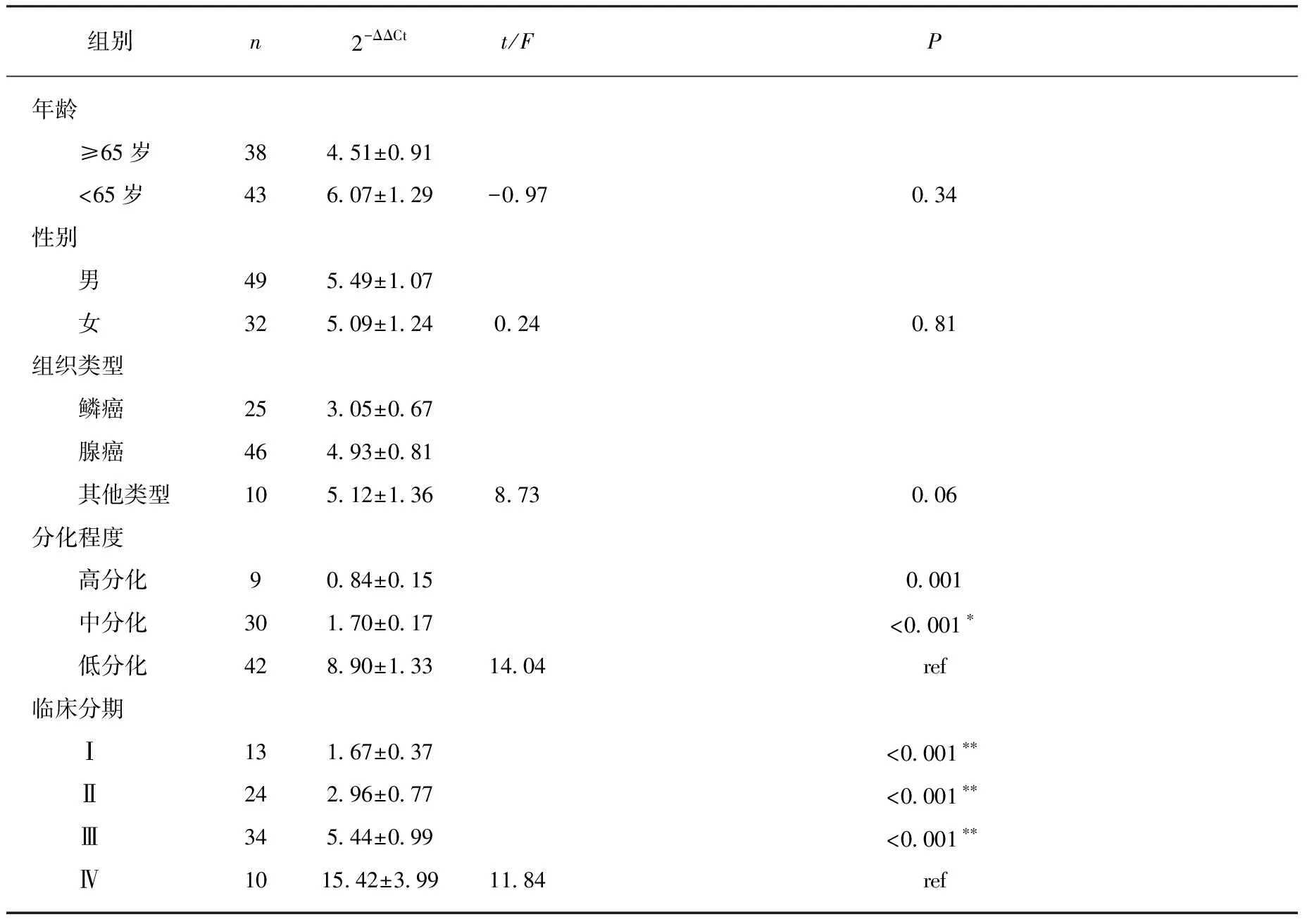
表2 EIF4G1 mRNA在NSCLC癌组织中的表达强度与 患者临床病理特征的关系
*表示高分化、中分化分别与低分化癌比较;**表示Ⅰ、Ⅱ、Ⅲ期分别与Ⅳ期比较;ref表示对照组
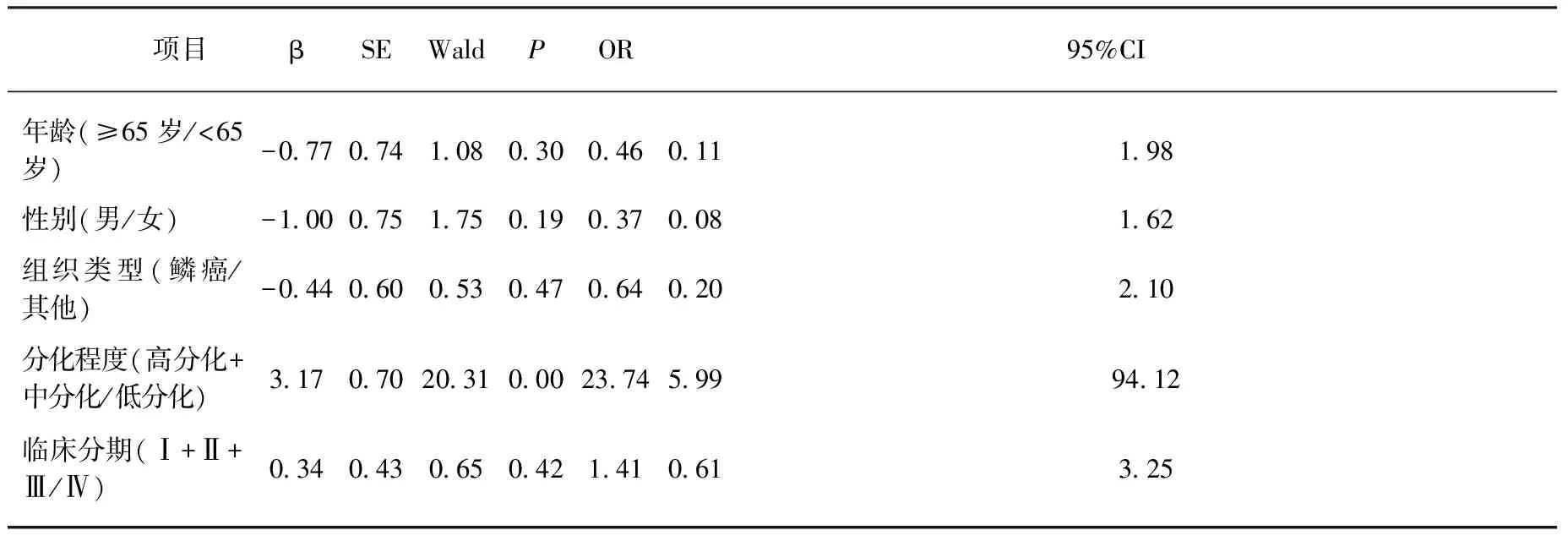
表3 影响EIF4G1 mRNA在NSCLC癌组织中高表达的Logistic回归分析
3 讨 论
肺癌是最常见的癌症之一,也是在世界范围内死亡率最高的癌。NSCLC治疗难、转移快,大部分患者确诊时已发生癌转移或处于癌晚期。传统的化疗方案虽能够一定程度上改善患者的生存率和死亡率,但总体效果不佳,全身毒副作用大,容易产生耐药,不适合长期运用。目前,治疗NSCLC的方案有走向靶向治疗的趋势,针对一些肿瘤靶点的药物,已进入临床使用。以EGFR突变型NSCLC为例,EGFR-TKI治疗目前已主要用于NSCLC一线、二线和维持治疗中,相比于传统化疗,使用特异性的靶向治疗,患者可以获得更长的生存期,且副作用较小[13-14]。但是这种针对EGFR突变使用酪氨酸激酶抑制剂吉非替尼、厄洛替尼等治疗的方法仅对EGFR突变型的NSCLC患者有效[15-16],因此需要寻找新的、特异性的肿瘤标志物作为治疗NSCLC的靶点。
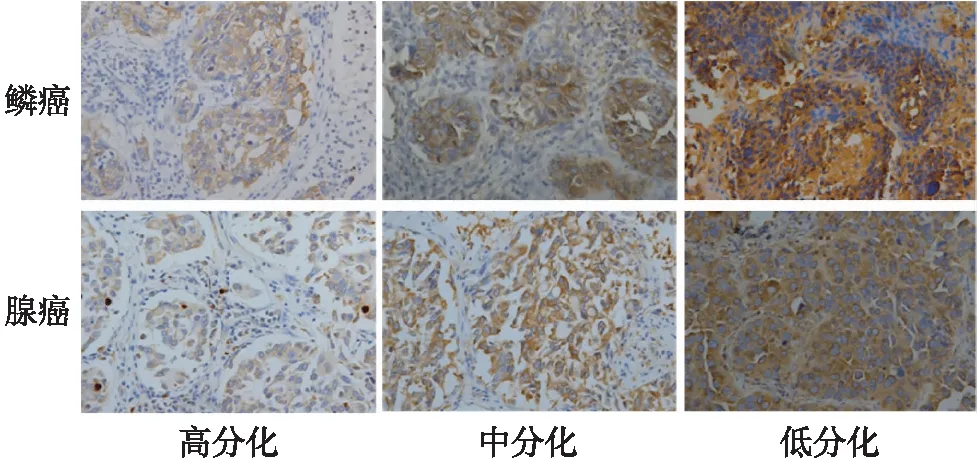
图1 EIF4G1在不同分化程度的NSCLC癌组织中的表达Fig.1 The expression of EIF4G1 at the protein level in NSCLC cancer tissues with different differentiation
肿瘤的形成和发生发展过程是一个复杂的多方联合、多因子参与的连续过程,期间涉及一些关键的癌基因和抑癌因子的作用。EIF4G1除了促进蛋白翻译,在真核细胞翻译起始阶段发挥重要作用外,也与肿瘤的发生、发展密切相关。目前已经研究证实EIF4G1作为潜在的分子靶点,有望成为部分肿瘤的预后指标,对肿瘤的诊断、治疗和预后监控等具有重要意义。如在鼻咽癌中的研究发现,EIF4G1蛋白的表达水平与肿瘤分级、临床分期和淋巴结转移呈正相关,并且是影响鼻咽癌患者总生存率的危险因素[9]。在乳腺癌研究中发现,EIF4G1在晚期患者癌组织中的表达明显高于早期,EIF4G1表达增高与增强癌细胞DNA损伤修复、防止细胞自噬和凋亡密切相关[10]。然而EIF4G1在NSCLC患者中的表达规律暂未见报道。因此本研究通过real-time PCR和免疫组化技术在81例NSCLC患者中发现,EIF4G1 mRNA和蛋白水平在癌组织中的表达明显升高,且EIF4G1的表达强度与肿瘤细胞的分化程度密切相关,分化越差,EIF4G1的表达越高。晚期NSCLC患者EIF4G1的表达强度明显高于早期。而EIF4G1的表达强度在肿瘤病理类型、年龄和性别之间无统计学差异。综合上述研究,提示EIF4G1是一个与NSCLC肿瘤生长密切相关的分子。本研究结果填补了EIF4G1在NSCLC中的研究空白,其结果符合EIF4G1在部分其他肿瘤中的表达特征,丰富了EIF4G1与肿瘤关系的临床病理研究。
本研究中应用Logistic回归模型分析EIF4G1 mRNA在NSCLC癌组织中高表达的影响因素,发现EIF4G1 mRNA的高表达与癌组织的分化程度密切相关,其局限性在于: (1) 本研究只收集到81例NSCLC肿瘤样本,标本量较小,但是EIF4G1 mRNA高表达与癌组织分化程度之间具有相关性的初步研究结果还是具有一定的临床意义;(2) 本研究为对照研究,Logistic回归模型分析提示EIF4G1 mRNA高表达与癌组织分化程度具有相关性,但是无法确定两者之间的因果关系。为进一步明确EIF4G1 mRNA高表达的影响因素,尚有待于大规模、前瞻性的研究加以证实。
有研究者通过串联亲和纯化及质谱分析(TAP-MS)发现EIF4G1与定位于细胞质的去泛素化酶USP10为互作蛋白,而USP10已证实能特异的去泛素化并稳定p53,从而调节p53依赖的下游功能。在DNA损伤应激条件下,USP10 42位苏氨酸及337位丝氨酸被ATM激酶磷酸化,磷酸化修饰能稳定USP10并促使USP10入核并去泛素化p53,从而调节p53下游网络功能[17]。迄今为止,p53是人类所发现最重要的抑癌因子之一。作为转录因子,p53通过调控下游靶基因调节多种细胞学反应。例如,p53通过作用于CDK抑制因子p21调节细胞周期G1阻滞,通过作用于凋亡先导因子PUMA和Bax调控细胞凋亡,通过作用于糖酵解调节因子TIGAR调控能量代谢,通过作用于AMPK调控细胞自噬作用[18-20]。除了转录因子依赖的功能以外,p53还能通过蛋白质相互作用的方式调控细胞凋亡。通过作用于野生型p53,USP10能行使抑癌因子的功能。而本研究组前期应用免疫共沉淀方法发现,EIF4G1在肺癌细胞系A549中可与USP10相互结合。关于靶分子EIF4G1是否能通过与USP10结合,抑制USP10稳定P53的功能,从而抑制P53调控的抑癌作用,最终在癌细胞中发挥促癌作用,其确切的作用机制还有待进一步的深入研究。
综上所述,EIF4G1在NSCLC癌组织中特异性高表达,并与肿瘤细胞的分化程度及临床分期密切相关,说明EIF4G1与NSCLC肿瘤的生长及转移相关。在后续研究中将深入探讨EIF4G1参与肿瘤发生发展的分子机制,为NSCLC疾病的诊断及治疗提供新的分子靶点。

