低剪应力对兔颈动脉粥样硬化进展的影响
夏良华, 孙雨晴, 马雨琴, 顾俊毅, 张 波
(同济大学附属东方医院医学超声科,上海 200120)
动脉粥样硬化病变优先发生在动脉的分叉和弯曲区域,造成血流特征性改变,包括剪应力降低和湍流增加,提示低剪应力是动脉粥样硬化形成的重要因素[1-2],但其具体作用方式及其影响程度尚不清楚。20世纪60年代人们提出了两种关于动脉粥样硬化的剪应力病因学假说,解释了壁面剪应力(wall shear stress, WSS)对动脉粥样硬化形成的影响[3-4]。近年来,大量的研究证明低剪应力(low shear stree, LSS)促进了在体动脉腔内和血管壁之间低密度脂蛋白的转移和炎症细胞的迁移,泡沫细胞的形成,从而导致动脉粥样硬化形成[5-6]。体外实验证实,持续降低的WSS可刺激动脉内膜增厚、中膜平滑肌细胞增殖,提示WSS减低是形成动脉粥样硬化的原因之一[7-8]。可能的机制是WSS直接刺激内皮细胞(endothelial cells, ECs)表面的机械感受器,这些机械感受器依次触发细胞内信号传导,最终导致转录因子激活,并转移到细胞核和基因中,随后导致促动脉粥样硬化基因表达增加,从而诱导动脉粥样硬化形成[9-11]。本研究拟通过建立LSS动物模型探讨LSS对兔颈动脉粥样硬化形成的影响。
1 材料与方法
1.1 实验动物及动物模型建立
雄性新西兰大白兔16只,体质量2.2~2.5kg,采购自同济大学医学院实验动物中心。适应性喂养1周后,将实验动物分为2个组: 假手术组(对照组)及颈动脉缩窄组(LSS组),每组各8只。所有兔均单笼正常喂养,自由饮水,每只兔进食普通饲料150g/d。通过左侧颈动脉缩窄手术建立兔颈动脉LSS动物模型。所有实验动物术前12h禁食,不禁水。耳缘静脉缓慢推注3%的戊巴比妥钠30mg/kg全身麻醉,兔取仰卧位,颈过伸,固定于兔台上,颈部去毛,以碘伏常规消毒,手术在无菌条件下进行;采用颈正中切口,显露并分离左侧颈总动脉;以血管夹夹闭其近心端,在暴露的颈总动脉近心端动脉旁放置一根钝的8号注射器针头(直径0.8mm),然后用2-0/T缝合线穿过颈总动脉连同针头一起结扎;结扎后抽出针头,松开血管夹恢复血流。经超声检查验证,颈动脉直径狭窄率控制在50%~60%为建模成功。在假手术组兔中,除最后一步不结扎颈总动脉,其余操作步骤与LSS组相同。本实验通过同济大学附属东方医院医学伦理委员会审批,并严格按照伦理要求进行实验操作。
1.2 兔颈总动脉超声检查
所有动物术前进行超声检查1次,术后每隔2周检查1次。检查前12h禁食,不禁水,经兔耳缘静脉推注3%戊巴比妥钠30mg/kg全身麻醉,取仰卧位固定并充分暴露颈部,颈部脱毛处理。选择Philips iE33超声诊断仪,使用专用动物超声血管探头(L15-7io),探头频率为10MHz,对左右侧颈总动脉行二维超声、彩色多普勒及脉冲频谱多普勒超声检查。分别在左右侧颈动脉分叉处下方约2cm处,采集3个心动周期的颈总动脉长轴的二维彩色多普勒血流图像,并观察血管内情况,测定左侧颈总动脉内径(inner diameter, D)、内中膜厚度(internal-media thickness, IMT)、收缩期峰值流速(peak systolic velocity, PSV)及阻力指数(resistive index, RI)。
1.3 剪应力定量分析软件测定兔颈总动脉WSS
在颈动脉血流中,WSS是单位面积上由血管表面流动的液体产生的接近管壁的切向摩擦力。本研究采用WSS定量分析(MATLAB)软件平台[12],导入动态二维彩色多普勒血流图像(dicom文件)进行分析处理(图1A),程序经对兔颈动脉彩超图像的预处理、配准和融合(图1B~图1D),自动生成颈总动脉的WSS数据,同时绘制WSS分布的三维WSS空间图。如图2所示,WSS定量分析软件能在颈总动脉内同时获取约500个取样点的WSS值,显示三维WSS空间分布图,其中X轴表示沿血管长轴的横向位移,Y轴表示垂直于血管长轴(血管短轴)的纵向位移,Z轴以波幅形式表示WSS的大小。因此,三维WSS空间分布图能获得颈总动脉WSS分布的可视化效果,也可用以观察其与血管壁的关系。该软件可读取沿颈总动脉前壁与后壁约500个取样点WSS数值,结果以Excel表格方式保存,并根据数值范围的不同进行分类,2~30dyne/cm2平均分为15组,第1组G1: (2,4) dyne/cm2,第2组G2: (4,6) dyne/cm2以此类推,第14组G14: (28,30) dyne/cm2,第15组G15: (30,+∞) dyne/cm2。
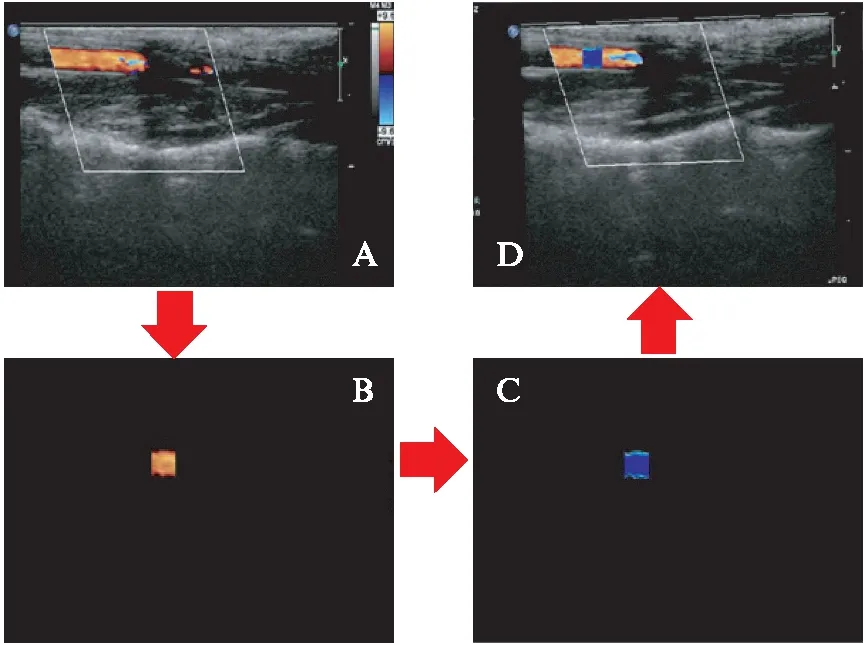
图1 定量分析软件分析正常组家兔颈动脉WSS分布Fig.1 WSS distribution of carotid artery analyzed by WSS quantitative analysis software in normal rabbitsA: WSS定量分析软件导入正常组家兔颈总动脉超声dicom图像;B: 提取感兴趣区内的彩色多普勒血流图像;C: 计算选取区域内的部分颈总动脉血管内WSS,生成颈总动脉长轴血流剪应力二维空间分布图;D: 生成WSS分布与颈动脉长轴血管超声多普勒血流的融合图像
1.4 病理标本的制作
兔死亡或处死后留取左侧颈总动脉,用生理盐水轻轻冲洗后,经4%多聚甲醛4℃过夜固定,石蜡包埋、切片(片厚3μm),二甲苯脱蜡,行苏木精-伊红(H-E)染色,光学显微镜下观察血管内中膜脂质沉积、泡沫细胞浸润、纤维帽及纤维板块形成情况,根据镜下观察结果将实验兔颈动脉的动脉粥样硬化程度分为脂质条纹期、纤维斑块期、粥样斑块期以及复合病变期。
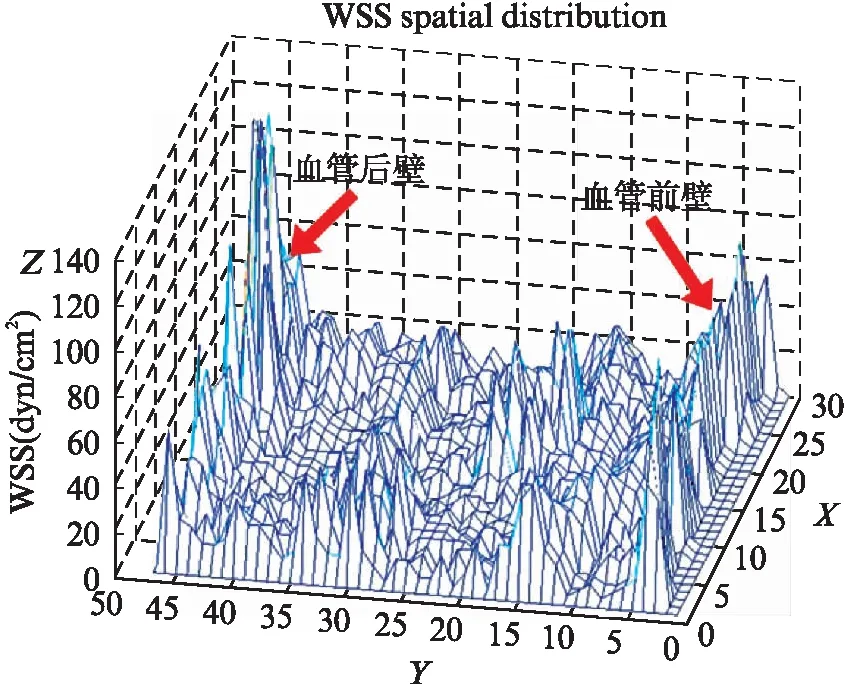
图2 正常组家兔颈动脉WSS三维空间分布图Fig.2 WSS spatial distribution of carotid artery in normal rabbits应用WSS定量分析软件绘制正常组家兔颈动脉长轴血流剪应力三维空间分布图,X轴表示沿血管长轴的位移(血管长度),Y轴表示沿血管短轴的位移(血管内径),Z轴以波幅形式表示WSS的大小(单位为dyne/cm2),图中箭头所指为颈动脉前壁及后壁
1.5 统计学处理
2 结 果
2.1 超声检测LSS模型兔颈动脉参数变化
术后所有兔均存活,对照组兔术后6周死亡1只,LSS组术后6、7周各死亡1只,主要死因为感染。不同时间点对照组及LSS组兔颈动脉各项参数测定结果见表1。与术前比较,对照组术后4、8周兔颈动脉D、IMT、PSV及RI均无明显变化(均P>0.05);与对照组比较,LSS组术后4、8周兔颈动脉D、PSV及RI均明显减低(均P<0.05);与对照组比较,术后8周LSS组兔颈动脉IMT增加(P<0.05),提示动脉粥样硬化形成。超声检查见LSS组兔颈动脉血流呈低阻低排改变,见图3。
表1 各时间点兔颈动脉超声检查测量参数
与对照组相比,#P>0.05;*P<0.05;**P<0.01
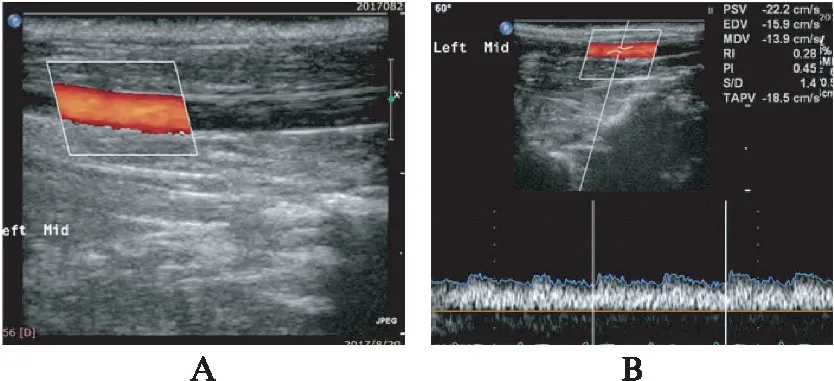
图3 LSS组兔颈动脉超声检查示血流呈低阻低排改变Fig.3 The ultrasonic images showing low flow rate of carotid artery in LSS groupLSS组家兔术后4周行左侧颈总动脉彩色多普勒模式(CDFI)显示动脉管腔内血流充盈情况(A),脉冲频谱多普勒模式(PW)显示颈总动脉内血流呈低阻低排改变(B)
2.2 LSS模型兔颈动脉WSS空间分布改变
如图4所示,术后8周对照组兔颈动脉的WSS主要分布在4~10dyne/cm2(83%),其中,4~6dyne/cm2占35%,6~8dyne/cm2占30%,8~10dyne/cm2占18%(图4A~4B);而术后8周LSS组兔颈动脉的WSS主要分布在2~6dyne/cm2(90%),其中,2~4dyne/cm2占70%,4~6dyne/cm2占20%(图4D~4E)。百分比堆积柱形图显示,术后各时间点对照组兔颈动脉血流WSS分布范围在4~10dyne/cm2(占78%),颈动脉血流WSS均值为(6.05±1.19)dyne/cm2(图4C);而LSS组兔颈动脉血流WSS分布呈现普遍减低,分布范围在2~6dyne/cm2(占81%),颈动脉血流WSS均值为(2.96±0.79)dyne/cm2(图4F)。
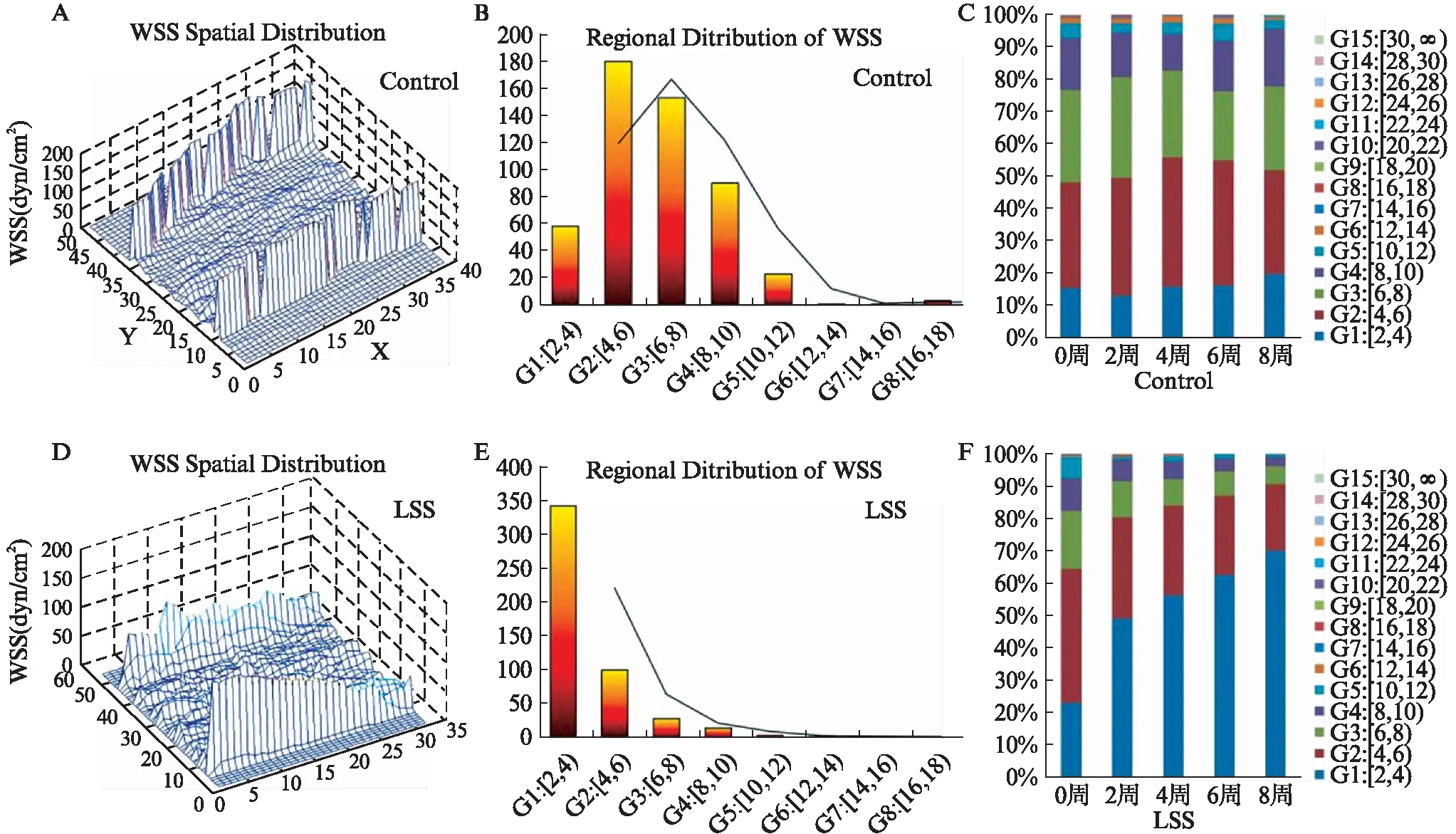
图4 正常组及LSS组兔颈动脉WSS分布Fig.4 WSS distribution of rabbit carotid arteryA: 正常组兔术后8周颈动脉血流WSS三维空间分布图;B: WSS数值分布范围分析;C: 各时间点颈动脉血流WSS分布;D: LSS组兔术后8周颈动脉血流WSS三维空间分布图;E: WSS数值分布范围分析;F: 及各时间点颈动脉血流WSS分布
2.3 LSS模型兔颈总动脉病理检查结果
术后8周取兔颈总动脉制成病理切片于显微镜下观察(图5)。LSS组中兔颈动脉出现不同程度的内-中膜不规则增厚、脂质沉积增加、泡沫细胞分布(图5B)。根据镜下观察进行动脉粥样硬化病理分期,LSS组中4只兔颈动脉处于脂质条纹期(66.7%),纤维斑块期1只(16.7%),正常内中膜1只(16.7%);而对照组的兔颈总动脉均为正常。
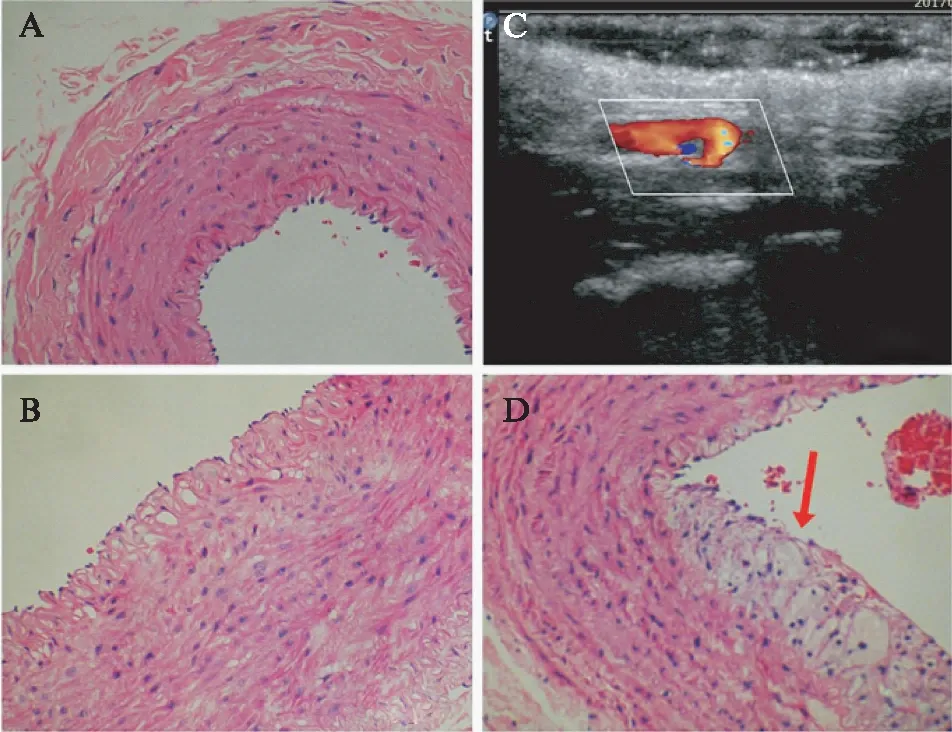
图5 正常组及LSS组兔颈动脉病理结果Fig.5 Observation of pathological section of rabbit carotid arteryA: 正常兔颈总动脉的病理切片H-E染色结果(×400);B: LSS组兔颈总动脉的病理切片H-E染色结果(×400),可见内-中膜不规则增厚、脂质沉积增加、泡沫细胞分布;LSS组兔颈总动脉超声显示血流充盈缺损(C)及其病理切片H-E染色结果(D,×400),病理切片可见纤维帽及动脉粥样硬化斑块形成(箭头所指)
3 讨 论
动脉粥样硬化的发病机制一直是心血管疾病研究的热点。虽然动脉粥样硬化形成与传统的心血管疾病的危险因素相关,但其病变优先发生的区域是在血管分支、分叉和弯曲等血流剪应力低或紊乱的区域[13]。这一部位的选择性被认为与血流动力学参数有关,尤其是WSS[14-15]。血管ECs在体内不断地受到血流剪应力的作用,这种血流动力环境对ECs的结构与功能产生重要影响。人体内大血管的生理范围剪应力为10~20dyne/cm2,血管分叉部位为30~100dyne/cm2,外周动脉为20~40dyne/cm2,静脉为1.5~6dyne/cm2[16]。在不同的剪应力作用下,血管内皮细胞表现出不同的形态结构[17]。研究[18]显示,持续的层流和生理的WSS可以诱导内皮细胞的椭球形态,并以时间相关的方式对血流的轴向方向进行排列。作为WSS中一种类型,LSS具有促动脉粥样硬化的作用。LSS刺激可增加氧化应激,诱导低密度脂蛋白在内皮下沉积,减少eNOS表达和NO产生,诱导炎症分子表达[19]。Walpola等[20]证明LSS通过激活JNK和NF-κB增加炎性细胞因子表达。此外,有文献报道LSS容易产生更大的易损斑块病灶,而紊乱的WSS则产生较小的稳定斑块病灶[21]。在本研究中,通过兔颈动脉血管超声检查发现术后8周LSS组兔颈总动脉出现IMT增加(P<0.05);兔颈总动脉病理切片中,LSS组中兔左侧颈总动脉出现不同程度的内-中膜不规则增厚、脂质沉积增加,甚至出现纤维帽形成及动脉粥样硬化斑块形成,而对照组的兔颈总动脉均为正常。由此说明LSS刺激可以促进动兔颈总动脉脉粥样硬化的形成。
建立稳定可靠的动物模型是动物实验的基础和开展相关研究的重要环节,目前颈动脉狭窄模型的制作方法有外科手术丝线结扎法,球囊损伤法,干燥空气损伤法,化学物质烧灼内膜法等[22-26]。以上方法或多或少会造成血管内膜或血管壁的损伤,且存在程序多,操作复杂,不能随意设定狭窄度等缺点。本实验经超声检查验证,建模成功后颈总动脉直径狭窄率控制为50%~60%,该狭窄程度在减少颈总动脉远端血流量的同时不会出现其他并发症。该方法稳定可靠,简单易行,狭窄血管的长度和狭窄度可自由设定和调控,是一种较好的在体研究WSS变化对动脉粥样硬化形成的影响的方法,同时也是一种快速制作LSS动物模型的好方法。实验结果表明,LSS模型兔颈总动脉D、PSV及RI均呈现明显减低(P<0.05),超声检查见其颈动脉血流呈低阻低排改变;LSS模型兔颈总动脉血流WSS分布呈现普遍减低,且随着时间的增加,低WSS数值分布比例呈现逐渐增大的趋势。
综上所述,本研究通过左侧颈动脉缩窄手术建立兔颈动脉LSS动物模型,发现LSS刺激能够诱导兔颈总动脉内中膜增厚及脂质沉积,LSS在兔颈动脉粥样硬化的形成中具有重要作用。该动物实验结果不仅提供了一种新的LSS动物模型建立方法,而且为动脉粥样硬化的血流动力学成因理论假说提供了在体试验的依据。而LSS刺激是如何诱导动脉粥样硬化形成的机制目前尚不明确,有待于后期进一步通过在体及离体实验来阐述LSS介导动脉粥样硬化形成的信号传导机制。

