高压氧对大鼠脊髓损伤后蛋白激酶R样内质网激酶表达和运动功能的影响①
应新旺,陈晓龙,谷鹏鹏,李思思,蒋松鹤
温州医科大学附属第二医院康复医学中心,浙江温州市325027
蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)是在内质网膜上的一个Ⅰ型跨膜蛋白,属于真核细胞起始因子2α(eukaryotic initiation factor 2α,eIF2α)上游激酶家族[1]。PERK是介导内质网应激(endoplasmic reticulum stress,ERS)整合调控反应重要的细胞内信号途径之一,参与机体多种疾病和病理过程的发生和发展[2]。相关研究表明,适度的ERS可以保护细胞器,持续、剧烈的内质网应激可诱导PERK蛋白表达,最终导致细胞凋亡[3-5]。急性脊髓损伤后,ERS程度明显增强,上调ERS凋亡相关蛋白,从而引发神经细胞、星形胶质细胞、少突胶质细胞等凋亡[6-7]。而高压氧作为一种无创的物理治疗方法,临床上已用于治疗脊髓损伤患者[8-9],但其神经保护机制尚不明确。
本实验观察高压氧治疗对脊髓损伤大鼠后肢运动功能恢复情况以及受损脊髓PERK蛋白表达的影响,探讨高压氧的神经保护机制,为高压氧治疗脊髓损伤提供理论依据。
1 材料与方法
1.1 实验动物
清洁级成年雄性Sprague-Dawley大鼠36只,体质量200~250 g,购买于温州医科大学实验动物中心,随机分为正常组、假手术组、模型组和高压氧组,每组9只。
本实验已通过温州医科大学动物保护和使用委员会同意,符合实验动物伦理学要求,实验过程尽量降低动物的不适感,且使用最小数量的动物。动物均饲养于动物房清洁笼内,自由饮食、饮水,动物房室温(22±2)℃,相对湿度50%~70%,动物房保持日夜12 h规律变化。
1.2 模型制作
5%水合氯醛6 ml/kg腹腔注射,术区常规碘伏消毒,定位于T10棘突,以此为中心,做一个约3 cm纵行切口,钝性分离肌肉韧带,暴露T9~T11棘突及椎板,用止血钳小心咬除棘突及椎板,注意勿伤脊髓硬脊膜,充分暴露脊髓长度约1 cm。用纽约大学脊髓打击器(New York University Impactor,NYU)[10]精确撞击制作大鼠脊髓不完全损伤模型(T10打击,2.5 cm×10 g)。以打击后脊髓组织出现水肿,脊膜充血呈紫红色,双下肢回缩扑动,尾巴痉挛性摆动,弛缓性瘫痪即视为造模成功。缝合肌肉筋膜和皮肤,表面消毒,放回鼠笼饲养,术后早晚各一次协助脊髓损伤大鼠排尿、排便。
1.3 干预方法
正常组不做任何处理。假手术组仅暴露T9~T11节段脊髓,不打击脊髓。模型组暴露T9~T11节段脊髓,打击脊髓。高压氧组暴露T9~T11节段脊髓,打击脊髓,给予连续高压氧治疗7 d。
1.4 后肢运动功能情况
采用BBB(Basso,Beattie and Bresnahan)运动功能评分法[11]对实验大鼠双下肢功能恢复情况进行评分。分别于术前及造模后6 h、3 d、7 d,晚上19:00~20:00进行。将大鼠后肢功能分为22个等级,最小值0分,最大值21分。其中0~7分主要评判动物后肢各关节活动;8~13分主要评判下肢的步态及协调;14~21分主要评判运动中爪的精细动作。
1.5 高压氧治疗
高压氧治疗在大鼠急性脊髓损伤造模成功后6 h开始。将大鼠放置在纸箱内,放入单人高压氧舱(DS400-Ⅳ型,潍坊华信氧业有限公司,中国山东)进行高压氧治疗。在纯氧洗舱5 min后,采用纯氧逐渐升压至2个绝对大气压,稳压吸纯氧90~100 min,中间暂停15 min,最后经15~20 min逐渐减压出舱。高压氧治疗时始终保持舱内氧浓度在95%以上。每次120 min,每天1次,连续治疗7 d,治疗后送回动物房内常规饲养。
1.6 标本取材
1.6.1 脊髓组织蛋白电泳标本制作
每组取实验大鼠5只于术后7 d处死取材。5%水合氯醛腹腔注射麻醉大鼠,迅速打开胸腔,充分暴露心脏,灌注针经左心室插入主动脉,止血钳将灌注管固定,剪开右心耳,200 ml生理盐水由快到慢灌注至肝由红色变为苍白。在低温下迅速切取损伤区脊髓约1.5 cm,置于液氮中,之后转移至-80℃冰箱保存,用于Western blotting检测。
1.6.2 HE染色标本制作
每组取实验大鼠4只于术后7 d处死取材。5%水合氯醛6 ml/kg腹腔内注射麻醉大鼠,迅速打开胸腔,充分暴露心脏,灌注针经左心室插入主动脉,止血钳将灌注针固定,剪开右心耳,生理盐水行心脏灌注,灌注至肝肺变白,后改输预冷4%多聚甲醛300~400 ml左右,灌注速度先快后慢,灌注过程中看到大鼠四肢和尾巴抽搐,待四肢脊柱变硬后即完成灌注,取出损伤节段脊髓1.5 cm,放于4℃的4%多聚甲醛中固定24 h,然后分别经15%、20%、30%蔗糖溶液梯度脱水沉底,找一个大小合适的模具,挤适量冰冻切片包埋剂(optimum cutting temperature,OCT),然后放入脊髓组织,根据切的方向和部位调整好位置,OCT没过脊髓组织,放进-80℃冰箱保存做冰冻切片。冰冻切片机上连续冠状切片,片厚8μm,每隔4张取1张。
1.7 HE染色
室温下风干切片,PBS浸泡10 min,苏木素染色60 s,自来水冲洗30 s,自来水返蓝5 min,伊红染色1 min,自来水冲洗30 s,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.8 Western blotting
取标本受损区脊髓1.5 cm置于匀浆管中,加入强裂解液RIPA、PMSF(100∶1)于匀浆器上摇匀震碎,4℃离心机12000 r/min,共15 min,提取上清进行蛋白检测与定量。制胶(10%分离胶和5%浓缩胶),100℃高温使蛋白质变性后,进行SDS-PAGE电泳,电压80 V,时间90 min。切胶湿转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,PERK蛋白(分子量140 kD)转膜120 min,内参 Tubulin(分子量 55 kD)转膜60 min。转膜结束后,将膜置于TBS液平衡5 min,5%脱脂奶粉封闭2 h。封闭结束后TBST洗膜5 min×3次,孵育兔源性PERK一抗(1∶1000,CELL SIGNALING公司),兔源性Tubulin一抗(1∶1000),4℃过夜。孵育一抗结束后TBST洗膜5 min×4次,辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶5000,碧云天公司)室温孵育1 h。TBST洗膜5 min×4次,ECL显影。蛋白条带用AlphaE-ascFC(FluorChem 8900)软件分析,采用平均灰度值比值比较各组蛋白的表达差异。Tubulin作为内参,将指标灰度值与对应内参灰度值比值进行统计学分析。
1.9 统计学分析
用SPSS 19.0统计软件分析所得数据,计量资料采用(xˉ±s)表示,多组间比较用单因素方差分析,两组间比较采用Student t检验统计显著性,方差齐者予LSD检验,方差不齐者予Dunnett's T3检验。显著性水平ɑ=0.05。
2 结果
2.1 BBB评分
术前四组BBB评分均为21分,稳定无变化。术后6 h,模型组和高压氧组BBB评分为0分,造模成功。术后3 d和7 d,模型组BBB评分低于假手术组(P<0.05)。术后7 d,高压氧组BBB评分高于模型组(P<0.05)。见表1。
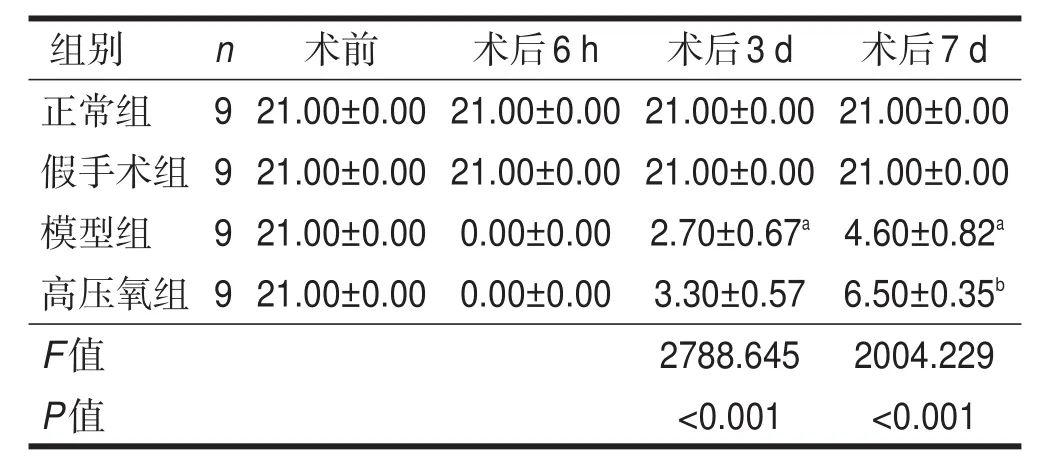
表1 各组大鼠不同时间段BBB评分
2.2 HE染色
正常组和假手术组均未见明显结构异常。模型组损伤脊髓区域可见胞体肿胀,结构模糊,间隙增大,胞核固缩等病理结构。与模型组相比,高压氧组组织水肿情况明显减轻。见图1。

图1 各组损伤脊髓区HE染色(400×)
2.3 Western blotting
术后7 d,模型组PERK蛋白表达明显高于假手术组(P<0.01),高压氧组PERK蛋白低于模型组相比(P<0.05)。见图2、表2。

表2 术后7 d各组脊髓PERK蛋白表达

图2 术后7 d各组脊髓PERK蛋白条带图
3 讨论
脊髓损伤是严重危害人类生存和生活质量的一类中枢性神经创伤。近年来,随着交通运输业和建筑业的快速发展,脊髓损伤的发病率逐年上升,尤其在中青年人群中高发,给患者、家庭、社会带来严重的身心打击和经济负担[12]。急性脊髓损伤由原发损伤和继发损伤共同导致,继发损伤通常是由级联、进展性的局部组织破坏引起[13]。继发损伤伴随原发损伤而发生,可持续数周,主要表现为血管缺血、炎症反应、神经兴奋性毒性反应和自由基的释放产生,最后导致神经细胞的死亡和组织破坏[14-15]。
高压氧治疗脊髓损伤是一种安全、有效的治疗手段,高压氧治疗能有效促进脊髓功能恢复,缩短治疗时间,降低致残率,提高患者生活质量,具有明显的社会效益。特别是在急性脊髓损伤早期接受高压氧治疗对功能恢复更有益处[9]。研究表明,高压氧治疗可在多方面阻止或逆转颈髓损伤后的病理生理发展进程,如控制炎症反应,增强神经修复和再生能力,促进血管再生,降低肌张力等,对脊髓损伤后脊髓功能恢复有促进作用[16-17]。
近年研究发现高压氧治疗脊髓损伤可能与抑制ERS介导的细胞凋亡有关。在脊髓损伤后,受损神经细胞存在着广泛的ERS现象,ERS可能介导细胞死亡和修复过程[18-19]。当发生ERS时,机体会通过减少新生蛋白质的合成,增加伴侣分子的合成及错误折叠或未折叠蛋白质的降解来维持内质网的稳态平衡,即未折叠蛋白反应(unfolded protein response,UPR)[20]。当ERS持续存在时,UPR不能缓解内质网应激状态,UPR中一些促凋亡信号通路被激活,分别为PERK信号通路、肌醇酶l(inositol requiring enzyme l,IREI)信号通路和活化转录因子6(the activating transcription factor 6,ATF6)信号通路,这3条信号通路均可激活细胞凋亡相关蛋白,从而诱导细胞凋亡,其中PERK信号通路是UPR中最先被激活,也是最主要的信号通路[21-22]。PERK信号通路可通过CHOP(C/EBP-homologous Protein)凋亡信号通路和胱天蛋白酶(caspase)介导的凋亡信号通路诱导细胞程序性死亡[23]。CHOP属于C/EBP转录因子族的成员,CHOP是内质网应激发生凋亡的标志性基因,参与内质网应激调节的凋亡,并且CHOP基因表达缺陷的细胞显著减少内质网应激诱导的细胞死亡[24]。PERK-eIF2α-ATF4-CHOP路径是其产生的主要信号通路,PERK蛋白可通过磷酸化eIF2α抑制细胞中蛋白质的合成,同时PERK蛋白可介导的eIF2α磷酸化可选择性介导转录活化因子4(ATF4)的mRNA表达水平升高,ATF4的翻译水平显著增加,通过上调CHOP基因的表达,最终通过激活caspase-3从而诱导细胞凋亡[25-26]。另外研究发现,PERK信号通路也可通过T细胞死亡相关基因51(T-cell death-associated gene 51,TDAG51)、核呼吸因子(nuclear respiratory factors,NRFs)和钙离子等途径直接或间接激活下游促细胞凋亡相关蛋白,从而引发细胞凋亡[23,27]。
有关研究发现,低氧环境可能诱导ERS的发生,与磷酸化PERK、CHOP蛋白的表达趋势呈正相关,这说明低氧造成的组织损伤可能与ERS激活PERK通路,诱导CHOP蛋白高表达,从而介导细胞凋亡有相关性[22]。Liu等[19]研究脊髓损伤大鼠凋亡相关蛋白,发现与对照组相比,脊髓损伤大鼠的凋亡相关分子CHOP、caspase-3、caspase-12的mRNA和蛋白表达水平明显增加。Wang等[28]研究发现,脊髓损伤大鼠高压氧预处理后可促进抗凋亡蛋白Bcl-2蛋白表达,降低凋亡相关分子caspase-3和caspase-9蛋白表达。
本研究采用2个绝对大气压高浓度纯氧治疗脊髓损伤大鼠,通过Western blotting观察细胞凋亡上游重要的调控分子PERK蛋白。与模型组相比,高压氧组脊髓损伤术后大鼠受损脊髓PERK蛋白表达明显减少,说明高压氧治疗可抑制PERK蛋白表达,下调ERS诱导的细胞凋亡途径,降低脊髓损伤诱导的细胞凋亡。HE染色观察发现,与模型组相比,高压氧组组织水肿情况明显减轻。另外,高压氧组7 d后的BBB运动评分高于模型组,说明高压氧组脊髓损伤大鼠的运动功能水平明显改善。因此,长期高压氧治疗可改善脊髓损伤大鼠受损的组织细胞,进而恢复其运动功能。
综上所述,高压氧治疗可以改善脊髓损伤大鼠的运动功能水平,提示高压氧治疗可抑制PERK蛋白的表达,降低脊髓损伤诱导的细胞凋亡,从而起到一定的保护作用。

