喉癌组织p21、SLC7A11表达与患者临床病理特征及预后、复发的关系
赵运华,陈宝刚,张红,郭靖涛,李建辉,陈建华,裴存文,马志红,刘建伟
(1承德市中心医院,河北承德 067000;2首都医科大学附属北京同仁医院)
喉癌是一种常见的、预后较差的头颈部恶性肿瘤,其中96%~98%为鳞状细胞癌。近年来喉癌的发病率呈明显上升趋势[1]。目前尚缺乏明确的特异性标记物用于喉癌诊断检测、复发预测及预后评估。p21是肿瘤抑制基因p53的下游基因,是已知具有最广泛活性的细胞周期抑制基因[2],可通过与细胞周期蛋白依赖性激酶(CDK)复合物结合,抑制CDK复合物的活性,使细胞停滞于G1期,具有细胞周期调控作用[3]。SLC7A11是哺乳动物重要的抗氧化蛋白,该基因编码胱氨酸/谷氨酸xCT转运载体,负责特异性转运胱氨酸和谷氨酸,对维持细胞内外的谷胱甘肽氧化还原平衡具有重要作用[4]。影响谷胱甘肽氧化还原循环的转运体已在肿瘤中被发现,这些转运体成为细胞毒性抗肿瘤治疗的主要靶点,SLC7A11是其重要的转运蛋白[5]。国内已有p21在喉癌组织中表达变化的报道,但鲜有SLC7A11及p21和SLC7A11同时表达的报道。本研究采用免疫组化SP法检测喉癌组织p21和SLC7A11表达,并探讨其与喉癌发生、发展的关系及其与患者预后和肿瘤复发的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2000年8月~2012年11月北京同仁医院耳鼻咽喉头颈外科收治的喉癌患者327例(观察组),均经喉镜、CT、MRI及术后组织病理检查明确为原发性喉鳞癌,且术前未行任何抗肿瘤治疗。排除标准: 合并其他恶性肿瘤;合并全身感染;严重肝肾功能不全。其中,男318例、女9例,年龄35~76岁(≤65岁184例、>65岁143例);TNM分期(UICC2002):T1、T2期207例,T3、T4期120例;有淋巴结转移90例,无淋巴结转移237例;有远处转移35例,无远处转移292例;组织分化程度:高分化160例,中分化125例,低分化42例。同期选择北京同仁医院耳鼻咽喉头颈外科收治的声带息肉患者62例(对照组),男57例、女5例,年龄23~68岁(≤65岁43例、>65岁19例)。两组年龄、性别具有可比性。本研究符合《赫尔辛基宣言》,并经北京同仁医院医学伦理委员会批准,所有研究对象知情同意。
1.2 SLC7A11、p21表达检测 采用免疫组化SP法。取两组手术切除标本,石蜡包埋,4 μm厚连续切片。切片经烤片后,常规二甲苯脱蜡,梯度乙醇脱水;3% H2O237 ℃孵育10 min,PBS冲洗,灭活内源性过氧化物酶;在枸橼酸缓冲液(pH 6.0)125 ℃下通过压力锅进行抗原修复5 min,然后室温冷却。10%山羊血清封闭,滴加多克隆抗体SLC7A11、单克隆抗体p21,4 ℃孵育过夜。用PBS缓冲液代替一抗作为阴性对照,SLC7A11以食管腺癌标本作为阳性对照,p21以乳腺浸润型导管癌腺上皮标本作为阳性对照。次日,滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育。DAB染色,苏木素复染,常规脱水、透明、干燥、封片。采用双盲法由两位经验丰富的病理医生判定结果。SLC7A11阳性染色主要定位于细胞膜,呈棕黄色或棕褐色颗粒;p21阳性染色主要定位于细胞核,呈棕黄色或棕褐色颗粒。每张切片随机选取至少5个高倍视野(×400),计算阳性细胞所占比例。阳性细胞所占比例<10%计0分,10%~25%计1分,>25%~75%计2分,>75%计3分。阳性细胞着色强度:未见阳性染色计0分,浅黄色计1分,黄色计2分,深黄色计3分,棕黑色计4分。阳性细胞所占比例得分与着色强度得分乘积≥1为阳性表达。
1.3 随访 327例患者均建立随访档案,每3~6个月通过电话或门诊随访,随访36~60个月,记录局部复发、死亡情况,统计3年复发率及5年病死率。
1.4 统计学方法 采用SPSS18.0统计软件。计数资料比较采用χ2检验。生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1 两组p21、SLC7A11阳性表达比较 喉癌组p21阳性表达115例(35.2%),SLC7A11阳性表达177例(54.1%);对照组p21阳性表达34例(54.8%),SLC7A11阳性表达21例(33.9%)。两组p21、SLC7A11阳性表达率比较差异均有统计学意义(χ2分别为8.53、8.56,P均<0.01)。
2.2 喉癌组织p21、SLC7A11阳性表达与患者临床病理特征的关系 喉癌组织p21阳性表达与临床分期、淋巴结转移有关(P均<0.05),与年龄、性别、远处转移、组织分化程度无关(P均>0.05)。喉癌组织SLC7A11阳性表达与临床分期有关,与淋巴结转移、远处转移、组织分化程度无关(P均<0.05)。见表1。
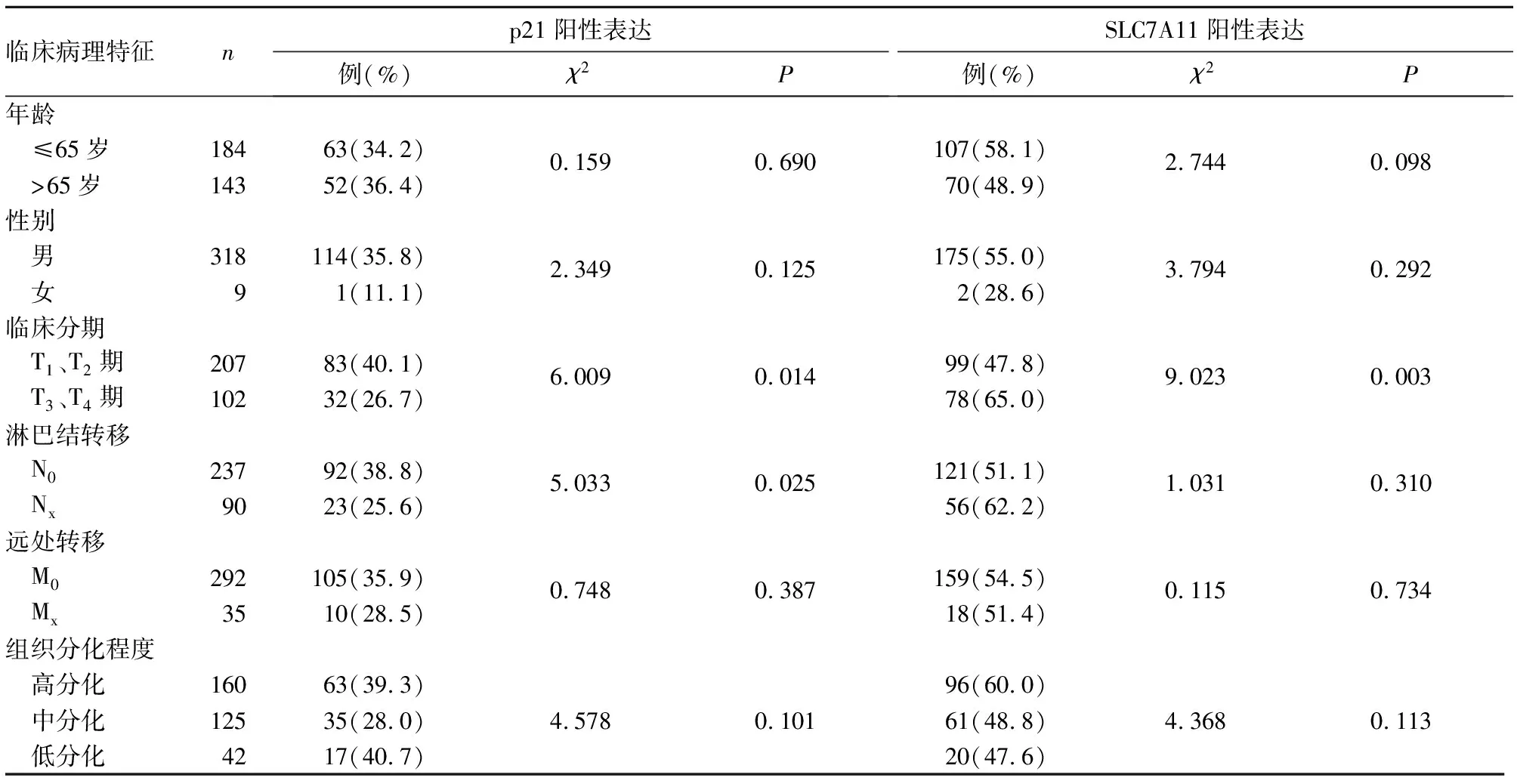
表1 喉癌组织p21、SLC7A11阳性表达与患者临床病理特征的关系[例(%)]
2.3 喉癌组织SLC7A11、p21表达与患者预后的关系 327例喉癌患者中,术后3年复发116例,复发率为35.5%(116/327)。复发者SLC7A11阳性表达率为62.1%(72/116),无复发者为49.8%(105/211),二者比较P均<0.05。复发者p21阳性表达率为27.6%(32/116),无复发者为39.3%(83/211),二者比较P<0.05。327例喉癌患者,术后5年死亡33例,死亡率为10.1%(33/327)。死亡者SLC7A11阳性表达率为66.7%(22/33),未死亡者为49.8%(155/294),二者比较P均>0.05。死亡者p21阳性表达率为36.4%(12/33),未死亡者为35.0%(103/294),二者比较P>0.05。327例喉癌患者中,SLC7A11阴性表达/p21阴性表达77例,SLC7A11阴性表达/p21阳性表达73例,SLC7A11阳性表达/p21阳性表达42例,SLC7A11阳性表达/p21阴性表达135例。SLC7A11阳性表达/p21阴性表达者复发时间明显短于SLC7A11阴性表达/p21阴性表达者、SLC7A11阴性表达/p21阳性表达者、SLC7A11阳性表达/p21阳性表达者(χ2分别为9.344、8.304、5.924,P均<0.05)。SLC7A11阳性表达/p21阴性表达者生存时间与SLC7A11阴性表达/p21阴性表达者、SLC7A11阴性表达/p21阳性表达者、SLC7A11阳性表达/p21阳性表达者比较差异无统计学意义(χ2=4.592,P>0.05)。
3 讨论
p21属于CDK抑制因子家族,能识别DNA受损细胞,通过干扰CDK与cyclins的结合使细胞周期停滞,减少受损DNA复制,阻止异常细胞继续增殖,从而发挥抑癌作用[4]。本研究中p21在喉癌组中低表达,与Izumaru等[6,7]的研究基本一致,表明p21可能是一种抑癌基因。p21阳性表达与喉癌临床分期和淋巴结转移有关,与性别、年龄、远处转移、组织分化程度无关;复发者p21阳性表达明显低于未复发者,但死亡者与未死亡者p21阳性表达比较差异无统计学意义。提示p21具有抑制喉癌发生、发展及复发的作用,但对患者预后可能影响不大。
细胞凋亡主要通过内源性的线粒体或外源性的死亡受体途径。最近研究发现,一种新的非凋亡细胞死亡机制,可以通过铁螯合或铁吸收促进细胞死亡[8]。这个细胞死亡机制被称为铁死亡,其有独特的形态、生化及功能特点[9]。谷氨酸-胱氨酸交换剂SLC7A11在某些细胞类型的铁死亡过程中具有重要作用[8]。SLC7A11也被称为xCT,是一种转运蛋白,在多种癌症中高表达。这些转运蛋白的一个重要生物学特性是能对肿瘤微环境进行特异性调控,从而导致肿瘤的优势生长[5]。有研究显示,SLC7A11在肝癌、肺癌、胰腺癌、恶性胶质瘤中表达均增高,且有预测患者预后或生存期的作用[10~13]。但SLC7A11在喉癌组织中的表达及其与患者预后的关系鲜见报道。前期我们研究发现,SLC7A11是影响喉鳞癌总生存期和术后复发的一个重要因素[14]。本研究结果显示,SLC7A11在喉癌组织中高表达;SLC7A11阳性表达与临床分期有关,与性别、年龄、淋巴结转移、远处转移、组织分化程度无关;复发者SLC7A11阳性表达明显高于未复发者,但死亡者与未死亡者SLC7A11阳性表达比较差异无统计学意义。表明SLC7A11能促进喉癌的发生、发展,但对患者预后可能影响不大。
本研究结果还发现,SLC7A11阳性表达/p21阴性表达者复发时间明显短于SLC7A11阴性表达/p21阴性表达者、SLC7A11阴性表达/p21阳性表达者、SLC7A11阳性表达/p21阳性表达者,但其生存时间比较差异无统计学意义。提示SLC7A11阳性表达/p21阴性表达与喉癌患者术后复发有关,而与患者生存时间无关。
综上所述,喉癌组织SLC7A11高表达、p21低表达,二者表达变化与患者术后复发有关,与术后生存时间关系不大。

