牦牛腹泻粪样的细菌分离鉴定与耐药性检测
李佛生, 胡舒昶, 谢 鑫, 李一璠, 汪 杭, 冯 兰, 杨 鑫
(四川大学 生命科学学院 生物科学国家级实验教学示范中心, 四川 成都 610065)
红原地区的牦牛是四川省阿坝藏族羌族自治州红原地区的标志性物种,其对高原地区高寒 、低氧等恶劣自然条件具有良好的适应能力,其养殖完全依赖红原天然草场,其乳、肉营养价值极高,在高原地区具有不可替代的生态与经济地位[1]。腹泻问题是牦牛犊不能正常发育甚至死亡的重要原因。牦牛腹泻的感染性因素主要有细菌感染、病毒感染、寄生虫感染和缺乏微量元素。目前对于常见畜牧产品腹泻问题的研究基本都涉及细菌感染因素,如郭建超[2]、夏晨阳[3]等探讨了猪、羊腹泻的细菌感染因素,但有关牦牛腹泻疾病的研究多见病毒感染因素,少见对细菌感染因素研究。本实验有助于补充牦牛腹泻在细菌感染方面的研究。
本检测从红原地区腹泻犊牛采集腹泻粪样,分离、鉴定细菌,采用药敏纸片法进行药敏试验,得到细菌耐药谱,从而为红原地区牦牛腹泻问题的抗生素解决方案提供了建议和参考。
1 材料和方法
1.1 样品采集
本次试验所用菌株均由小组成员于2017年在四川省阿坝藏族羌族自治州中部红原县红原地区16头牦牛犊腹泻粪样中分离得到,本次腹泻样本共计16份,其中1份为血样粪便。
1.2 培养基与试剂
1.2.1 微生物培养基
PBS磷酸缓冲盐溶液、伊红美兰琼脂培养基(EMB)、甘露醇高盐琼脂培养基(MSA)、三糖铁培养基(CN)、麦康凯培养基(MC),琼脂购自国产生物试剂公司。
1.2.2 实验试剂
PrimerSTAR Max DNA Polymerase、DNA Maker和PCR产物回收试剂盒购自大连宝生物公司,引物合成自成都擎科梓熙生物技术有限公司。
1.2.3 药敏纸片
9种抗生素药敏纸片(红霉素(E)、庆大霉素(CN)、四环素(TE)、万古霉素(VA)、环丙沙星(CIP)、复方新诺明(SXT)、氯霉素(C)、氨曲南(ATM)、氟苯尼考(FFC))购自英国Thermofisher SCIENTIFIC生物科技公司。
1.2.4 仪器设备
PCR仪(Bio-rad T100)、生化培养箱LRH-250A型、离心机(eppendorf 5424)、生物安全柜BHC-1300A2型、全自动立式高压灭菌器(ZEALWAY GR85DA)、冰箱BCD-301型、摇床。
1.3 菌株的分离、纯化与鉴定
1.3.1 菌株的分离纯化
采样后将粪样暂时置于冰盒中保存,并立即带回实验室,按照粪样与PBS磷酸缓冲盐溶液比例为1∶4处理粪样,混匀后放入离心机以10 000 r/min转速离心30 min,并取上清液备用;配置BHI液体培养基,在10 mL的EP管中加入5 mL BHI液体培养基和1 mL粪样上清液,放入摇床中在37 ℃下摇晃过夜;之后采用平板划线法将细菌分别接种至伊红美蓝琼脂培养基(EMB)、甘露醇高盐琼脂培养基(MSA)、三糖铁培养基(CN)、麦康凯(MC)培养基上,在37 ℃恒温箱中过夜培养;取出过夜培养的培养皿,挑取培养基上的单菌落,并接种至装有5 mL BHI培养基的10 mL EP管中,在37 ℃的摇床中振荡过夜;取出EP管得分离纯化的菌株。
1.3.2 菌落的形态学鉴定
通过长出菌落的形态,包括大小、形状、边缘、光泽、质地、颜色和透明程度等进行粗略鉴定[4]。
1.3.3 16S rRNA基因序列分析
将分离纯化好的菌株37 ℃培养过夜后,分别挑取菌落,采用16S rRNA细菌鉴定的通用引物1492R: 5′-TACGGYTACCTTGTTACGACTT-3′,27F: 5′-AGAGTTTGATCMTGGCTCAG-3′,进行PCR扩增,得到目的片段约为1500 bp。PCR 扩增体系(25 μL): PrimerSTAR Max DNA Polymerase 12.5 μL,引物F/R各1.0 μL,ddH2O 10.5 μL。PCR反应:95 ℃预变性3 min;98 ℃变性10 s,60 ℃退火10 s,72 ℃延伸5 s,35 个循环;72 ℃再延伸5 min。扩增产物经1 % 琼脂糖凝胶电泳检测后,送至成都擎科梓熙生物技术有限公司测序[5-7]。
1.4 药敏试验
1.4.1 菌株复苏
从-20 ℃冰箱中取出冷冻保存的菌株,在常温下静置;配置LB液体培养基,加入到10 mL 灭菌后的EP管中,每支EP管中加入5~6 mL配置好的LB液体培养基;再加入复苏后的菌液20 μL;将EP管捆绑好放入摇床中,在37 ℃下以180 r/min的转速振荡过夜。
1.4.2 耐药性检测
采用药敏纸片法测定64株菌株对9种抗生素的耐药情况[8-11]。在培养皿内放置完药敏纸片后将培养皿倒置,放入37 ℃恒温箱中培养24 h后,通过测量抑菌圈直径对菌株的耐药性进行记录和比较,并根据CLSI M100-S20标准[12],得到不同菌株对不同抗生素的耐药情况。
2 结果与分析
2.1 红原地区牦牛腹泻样品细菌的分离、鉴定结果
用EMB培养基筛选19株菌株,用MSA培养基筛选出16株菌株,用CN培养基筛选出9株菌株,用麦康凯培养基筛选出20株菌株。对所得菌株进行16S rRNA基因序列分析,最终筛选鉴别出64株菌株,其中包含沙门氏菌、大肠杆菌、芽孢杆菌、枯草芽孢杆菌、粪肠球菌、成团泛菌和阪崎肠杆菌(见表1)。

表1 红原地区牦牛腹泻样品细菌的分离、鉴定结果
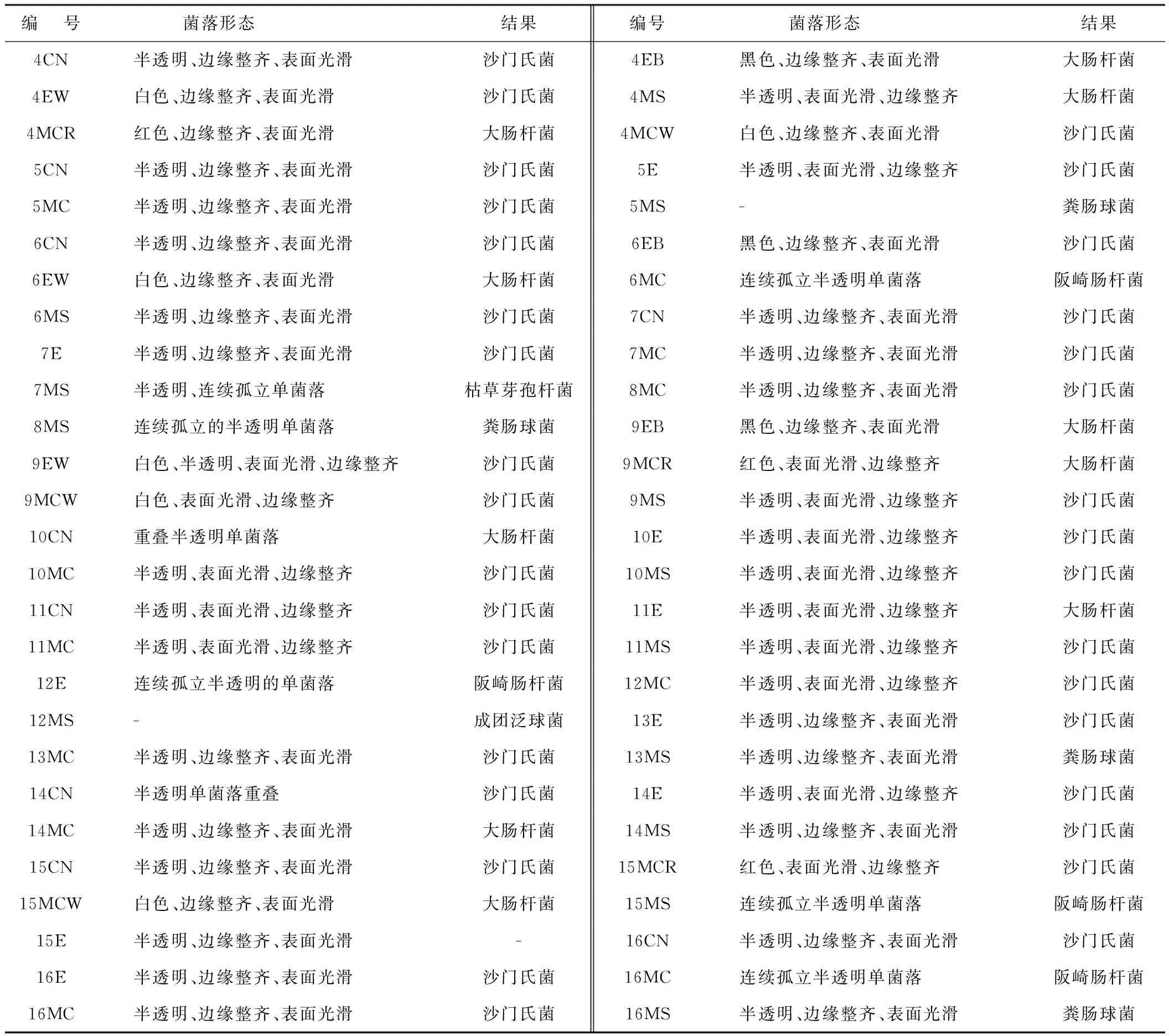
表1(续)
注:编号中的数字代表粪样编号;编号中的第1个和第2个英文字母代表筛选出菌种所用的培养基英文缩写,EMB培养基缩写为E,MSA培养基缩写为MS、CN培养基记为CN、麦康凯培养基记为MC;编号中的第3个字母表示挑取菌落的颜色,R表示红色,W表示白色,B表示黑色,Y表示黄色。
2.2 耐药结果
2.2.1 细菌耐药率
根据药敏试验结果(见图1和图 2)统计,得细菌耐药率见表2—表5。表中耐药率和敏感率数值后括号内/后的数字为样品数,/前的数字为耐药样品或敏感样品数。
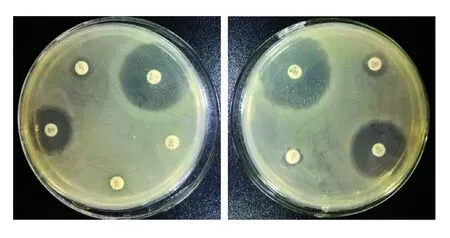
图1 大肠杆菌(9EB)的药敏试验结果

图2 沙门氏菌(9MS)的药敏试验结果
具体情况如下:大肠杆菌对各药物耐药率R有:R(VA)(93.33%)>R(E)(86.67%)>R(C)(53.33%)>R(TE)(20.00%)>R(SXT/FFC)(13.33 %),但对CN、CIP、ATM耐药率为0,对CN、CIP、ATM的敏感率为100%。
沙门氏菌对各药物的耐药率有:R(E/VA)(100.00%)>R(C)(91.89%)>R(FFC)(8.11%)>R(SXT)(2.70%),但对CN、TE、ATM耐药率为0,对各种药物的敏感率S有:S(CN/CIP/ATM)(100.00%)>S(SXT)(94.59%)>S(TE)(62.16%)>S(FFC)(40.54%)>S(C)(5.41%)。
坂崎肠杆菌对各药物耐药率有:R(E)(100.00%) >R(VA)(75.00%)>R(TE/C)(50.00%)>R(CIP/SXT)(25.00 %),但对CN、ATM、FFC的耐药率为0,对CN、ATM的敏感率为100.00%。
粪肠球菌对E/VA/C药物的耐药性为100.00%;CN/CIP/SXT/ATM敏感率为100.00 %,对FFC为50.00%。成团泛菌、芽孢杆菌、枯草芽孢杆菌对E/VA均耐药,并且成团泛菌、芽孢杆菌对C也耐药;成团泛菌、芽孢杆菌、枯草芽孢杆菌对CN、CIP、SXT、ATM都敏感,此外,成团泛菌和枯草芽孢杆菌还对FFC敏感,芽孢杆菌和枯草芽孢杆菌还对TE敏感。

表2 大肠杆菌菌株对抗生素的耐药情况

表3 坂崎肠杆菌菌株对抗生素的耐药情况
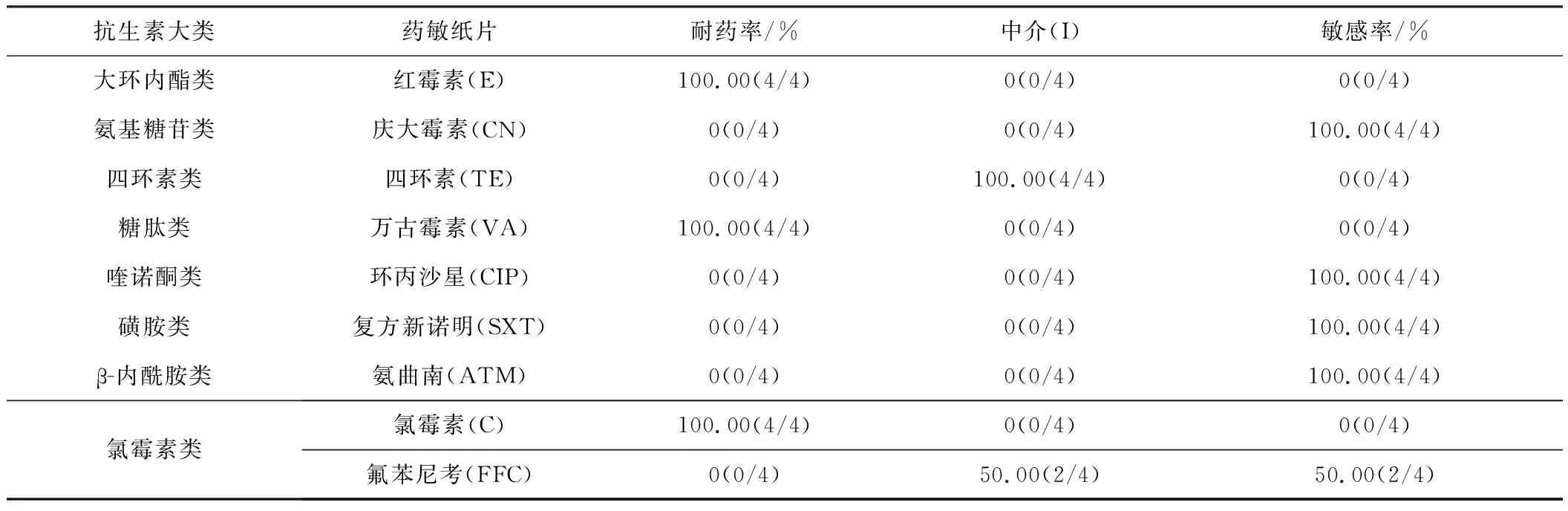
表4 粪肠球菌菌株对抗生素的耐药情况

表5 沙门氏菌菌株对抗生素的耐药情况
2.2.2 多重耐药谱
由图3可知,红原地区牦牛腹泻样细菌对E、VA和C耐药,对FFC和TE的耐药性差异很大,但对CN、CIP、ATM和SXT敏感。然而,值得注意的是,红原地区牦牛腹泻样中大肠杆菌和沙门氏菌均产生1种以上抗生素的多重耐药性,且大多数存在3种以上抗生素的多重耐药情况,分别占53.33 %和91.89 %(见表6)。

图3 菌株对不同抗生素的柱形耐药谱
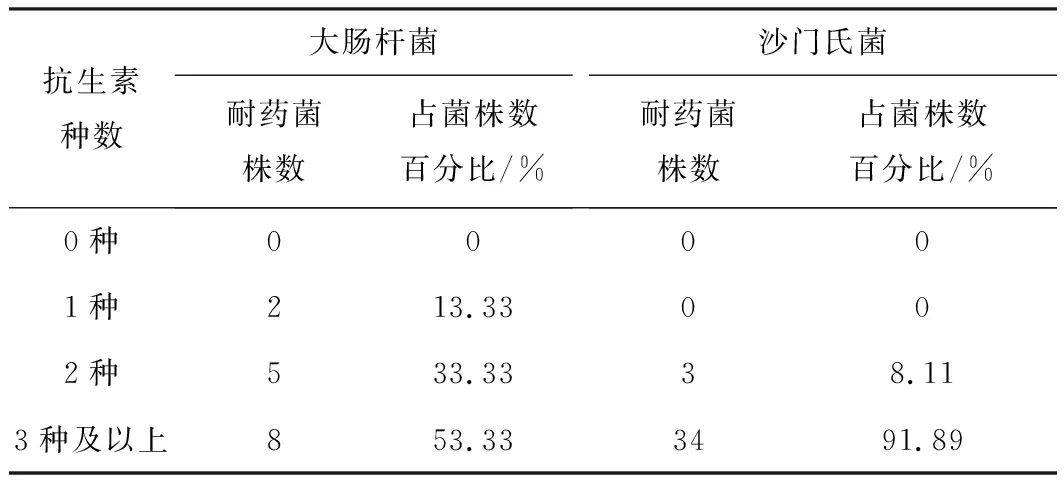
抗生素种数大肠杆菌耐药菌株数占菌株数百分比/%沙门氏菌耐药菌株数占菌株数百分比/%0种00001种213.33002种533.3338.113种及以上853.333491.89
3 讨论
本次测检从红原地区牦牛腹泻粪样中分离了得到了7种共64株菌株,其中主要包括了大肠杆菌(23.44 %)和沙门氏菌(57.81 %)。而周雪雁等人从健康牦牛粪样中分离得到粪肠球菌[13],刘明春等人从犊牛腹泻粪样中分离得到大肠杆菌[14]。相较于之前的研究,本实验从罹患腹泻牦牛的腹泻粪样中分离得到更加全面的致病菌种,具有较大的参考价值。
本次检测使用了药敏纸片法,检测了64株红原地区牦牛腹泻粪样细菌菌株对9种抗生素的耐药性,完善了红原地区牦牛腹泻致病菌的耐药谱。通过耐药率和多重耐药情况可以看出,试验菌种的耐药谱范围有限,普遍对特殊的几种抗生素(E和VA)产生极强的耐药性,却对其他数种抗生素(CN、CIP、SXT、ATM)表现出高度敏感。相比之下,喻华英等人的研究缺少了四环素、万古霉素、氨曲南、氯霉素、氟苯尼考的药敏试验,但增加了头孢唑啉、阿莫西林、诺氟沙星、痢特灵的药敏试验[15-16];刘明春等人的研究缺少了氨曲南、氯霉素、氟苯尼考的药敏试验,但增加了妥布霉素、丁胺卡那、头孢他啶、头孢哌酮、利福平、氟哌酸、呋喃妥因、卡那霉素、氨苄西林的药敏试验[13],可与本次试验互为补充。与喻华英等人的药敏试验结果相比,本试验中大肠杆菌对CIP、CN极为敏感,对E高度耐药,与其试验结果基本一致,但敏感和耐药程度都相对更高;沙门氏菌对CIP、CN、SXT都极为敏感,敏感程度相对更高,而对E具有极强的耐药性,这与喻华英等人的试验结果不相一致。
本试验结果中,大多数菌种对不同抗生素的耐药性几乎呈现出较为极端的情况(耐药或敏感程度接近100 %),并且不同菌种的耐药情况有很大重叠。这可能与红原当地长期使用少数几种抗生素防治牦牛腹泻疾病,从而导致致病菌对这几种抗生素(E、VA、C)产生了较为单一并且极强的耐药性,而对其他抗生素高度敏感有关。此外,红原地区地处高原、较为封闭的特殊地理环境,也可能是红原地区牦牛腹泻粪样中细菌具有如此独特的耐药情况的重要原因。
根据本次试验结果可以推测,对于红原地区牦牛腹泻疾病,使用多样化的抗生素,能够有效控制红原地区牦牛的腹泻病情。虽然对于引起红原地区牦牛腹泻的致病菌,仅仅依靠试验所使用的抗生素中的一种或两种,就能有效抑制致病菌的增殖,但是由于抗生素的单一使用,极易使致病菌产生在短时间内产生新的耐药性,并不适用于长期控制红原地区牦牛的腹泻疾病。就抗生素防治而言,尝试寻找新的抗生素,减少同种抗生素的重复使用,同时利用现有抗生素和新抗生素进行防治,是较为合理解决方案。除此之外,尝试运用生态学方法防治红原地区牦牛腹泻的发生可能是更加有利于生态保护、更加持久的解决方案。

