贵州草海后生浮游动物群落季节动态特征及与环境因子的关系
朱冲冲, 李秋华*, 陈文生, 何应, 肖晶
贵州草海后生浮游动物群落季节动态特征及与环境因子的关系
朱冲冲, 李秋华*, 陈文生, 何应, 肖晶
贵州师范大学贵州省山地环境信息系统和生态环境保护重点实验室, 贵阳 550001
为研究草海后生浮游动物群落动态特征及与环境因子的关系, 于2016年10月和2017年1月、4月、7月对草海后生浮游动物群落进行四次生态调查, 并运用非度量多维尺度分析(Non-metric multidimensional scaling analysis, NMDS)、冗余分析(Redundancy analysis, RDA)对后生浮游动物群落结构进行了研究。共鉴定出后生浮游动物45种, 以轮虫种类为主(32种)。后生浮游动物丰度的季节性差异显著, 春季最高(5287 ind.·L-1), 冬季最低(73.20 ind.·L-1); 生物量的季节性差异显著, 春季最高(18.30 mg·L-1), 夏季最低(1.50 mg·L-1)。螺形龟甲轮虫()、矩形龟甲轮虫()、萼花臂尾轮虫()为主要优势种。春季、夏季均以螺形龟甲轮虫为优势种类; 秋季、冬季没有明显的优势种。通过非度量多维尺度分析获得样品的空间定位点图, 四季分明, 反映出群落结构的水文季节性特征。冗余分析(RDA)表明, 水温(Water temperature, WT)、透明度(Secchi disk depth, SD)是影响草海后生浮游动物群落结构的关键因子, 营养盐、pH、叶绿素a(Chlorophyll-a, Chl)是影响草海后生浮游动物群落结构的重要因素。
后生浮游动物; 群落结构; 环境因子; 非度量多维尺度分析; 冗余分析; 草海
1 前言
后生浮游动物作为初级消费者, 通过上下行效应影响其他营养级的结构, 一方面其大部分可作为经济鱼类的优良饵料[1], 其丰度和生物量直接影响经济鱼类的数量, 从而对渔业生产有重要影响; 另一方面通过牧食作用控制浮游植物数量[2]。由于其个体小、繁殖快, 对水体环境的变化比较敏感, 营养盐、温度、pH、食物等的变化都能影响后生浮游动物的群落结构及时空分布[3]。
自1982年恢复水位以来, 已陆续有学者[4–6]针对草海后生浮游动物开展了相关研究, 向应海和张华海侧重于浮游动物的种类、丰度和生物量的研究, 蔡国俊侧重于浮游动物群落结构与水质评价的研究, 而本研究主要侧重于后生浮游动物群落动态特征及与环境因子关系的研究。草海环境因子复杂多变, 水体中的后生浮游动物群落同时受周围多种环境因素(如物理、化学和生物等)的影响, 其群落结构季节动态是多个环境因子在时间和空间序列上综合作用的结果[7]。近年来, 冗余分析(RDA)因具有能同时结合多个环境因子分析物种与环境因子间的复杂关系、信息包含量大、结果明确直观等优点而得到越来越多国内外学者的青睐, 并在生态学领域中得到广泛运用[8–10]。
本文调查研究了2016年10月至2017年7月四季草海后生浮游动物的种类数、丰度、生物量的动态变化, 并结合理化因子数据, 采用冗余分析(RDA)对草海后生浮游动物群落动态与环境理化因子的关系进行研究, 探究草海后生浮游动物群落动态特征及与环境因子的关系, 结合过去的研究分析了近年来草海后生浮游动物群落结构的演替进展, 旨在为草海可持续发展提供理论依据。
2 材料与方法
2.1 草海概况与采样
草海(104°10′E—104°25′E, 26°45′N—27°00′N)是国家级自然保护区, 位于贵州省毕节市威宁县城西南侧, 正常蓄水面积1980 hm2, 平均水深2 m, 是一个完整的、典型的喀斯特高原湿地生态系统, 属于长江水系, 是贵州省境内最大的天然淡水湖泊, 其水源补给主要来自大气降水, 其次是地下水补给[11]。草海属于亚热带季风气候, 年均气温10.50 ℃;年均降水量951 mm, 年均相对湿度79%, 降水分布不均, 主要集中于夏季, 干湿季明显, 昼夜温差大。分别于2016年10月(秋季)、2017年1月(冬季)、2017年4月(春季)、2017年7月(夏季)在草海进行4次定点采样。依据草海面积和水文地理特征, 于草海湖面设置10个采样点(图1)。
2.2 实验方法
2.2.1 后生浮游动物采集与处理
(1)定性样品
采用13号浮游生物网于水面水平及垂直方向作“∞”字形缓慢拖网, 收集于50 mL塑料瓶中, 加入5%福尔马林溶液固定, 以待镜鉴鉴定。种类鉴定参考《中国淡水轮虫志》[12]、《中国动物志·淡水桡足类》[13]、《中国动物志·淡水枝角类》[14]。
(2)定量样品
于水下0.5 m处用5 L采水器采集20 L表层水样, 用25号浮游生物网现场过滤并收集于50 mL塑料瓶中, 加入5%福尔马林固定, 以待镜鉴, 每瓶样品重复计数3-6次, 取其平均值。参考《湖泊富营养调查规范》[15]中个体湿重及简化公式求得轮虫生物量, 桡足类和枝角类则根据体长与体重回归方程, 由体长求得生物量。生物量皆为湿重。

图1 草海采样点分布
2.2.2 理化因子测定
于水下0.5 m处采集水样, 用雷磁DZB-718型便携式水质多参数测定仪原位现场测定水温(WT)、pH; 用塞氏盘现场测定透明度(SD); 按照GB 3838—2002《地表水环境质量标准方法》测定总氮(Total nitrogen, TN)、硝氮(Nitrate nitrogen, NO3-N)、氨氮(Ammonia nitrogen, NH4-N)、总磷(Total phosphorus, TP)等指标。叶绿素a(Chl)浓度采用改良的反复冻融、丙酮萃取法进行测定[16]。
2.3 数据处理与分析
2.3.1 优势度
后生浮游动物优势种根据每个种的优势度值(Y)来确定:
=(N/)f
式中,为第种的个体数,为所有种类总个体数,为出现频率,值>0.02的种类视为优势种。
2.3.2 数据分析
运用Canoco4.5 软件包对后生浮游动物与环境因子的关系进行冗余分析(RDA)。降趋势对应分析(Detrended correspondence analysis, DCA)排序轴梯度各季节最大值均小于3, 均选择冗余分析(RDA) 对后生浮游动物和环境因子的关系进行进一步分析。使用R语言对后生浮游动物群落进行非度量多维尺度分析(NMDS)。使用Origin8.0 绘制后生浮游动物丰度、生物量分布图。使用Excel进行数据处理。
3 结果与分析
3.1 理化指标
贵州草海四季总氮(TN)变化为0.12-2.33 mg·L-1,春季、夏季、秋季和冬季各采样点平均值为0.67、0.38、0.92和0.44 mg·L-1。硝氮(NO3-N)变化为0.03—0.09 mg·L-1, 春季、夏季、秋季和冬季各采样点平均值为0.07、0.08、0.08和0.05 mg·L-1。氨氮(NH4-N)变化为0.01—0.08 mg·L-1, 春季、夏季、秋季和冬季各采样点平均值为0.04、0.006、0.03和0.06 mg·L-1。总磷(TP)变化为0.01—0.29 mg·L-1, 春季、夏季、秋季和冬季各采样点平均值为0.02、0.06、0.04 和0.02 mg·L-1。叶绿素a(Chl)的季节变化最明显, 秋季最高, 为23.31 mg·L-1, 春季、夏季和冬季分别为3.08、9.16和16.95 mg·L-1。水温(WT)变化为9.50—23.60 ℃, 春季、夏季、秋季和冬季各采样点平均水温为19.53、21.58、18.90和10.06 ℃。pH值变化范围冬季为6.56—7.47, 呈中性状态, 春季为7.52—8.15, 夏季为8.34—9.87, 秋季为9.80—10.50, 春季、夏季和秋季呈中性偏弱碱性状态, 反映出草海高pH值的特征。透明度(SD)变化为0.80—3 m, 春季、夏季、秋季和冬季各采样点平均值为1.29、2、1.48和1.27 m。草海各季节主要理化指标见图2。
3.2 后生浮游动物群落动态特征
共检测到后生浮游动物43种, 其中轮虫31种, 桡足类3种, 枝角类9种(表1)。各季节后生浮游动物种类数依次为夏季(36种)>春季(30种)>秋季(17种)>冬季(15种)。春季、夏季、秋季、冬季后生浮游动物的总丰度分别为5287、560.60、682.40和73.20 ind.·L-1, 总生物量分别为18.29、1.46、7.28和1.58 mg·L-1(图3)。各季节多数区域轮虫在种类数、丰度上占据较大优势, 桡足类在生物量上占据较大优势。主要优势种为螺形龟甲轮虫、矩形龟甲轮虫、萼花臂尾轮虫。

图2 草海主要环境因子变化

表1 草海的后生浮游动物种类
春季, CH1—CH10后生浮游动物生物量变化范围及均值为0.48 (CH8) —3.11 (CH6) mg·L-1, 1.83 mg·L-1; 夏季, CH1—CH10后生浮游动物生物量变化范围及均值为0.02 (CH10) —0.41 (CH6) mg·L-1, 0.15 mg·L-1; 秋季, CH1—CH10后生浮游动物生物量变化范围及均值为0.23 (CH3) —1.46 (CH5) mg·L-1, 0.73 mg·L-1; 冬季, CH1—CH10后生浮游动物生物量变化范围及均值为0.02 (CH2) —0.36 (CH10) mg·L-1, 0.16 mg·L-1。从采样点分布来看, 春季采样点CH5、CH6和CH9丰度较高, 采样点CH1、CH2、CH5、CH6和CH7生物量较高; 夏季采样点CH6和CH7丰度较高, 采样点CH1、和CH6生物量较高。CH6的后生浮游动物的种类、丰度、生物量较其它采样点较高; 秋季采样点CH1、CH8、CH9和CH10丰度较高, 采样点CH5、CH8、CH9和CH10生物量较高; 冬季采样点CH6、CH7、CH8、CH9和CH10丰度较高, 采样点CH6、CH7、CH8、CH9和CH10生物量较高(图3)。
3.3 后生浮游动物群落动态特征与环境因子的关系
3.3.1 非度量多维尺度分析
非度量多维尺度分析(NMDS)根据样品中包含的后生浮游动物的物种信息, 以点的形式反映在多维空间上, 而对不同样品间的差异程度, 则是通过点与点间的距离体现的, 最终获得样品的空间定位点图。非度量多维尺度分析(NMDS)中的压力值(Stress) 较大(0.25) , 表明草海后生浮游动物群落结构很难由少数主轴表示。在非度量多维尺度分析的排序图(图4)中, 春季的采样点分布于主轴 1 的左上侧, 夏季的采样点分布于主轴 1 的左下侧, 秋季分布于轴 1 的右下侧, 冬季分布于轴 1 的右上侧,体现了后生浮游动物群落对春、夏、秋、冬四个不同季节的响应。
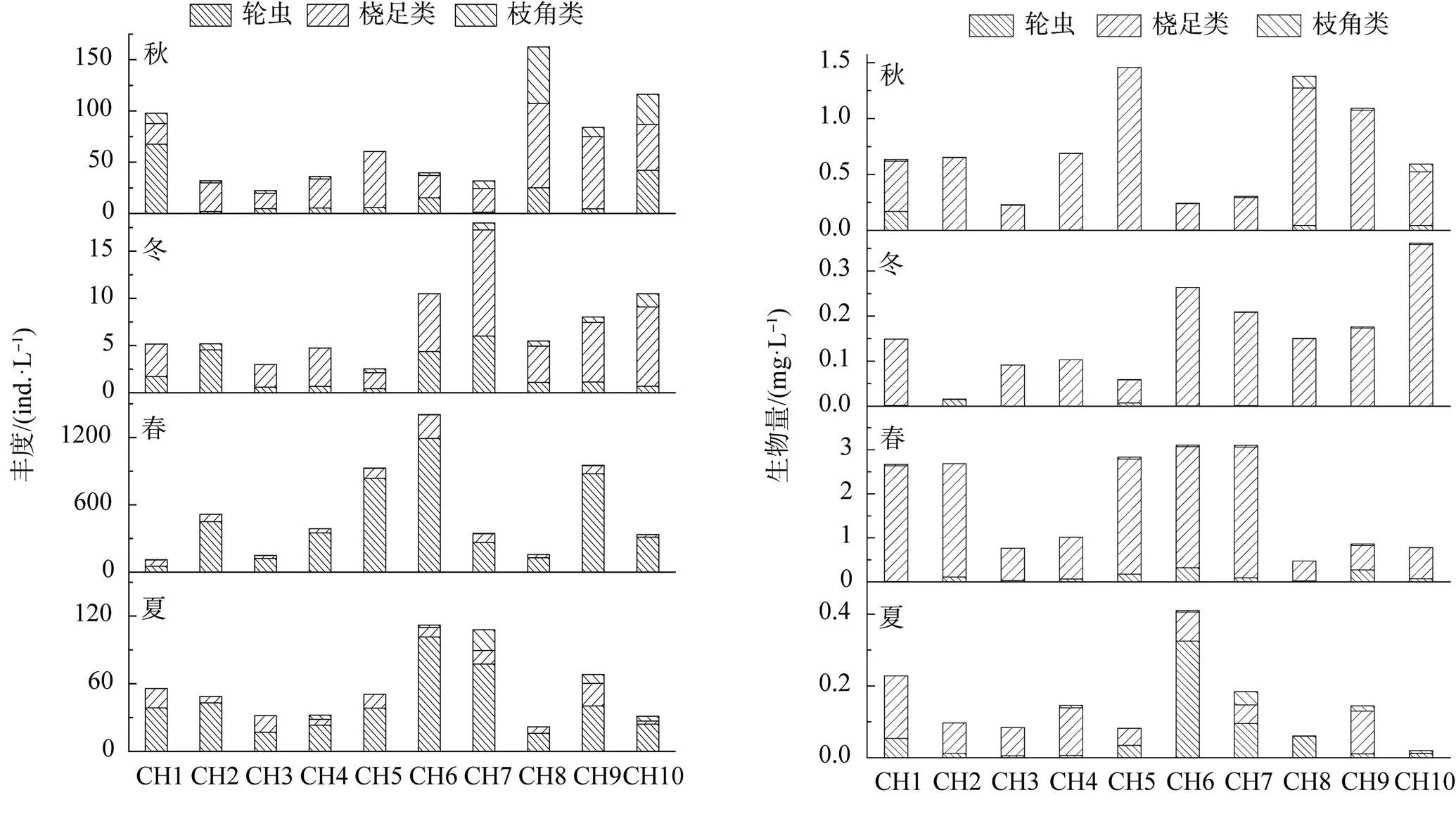
图3 草海后生浮游动物群落结构四季变化图
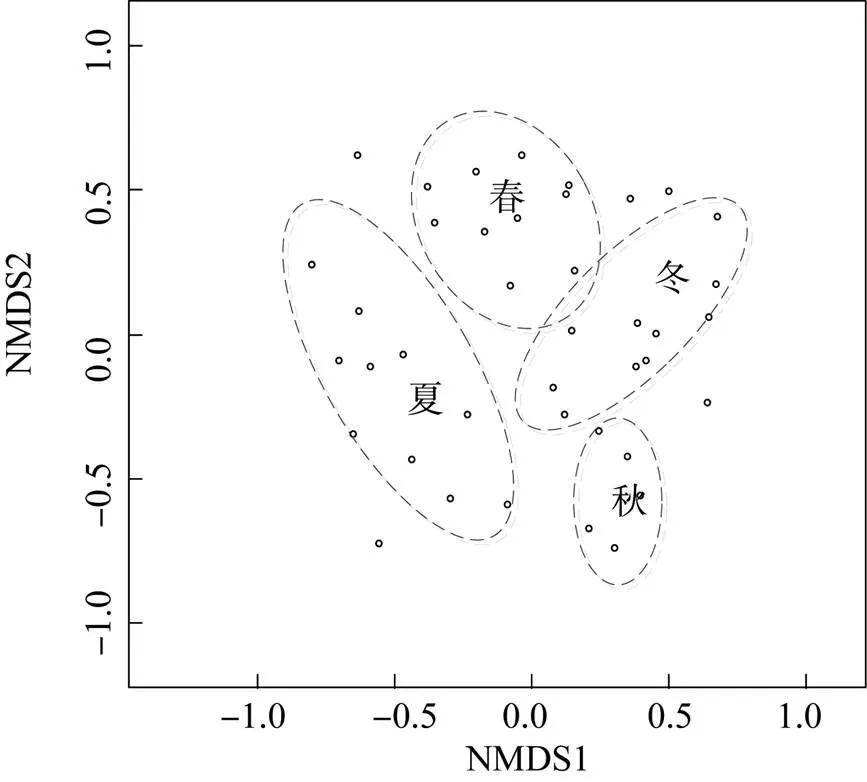
图4 草海后生浮游动物群落非度量多维尺度分析(NMDS)
3.3.2 后生浮游动物与环境因子的冗余分析(RDA)
在对后生浮游动物群落的冗余分析(RDA)中, 春季筛选出5种后生浮游动物和6种环境因子进行排序分析, 夏季筛选出4种后生浮游动物和8种环境因子进行排序分析, 秋季筛选出4种后生浮游动物和5种环境因子进行排序分析, 冬季筛选出4种后生浮游动物和5种环境因子进行排序分析。首先四季经冗余分析(RDA)得到物种矩阵排序轴梯度的最大值均小于3, 说明四季优势种丰度和环境因子的关系均适合冗余分析(RDA), 分析结果以双轴排序图显示(图5)。
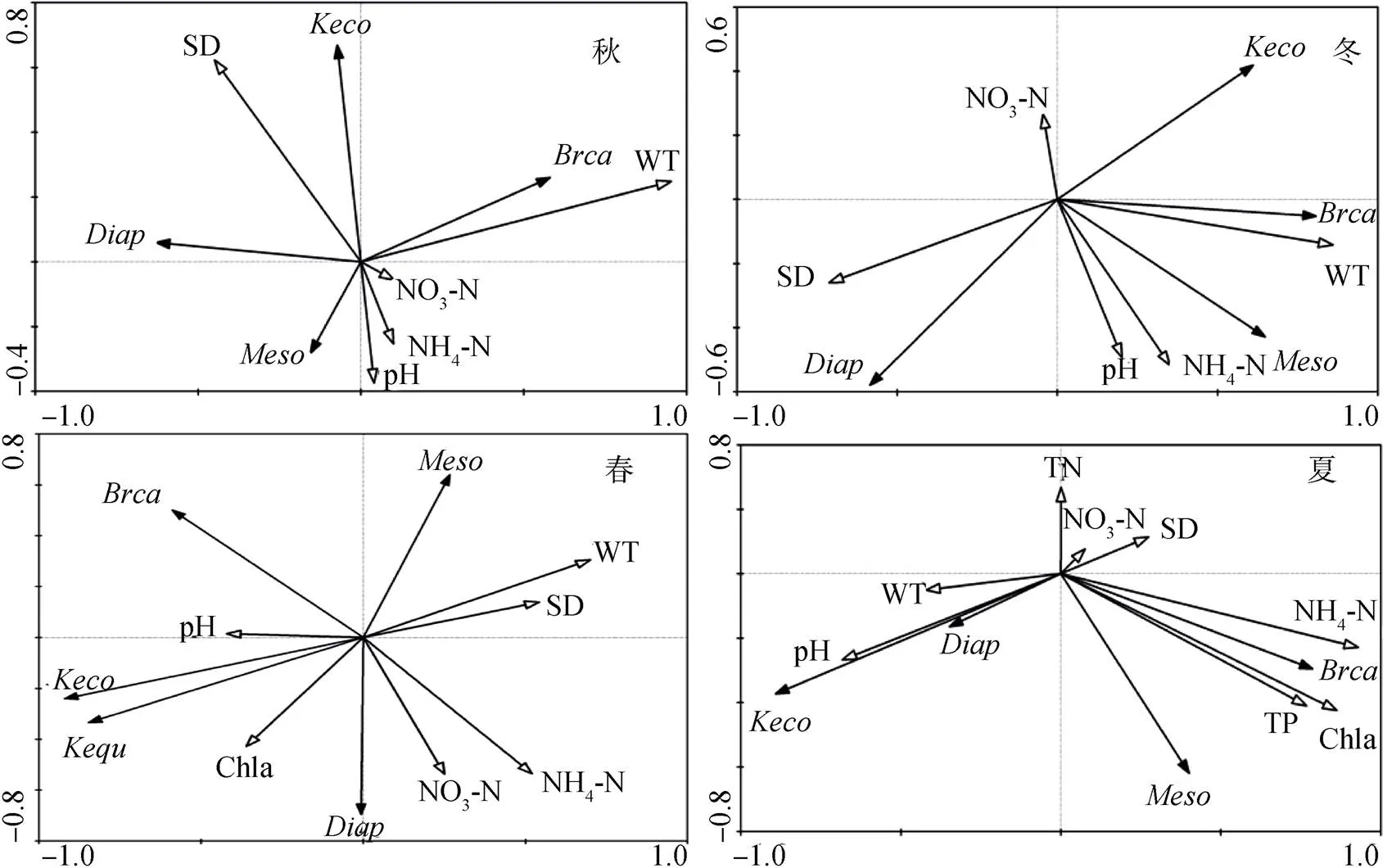
注: Keco-螺形龟甲轮虫、Kequ-矩形龟甲轮虫、Brca-萼花臂尾轮虫、Meso-中剑水蚤、Diap-镖水蚤。
分析结果显示, 春季前两个排序轴的特征值分别为0.35和0.28, 其解释率为63%。后生浮游动物群落结构变化整体上由水温(WT)、透明度(SD)、氨氮(NH4-N)所主导。从图中物种与环境因子之间的夹角可以看出螺形龟甲轮虫、矩形龟甲轮虫与叶绿素a(Chl)、pH呈正相关, 与水温(WT)、透明度(SD)呈负相关; 萼花臂尾轮虫与氨氮(NH4-N)和硝氮(NO3-N)呈负相关。夏季前两个排序轴的特征值分别为0.54和0.16, 其解释率为69.70%。后生浮游动物群落结构变化整体上由总磷(TP)、叶绿素a(Chl)和氨氮(NH4-N)所主导。从图中物种与环境因子之间的夹角可以看出螺形龟甲轮虫、镖水蚤与水温(WT)、pH呈正相关, 与透明度(SD)和硝氮(NO3-N)呈负相关; 萼花臂尾轮虫与总磷(TP)、叶绿素a(Chl)和氨氮(NH4-N)呈正相关。秋季前两个排序轴的特征值分别为0.46和0.15, 其解释率为61%。后生浮游动物群落结构变化整体上由水温(WT)、透明度(SD)、pH所主导。从图中物种与环境因子之间的夹角可以看出萼花臂尾轮虫与水温(WT)呈正相关, 螺形龟甲轮虫与pH呈负相关。冬季前两个排序轴的特征值分别为0.21和0.14, 其解释率为34.20%。冬季草海后生浮游动物群落结构变化整体上由水温(WT)、透明度(SD)、pH所主导。从图中物种与环境因子之间的夹角可以看出萼花臂尾轮虫与水温(WT)呈正相关。整体来看, 草海后生浮游动物群落结构变化主要受水温(WT)和透明度(SD)的影响。
4 讨论
4.1 草海后生浮游动物群落动态特征
草海后生浮游动物均为亚热带水体常见种类, 优势类群为轮虫, 桡足类次之, 而枝角类仅在个别季节出现。草海桡足类种类相对较少, 仅检测到了中剑水蚤、镖水蚤, 以无节幼体()为主。因为轮虫个体较小、发育快、生命周期短等特点, 在淡水生态系统中常处于优势地位。后生浮游动物的种类数、丰度及生物量受到轮虫的影响最大, 总体呈现出春夏较秋冬高的现象, 这与过去的研究一致[4–6]。草海水环境复杂, 生长有不同的高等水生植物, 较高的有机质含量可以为轮虫提供更多的食物来源, 同时也为轮虫创造相对适宜的多样性生境。四次采样的总丰度和总生物量最大值均出现在春季, 夏季和秋季次之, 冬季最少。丰度和生物量不一定呈显著正相关(图3), 生物量的计算还要考虑个体湿重的大小[17]。在夏季、秋季、冬季轮虫、桡足类、枝角类生物量较小, 且冬季最小, 而春季轮虫、桡足类生物量较其他三季明显偏高。春季后生浮游动物群落结构变化整体上由水温(WT)、透明度(SD)、氨氮(NH4- N)所主导(图5)。由于表层水温升高, 光度增强, 营养盐类丰富, 浮游动物迅速繁殖, 其丰度在春季达到最高值, 种类数在夏季达到峰值。
2005年夏季优势种主要有精致单趾轮虫()、月形腔轮虫、汤匙华哲水蚤等13种优势种[5], 2014年夏季和秋季主要有精致单趾轮虫、大型中镖水蚤等5种优势种[6], 而本次研究中春季、夏季、秋季和冬季主要有螺形龟甲轮虫、矩形龟甲轮虫、萼花臂尾轮虫、中剑水蚤、镖水蚤等5种优势种。优势种群发生了较大的变化, 首先是优势种群变少, 其次是一些原有的优势种被新的优势种群所替代。1983—2017年, 草海后生浮游动物种类数量变化范围较大, 轮虫种类数在32—69 种波动, 桡足类在3—21种波动, 枝角类在10—28种波动。2005年、2014年和2017年后生浮游动物丰度表现先增加后减少的趋势, 轮虫丰度由2005年的761.40 ind.·L-1骤减到2014年的231.60 ind.·L-1, 后又明显增加到2017年的1300.20 ind.·L-1。桡足类丰度由2005年的85.70 ind.·L-1增加到2014年的405.50 ind.·L-1, 后又减少到2017年的306.10 ind.·L-1。枝角类丰度变化不是特别明显。总体来看, 后生浮游动物总丰度由2005年的889.90 ind.·L-1减少到2014年的701.40 ind.·L-1, 后又明显增加到2017年的1651 ind.·L-1。2005—2017年, 轮虫丰度变化较为突出, 这主要是因为轮虫个体小、适应性强、易于繁殖等特点, 在适宜生存的环境下能快速繁殖起来。通常情况下, 在清洁型水体中轮虫呈现出种类多、数量少的特点, 而在中污染型的水体中, 往往是耐污染类轮虫为优势种(往往以较高数量出现)[18–20]。草海轮虫中的主要优势种有螺形龟甲轮虫、矩形龟甲轮虫、萼花臂尾轮虫, 特别是春季矩形龟甲轮虫大量繁殖成为绝对优势种, 这些种类都是富营养化指示种。之所以出现这种现象可能是因为草海本身被城镇和周边农田所包围, 近年来大量的城市生活污水和农田残留的化肥、农药等随着地表径流直接流入草海, 导致草海水质恶化。生活污水、禽畜养殖和农业化肥等是导致水体出现富营养化趋势的主要原因。因此, 在对国家级自然保护区草海的保护与防治过程中, 应将严格控制周边污染源与渔业养殖。
从各采样点理化指标来看, 水温(WT)和pH的离散程度比较小, 总氮(TN)、总磷(TP)、水温(WT)、叶绿素a(Chl)、氨氮(NH4-N)和硝氮(NO3-N)的离散程度比较大(图2)。草海各点总氮(TN)、总磷(TP)均较高; 夏季、秋季草海的pH、透明度(SD)高于春季、冬季, 其他指标四季变化存在随机性。CH1除透明度(SD)以外, 总氮(TN)、总磷(TP)、水温(WT )、叶绿素a(Chl)、氨氮(NH4-N)和硝氮(NO3-N)四季均偏高, 和该采样点养鱼有直接关系。各采样点pH均值8.53, 最高点达到10.56。草海四季总氮(TN)平均值为0.61 mg·L-1, 总磷(TP)平均值为0.13 mg·L-1, 富营养状态较高, 营养盐已经能够满足后生浮游动物生长的需求, 相对高的营养盐浓度变化对后生浮游动物群落结构动态的变化影响不是特别明显。
4.2 草海后生浮游动物群落动态特征与环境因子的关系
冗余分析(RDA)表明, 总氮(TN)、总磷(TP)与后生浮游动物群落没有很强的相关性, 可能是由于营养盐是通过影响浮游植物群落间接影响后生浮游动物的群落组成, 具体的影响机理还有待后续研究的补充。整体来看, 水温(WT)和透明度(SD)是影响草海后生浮游动物群落结构变化的关键因子。因此, 在富营养化程度较高水体, 水文因素的动态变化是影响浮游生物群落结构动态变化的主要环境因子[21–22]。
草海后生浮游动物的分布是各种环境因子综合作用的结果。大量研究表明, 水温(WT)是影响后生浮游动物生长发育、数量变化和群落组成等最重要的环境因子之一, 也是影响后生浮游动物分布的重要因素[23–24]。本文对物种和环境数据进行冗余分析(RDA)也得出相似的结果。冗余分析(RDA)表明, 水温(WT)、透明度(SD)是影响草海后生浮游动物群落结构的重要因素。水温可以间接调节鱼类对后生浮游动物的捕食强度, 从而影响到后生浮游动物群落面临的捕食压力, 温度还可以通过影响作为食物的浮游植物的生长及密度, 进而影响到轮虫群落的食物供给。另外温度还可以通过直接影响单个后生浮游动物的生长繁殖和发育来直接作用于后生浮游动物群落, 因此水温(WT)是影响草海后生浮游动物群落结构的关键因素。水体透明度(SD)随着水生植物、藻类及水体中有机物含量的增加而降低, 能够间接反应水体中浮游生物及水体的营养化程度。水体透明度(SD)是评判水体质量好坏的重要指标, 对浮游生物的生长发育有较大影响[25]。水体的 pH 值对后生浮游动物具有重要影响, 不同种类的轮虫、枝角类对较高及较低的 pH 值非常敏感[26]。食物是影响草海后生浮游动物的重要因素, 叶绿素a(Chl)的浓度在一定程度上反映了食物水平。值得注意的是, 冗余分析(RDA)结果显示本文冬季所选环境因子对后生浮游动物群落分布的累计贡献率仅为34.20%, 说明, 除了所选环境因子外, 鱼类、水生植物、人类活动等也是不可忽略的环境因素。想要进一步深入研究影响后生浮游动物群落结构的因素, 从影响因素上进行不断的筛选与整合显得尤为重要。
5 结论
本研究着重分析草海后生浮游动物群落动态特征及与环境因子的关系。草海后生浮游动物以轮虫为主, 其种类数、丰度占据较大优势。草海后生浮游动物丰度和生物量均存在明显的季节变化特征: 春季>秋季>夏季>冬季, 体现了后生浮游动物群落对四季不同的响应。冗余分析(RDA)表明: 水温(WT)、透明度(SD)是影响草海后生浮游动物群落结构的关键因子, 营养盐、pH、叶绿素a(Chl)是影响草海后生浮游动物群落结构的重要因素。生活污水、禽畜养殖和农业化肥等是导致水体出现富营养化趋势的主要原因。因此, 在对国家级自然保护区草海的保护与防治过程中, 应将严格控制周边污染源与渔业养殖。
[1] MITRA G, Mukhopadhyay P K, Ayyappan S. Biochemical composition of zooplankton community grown in freshwater earthen ponds: Nutritional implication in nursery rearing of fish larvae and early juveniles[J]. Aquaculture, 2007, 272(1/4): 346–360.
[2] Balvay G, Ibanez F, Reid P C. Spatial seasonal and long-term fluctuations of plankton in relation to hydroclimatic features in the English Channel Celtic Sea and Bay of Biscay[J]. Marine Ecology Progress Series, 2000, 200: 93–102.
[3] Lee C Y, LIU D C, SU W C. Seasonal and Spatial Variations in the Planktonic Copepod Community of Ilan Bay and Adjacent Kuroshio Waters off Northeastern Taiwan[J]. Zoological Studies, 2009, 48(2): 151–161.
[4] 贵州科学院生物研究所.草海科学考察报告[M]. 贵州人民出版社, 1986.
[5] 张华海, 李明晶, 姚松林.草海研究[M]. 贵阳: 贵州科技出版社, 2007.
[6] 蔡国俊, 周晨, 林艳红, 等. 贵州草海高原湿地浮游动物群落结构与水质评价[J]. 生态环境学报, 2016, 25(2): 279–285.
[7] 左涛, 王荣, 陈亚瞿, 等. 春季和秋季东、黄海陆架区大型网采浮游动物群落划分[J]. 生态学报, 2005, 25(7): 1531–1540.
[8] ZHOU Shuchan, JIN Binsong, GUO Li, et al. Spatial distribution of zooplankton in the intertidal marsh creeks of the Yangtze River Estuary, China[J]. Estuarine Coastal & Shelf Science, 2009, 85(3): 399–406.
[9] HUANG Changjiang, LIN Xiaoping, LIN Junda, et al. Population dynamics of Pseudo-nitzschia pungens in Zhelin Bay, China[J]. Journal of the Marine Biological Association of the United Kingdom, 2009, 89(4): 663–668.
[10] 李秋华, 韩博平. 基于CCA的典型调水水库浮游植物群落动态特征分析[J]. 生态学报, 2007, 27(6) : 2355–2364.
[11] 林绍霞, 张清海, 郭媛, 等. 贵州草海沉积物重金属污染特征及潜在生态风险分析[J]. 农业环境科学学报, 2012(11): 2236–2241.
[12] 王家辑. 中国淡水轮虫志[M]. 北京: 科学出版社, 1961.
[13] 沈嘉瑞, 戴爱云, 张崇洲. 中国动物志,淡水桡足类[M]. 北京: 科学出版社, 1979.
[14] 蒋燮治, 堵南山. 中国动物志,节肢动物门,甲壳纲,淡水枝角类[M]. 北京: 科学出版社, 1979.
[15] 金相灿, 屠清瑛. 湖泊富营养化调查规范 (第二版)[M]. 北京: 中国环境科学出版社, 1990.
[16] 林少君, 贺立静, 黄沛生, 等. 浮游植物中叶绿素a提取方法的比较与改进[J]. 生态科学, 2005, 24(1): 9–11.
[17] 鞠永富, 于洪贤, 于婷, 等. 西泉眼水库夏季浮游动物群落结构特征及水质评价[J]. 生态学报, 2016, 36(16): 5126–5132.
[18] 任晶晶, 林秋奇, 韩博平. 热带水库敞水区轮虫种类组成与数量结构——基于海南7座典型水库的分析[J]. 湖泊科学, 2010, 22(2): 272–280.
[19] 李慧明, 陈花, 韩小玉, 等. 海南热带水库敞水区浮游甲壳动物群落结构特征[J]. 湖泊科学, 2011, 23(2): 251–256.
[20] 杨桂军, 秦伯强, 高光, 等. 太湖不同湖区轮虫群落结构季节变化的比较研究[J]. 环境科学, 2008, 29(10): 2963–2969.
[21] 李秋华, 温远志, 杨卫诚, 等. 贵州百花湖麦西河河口后生浮游动物群落结构及与环境因子的关系[J].湖泊科学, 2013, 25(4): 531–538.
[22] 李秋华. 贵州高原水库富营养化特征及评价[J]. 贵州师范大学学报(自然科学版), 2018, 36(2): 1–8.
[23] 陈光荣, 钟萍, 张修峰, 等. 惠州西湖浮游动物及其与水质的关系[J]. 湖泊科学, 2008, 20(3): 351–356.
[24] RECORD N R, PERSHING A J, JOSSI J W. Biodiversity as a dynamic variable in the Gulf of Maine continuous plankton recorder transect[J]. Journal of Plankton Research, 2010,32(12): 1675–1684.
[25] 刘桂兰.两种贝类滤食对封闭水体透明度影响的研究[D]. 湛江: 广东海洋大学, 2014.
[26] 黄祥飞, 胡春英, 伍焯田.武汉东湖的轮虫[J]. 水生生物学报, 1985, 9(2): 129–143.
Metazooplankton community structure and its relationship with environmental factors of Caohai, Guizhou Province, China
ZHU Chongchong, LI Qiuhua*, CHEN Wensheng, HE Ying, XIAO Jing
Key Laboratory for Information System of Mountainous Area and Protection of Ecological Environment of Guizhou Province, Guizhou Normal University, Guiyang 550001, China
To understand the community structure of metazooplankton in Caohai, Guizhou and explore the relevant physicochemical factors on their distribution, we conducted seasonal investigations in 10 sites in the Caohai in October 2016 and January, April, July 2017. Non-metric multidimensional scaling analysis (NMDS) and redundancy analysis (RDA) were used to study the community structure of metazooplankton. Forty-five metazooplankton species were identified (excluding protozoa), and most of them were rotifers (32 species) having the highest abundance. The seasonal difference in metazooplankton abundance was significant, highest in spring (5287 ind.·L-1) and lowest in winter (73.20 ind.·L-1); the seasonal difference in metazooplankton biomass was significant, highest in spring (18.30 mg·L-1) and lowest in summer (1.50 mg·L-1).The dominant species were,,. In spring and summer, the dominant species were. There were no distinct dominant species in autumn and winter. Spatial location maps of samples obtained through NMDS, with four distinct seasons, reflected the hydrologic seasonality of the community structure. RDA showed that water temperature and secchi disk depth were the key factors affecting the metazooplankton community structure. Nutrients, pH and chlorophyll a were the important factors affecting the metazooplankton community structure.
metazooplankton ; community structure ; environmental factors ; NMDS ; RDA ; Caohai
10.14108/j.cnki.1008-8873.2018.06.017
Q178.51
A
1008-8873(2018)06-131-08
2017-11-24;
2018-01-02
贵州省科技厅项目(黔科合人字(2015)10号,黔科合平台人才[2018]5805)
朱冲冲(1988—), 女, 硕士, 主要从事水域生态学研究, E-mail: chong60927@126.com
李秋华, 男, 博士后, 教授, 主要从事水域生态学及水环境化学研究, E-mail:qiuhua2002@126.com
朱冲冲, 李秋华, 陈文生, 等. 贵州草海后生浮游动物群落季节动态特征及与环境因子的关系[J]. 生态科学, 2018, 37(6): 131-138.
ZHU Chongchong, LI Qiuhua, CHEN Wensheng, et al. Metazooplankton community structure and its relationship with environmental factors of Caohai, Guizhou Province, China[J]. Ecological Science, 2018, 37(6): 131-138.

