崂山奶山羊脂肪间充质干细胞系的建立及鉴定
刘宗正 ,肖 娜 ,杨培培 ,刘开东 ,李培培 ,王建华
(1.青岛市畜牧兽医研究所,山东 青岛 266100;2.青岛奥特种羊场,山东 青岛 266100;3.青岛派森诺基因科技有限公司,山东 青岛 266100)
脂肪间充质干细胞是一类存在于动物脂肪组织中的成体干细胞。近年来,其被广泛地应用于组织修复和基因治疗等领域[1-3]。目前,研究人员已从多种动物体内分离得到了脂肪间充质干细胞,但对于崂山奶山羊脂肪间充质干细胞的研究很少[4]。为此,笔者对崂山奶山羊脂肪间充质干细胞进行分离培养和诱导分化,以期为崂山奶山羊种质资源的研究提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 组织样品:脂肪组织取自1岁雄性育成崂山奶山羊的肾脏周围组织,崂山奶山羊由青岛奥特种羊场提供。
1.1.2 主要试剂:胎牛血清、牛血清白蛋白(BSA),购自SIGMA公司;青霉素、链霉素,购自华北制药厂;Ⅰ型胶原酶,购自GIBCO公司;DMEM/F12(1∶1),购自 HYCLONE 公司;DMSO,购自生工生物工程(上海)股份有限公司;Transzol up、反转录试剂盒、EASY Taq MIX、pEASY-T1 Cloning Kit等分子生物学试剂均购自北京全式金生物技术有限公司。
1.1.3 全能性相关基因引物序列及合成:根据NCBI GenBank中已公布的牛、羊和猪Oct-4、Sox-2、Nanog的mRNA序列,利用Primer Premier 5.0软件进行相似性比较,选取保守区序列,根据跨内含子原则进行引物设计,引物名称、序列及基因登录号见表1。引物由青岛派森诺基因生物技术有限公司合成。

表1 崂山奶山羊荧光定量RT-PCR引物序列
1.2 试验方法
1.2.1 崂山奶山羊脂肪干细胞(ADSCs)的分离与培养:选取成年崂山奶山羊公羊屠宰后,取肾脏周围白色脂肪组织,经PBS清洗2~3次后,超净台内切碎脂肪组织,在50 mL离心管中加入1∶1体积的PBS(含1%BSA和1%Ⅰ型胶原酶),37℃摇床振荡酶解1 h,每隔20 min用涡旋振荡器振荡1次。酶消化1 h后,1 200 r/min离心5 min,去除上层组织,加入等体积的红细胞裂解液,裂解红细胞20 min,离心清洗后加入7 mL DMEM完全培养基,重悬沉淀,以5×106个cell/mL的密度接种于卡式瓶中,于37℃、5%CO2的培养箱中培养,每3 d 换液 1 次[5]。
1.2.2 细胞的传代培养:首次接种的原代细胞生长至80%~90%汇合时,吸掉上清液,用PBS清洗后加入1 mL胰酶37℃消化1~2 min。待细胞变圆后加入2~3 mL完全培养基,终止消化。轻轻吹吸细胞,1 800 r/min离心5 min,弃上清液。加入1 mL完全培养基重悬,细胞悬液按照1∶3的比例传代培养。
1.2.3 崂山奶山羊ADSCs生长曲线的测定:细胞传至第3代时开始大量冻存细胞,同时选取生长状态良好的第3、5代细胞,利用胰酶消化制成单细胞悬液,以1×104个cell/孔密度接种于24孔板中,平均分成9组,每组3孔,每天计数3孔细胞,求平均值,至第9组结束。以时间为横坐标,细胞数量为纵坐标,绘制生长曲线。
1.2.4 Real time RT-PCR鉴定全能性相关基因:采用Transzol up提取第2、3、4代崂山奶山羊ADSCs的总RNA。反转录前首先进行去除基因组DNA 反应, 反应体系为 20 μL:5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL、RNA Free dH2O 0.5 μL,反应条件为:42℃、2 min,4℃保存。 将反应产物分装成10 μL/管之后加入RNase Free dH2O 4.0 μL、5×Prime Script Buffer 2 (for Real time)4.0 μL、RT Primer Mix 1.0 μL、PrimeScript RT Enzyme MixⅠ 1.0 μL, 反应条件为:37 ℃、15 min,85 ℃、5 s,4℃保存。实时定量 PCR反应体系为 20 μL:2×SYBR Premix EX TaqTM10 μL,上、下游引物各 0.3 μL(10 mol/L),RO×Reference Dye (50×)0.2 μL,RT反应液(cDNA)2 μL、dH2O 7.2 μL。 利用 ABI7500实时定量PCR仪进行PCR反应,反应程序为:94℃预变性 3 min;94℃变性 10 s,60℃退火 25 s,72℃延伸20 s,共40个循环。以Gapdh作为内参基因,采用 2-△△Ct法计算 Oct-4、Sox-2 和 Nanog 基因的mRNA相对表达量。
1.2.5 成骨诱导分化及鉴定:选取第3代ADSCs消化,按2×105个cell/mL密度接种于6孔板中。当细胞达到70%~80%汇合时,倒掉培养液,诱导组更换为诱导培养基 (DMEM/F12+10%FBS+10 mmol/L β-甘油磷酸钠+20 nmol/L 地塞米松+50 μg/mL抗坏血酸),对照组则继续正常培养。每3 d换液1次,观察细胞的生长情况,连续诱导21 d后,利用茜素红染色,用150 mmol/L的NaCl溶液冲洗细胞3次,70%冰乙醇4℃固定1 h后水洗3次,2%茜素红室温染色10 min,显微镜下观察染色结果。
2 结果与分析
2.1 崂山奶山羊ADSCs的分离与培养

图1 崂山奶山羊ADSCs原代培养及传代培养结果
崂山奶山羊原代培养的ADSCs在接种后细胞均悬浮于培养基中,培养1 h左右细胞开始贴壁生长,起初细胞贴壁后生长形态不规则,6 h观察时,细胞基本全部贴壁,但细胞中仍混有许多杂质,12 h经换液处理后,细胞形态清晰,48 h后贴壁生长的细胞开始大量繁殖,4~5 d时,细胞出现融合成片的趋势,此时细胞均呈现长梭形及多角形(见图1A),7~8 d后细胞相互融合,基本铺满瓶底,经2~3次传代培养后,利用酶消化时间差的处理方法,细胞得到进一步纯化,且形态基本一致,呈现均一长梭形,4~5 d后细胞生长再次达到80%融合(见图 1B)。
2.2 崂山奶山羊ADSCs生长曲线
由图2可知,崂山奶山羊ADSCs的生长曲线呈“S”形;第 3、5 代细胞在培养 1~2 d 时,细胞数量没有较大变化,此时细胞处于潜伏期;培养3 d后细胞开始快速生长,此时进入对数生长期;培养6 d时细胞生长开始减缓;培养7~8 d时,细胞数量基本维持不变,此时细胞生长进入平台期。
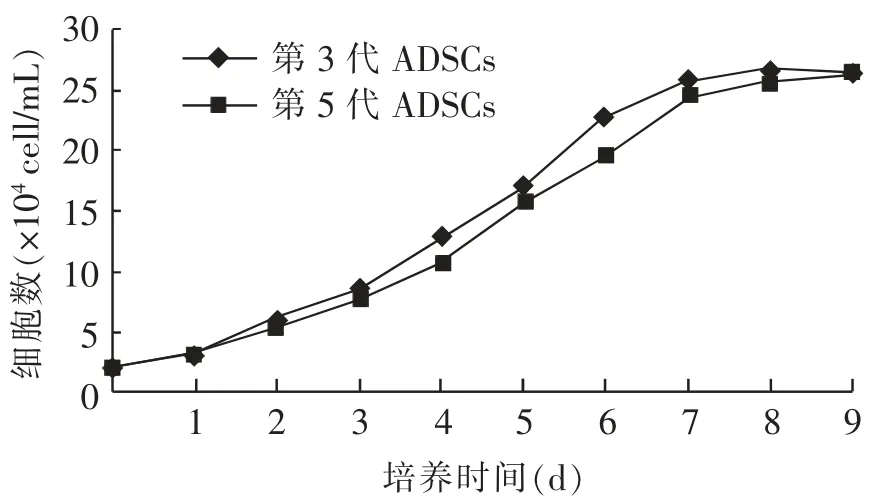
图2 崂山奶山羊ADSCs生长曲线
2.3 崂山奶山羊ADSCs全能性基因Real time RT-PCR结果
Real time RT-PCR结果显示,第2、3、4代崂山奶山羊ADSCs中均检测到Oct-4和Sox-2基因的表达(见图3A、B),但均未检测到Nanog基因的表达 (见图3C)。由图4可知,2个基因在第2代ADSCs中的表达量均较低,在第3、4代ADSCs中的表达量均较高。

图3 Oct-4、Sox-2及Nanog基因Real time RT-PCR反应熔解曲线

图4 第2、3、4代崂山奶山羊ADSCs中Oct-4和Sox-2基因的mRNA相对表达量
2.4 崂山奶山羊ADSCs成骨诱导分化结果
ADSCs一般在诱导10 d左右时即可出现明显的钙化结节,17 d左右时骨结节最显著(见图5 A),经茜素红染色后被染成深红色(见图5 B)。而对照组染色后并未见有深红色的骨结节出现 (见图 5 C)。
3 讨论与结论
近年来,间充质干细胞作为一种成体干细胞,逐渐成为国内外研究的热点,因其成熟的体外分离技术和较强的体外分化能力,在组织功能修复和创伤治疗方面具有不可替代的优势[6-8]。脂肪间充质干细胞由于其特定的存在方式和安全性,在美容医疗等方面越来越被接受。同时,由于脂肪组织中间充质干细胞数量较多,取材和处理的方式简单,且在体外增殖快速,因此,逐步成为成体干细胞研究中常用的组织工程种子细胞,其研究领域逐步延伸到了分子功能机制的水平[9]。
目前,国内外的许多研究已经从多种哺乳动物体内分离得到了脂肪间充质干细胞,但在国内,受限于地域和研究水平的问题,许多地方优良品种的脂肪间充质干细胞未见相关的报道[10]。在该研究中,笔者采用了常规的酶消化脂肪组织的方法,系统探讨了崂山奶山羊脂肪间充质干细胞的分离与培养技术。在该过程中,笔者分离得到了崂山奶山羊的脂肪间充质干细胞,细胞形态呈长梭形,与成纤维细胞相似。经传代后检测,细胞纯度较高,在多次传代后,形态始终保持均一。对第3、5代细胞进行生长曲线测定,在培养1~2 d时,细胞处于潜伏期;3 d后细胞开始快速生长,进入对数生长期;6 d时细胞生长开始减缓,7~8 d时,细胞生长进入平台期,这与先前的研究结果一致[11-12]。而采用Real time RT-PCR方法对崂山奶山羊脂肪间充质干细胞的多能性因子进行检测时,能够检测到传代后Oct-4和Sox-2基因的正常表达,但未检测到Nanog基因的表达,这说明脂肪间充质干细胞多能性因子表达不全,可能与各种类型的间充质干细胞所存在的组织有关[13]。
在该研究中,笔者采用成骨诱导分化的方法验证了脂肪间充质干细胞的诱导分化潜能,该方法也是最早被发现的分化验证方法之一。由于骨来源于中胚层,因此,成骨诱导也被认为是中胚层细胞的诱导能力[14]。该过程涉及多个信号通路的改变,诱导培养基中的地塞米松和β-甘油磷酸钠是成骨诱导所必需的试剂,地塞米松可以促进诱导成骨分化成熟,同时也可以提高碱性磷酸酶的活性,进而促进细胞外基质中胶原的合成。β-甘油磷酸钠是一种能够为成骨细胞提供磷酸离子的物质,可以促进细胞内钙盐的沉积和钙化的形成。采用茜素红染色后,可以观察到钙盐的沉积,其被染成深红色,这与前人的研究结果一致[15-16]。该研究未进一步进行基因水平的验证,但染色结果已经证明了崂山奶山羊ADSCs具有分化为中胚层骨细胞的能力,这为将其作为模型细胞研究骨损伤修复机制和方法以及作为骨组织工程的种子细胞研究提供了科学依据。
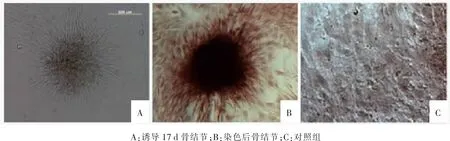
图5 崂山奶山羊ADSCs成骨诱导结果
综合上述结果,该研究建立了成熟、稳定的崂山奶山羊ADSCs分离、体外培养扩增及定向诱导分化的方法。分离获得的崂山奶山羊ADSCs在体外培养时表现出较高的增殖速率和诱导分化潜能,这为临床移植提供了充足的组织功能研究细胞来源,也为崂山奶山羊的保种、育种以及基因库建设提供了理论基础。

