光强调控三角褐指藻对海洋酸化的生理学响应
曾晓鹏 徐锦涛 邓子权 方逸麟 何铭华 夏建荣
(广州大学环境科学与工程学院, 广州 510006)
硅藻作为海洋浮游植物的重要类群, 贡献了近20%的全球初级生产力[1,2]。硅藻通过光合作用将溶解性无机碳(Dissolved inorganic carbon, DIC)转移到深海的过程是全球海洋生物泵的重要组成部分[3], 对全球碳循环具有重要的意义。由于水气界面的存在, CO2在海水中的扩散速率是缓慢的, 导致了海水中CO2浓度仅为海洋硅藻核酮糖-1,5-二磷酸羧化酶/氧化酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase, Rubisco) K1/2(CO2)的1/4—1/3[4—6],但大部分的硅藻拥有CO2浓缩机制(CO2Concentrating Mechanisms, CCMs), 用于克服海洋环境中低CO2浓度对光合作用的限制[7,8]。在工业革命后,人为排放CO2不断的增加, 预计到2100年大气中的CO2浓度将会达到1000 ppmv[9], 而大气中的CO2有近1/3被海洋吸收并导致表层海水pH下降0.3, 出现海洋酸化的现象[10,11]。海洋酸化将导致海水中CO2和浓度增加, 对海洋浮游植物的初级生产力和浮游植物的群落结构造成影响[12,13], 这种影响可能是正面的也可能是负面的[14,15]。在高浓度CO2条件下培养的藻会通过下调CCMs活性来节省CCMs运行过程中的能量消耗, 而在低浓度CO2条件下培养的藻细胞则通过增强CCMs活性以获取更多碳源用于光合作用[13,16,17]。
硅藻CCMs的运行是个耗能的过程, 其活性不仅取决于外部无机碳(Inorganic carbon, Ci)浓度, 还与光能的获取有着密切的联系[5,18]。藻类的光合作用为Ci的转运提供能量, 对CCMs的活性具有直接的影响[19—21]。光和CO2浓度是2个重要的环境因子,其对藻类的相互作用会影响藻类的光合生理和海洋生态环境[22]。在酸化和200 μmol photons/(m2.s)的光强下, 三角褐指藻能够减少CCMs运行过程中的能量支出, 并将这部分能量用于细胞的增长[16]。此外, CO2和光强的交互作用还会对浮游植物群落造成影响。当CO2浓度升高时, 低光强能够促进浮游植物群落的生长和碳的固定, 而在高光强下浮游植物群落初级生产力下降[23]。光和CO2对藻的生长和光合特性的影响是存在差异的, 涉及藻类对光和海洋酸化的响应机制还需要进一步探索[15,22]。
本文利用海洋浮游硅藻的模式藻种三角褐指藻作为实验材料, 通过测定不同光强和CO2浓度下三角褐指藻光合生理、碳酸酐酶(Carbonic anhydrase, CA)和Rubisco活性的变化, 探讨光强和CO2浓度对于三角褐指藻CCM的调节作用。
1 材料与方法
三角褐指藻bac-2 (Phaeodactylum tricornutumBohlin)取自中国科学院海洋研究所。藻细胞被培养在f/2加富的天然海水中, 温度为(20±1)℃, 设置高、低光的光强分别为160和50 μmol photos/(m2.s),培养液的pH分别控制在7.80±0.05、8.00±0.05和8.20±0.05, 相当于CO2浓度分别为25 μmol/L (High carbon dioxide concentration, HC)、16 μmol/L (Medium carbon dioxide concentration, MC)和11 μmol/L(Low carbon dioxide concentration, LC)。三角褐指藻的接种起始密度为500 cell/mL, 通过添加饱和CO2海水以维持培养液中pH。培养至18—20代后用0.45 μm聚酰胺滤纸过滤收集用于实验。
1.1 海水碳酸盐化学
通过滴定法测定海水[温度: (20±1)℃; 盐度:30‰]的总碱度(Total alkalinity, TA)[24,25]。通过TA、pH和硼酸浓度计算培养液中的碳酸碱度[26],CO2的浓度通过碳酸碱度计算获得[27]。
1.2 生长测定
用血球计数板在显微镜下对藻细胞进行计数。比生长速率(Specific growth rate, SGR)通过以下公式计算:μ=(lnX2-lnX1)/(T2-T1), 其中,X1和X2分别代表三角褐指藻在T1和T2时的细胞密度。
1.3 光合作用测定
采用Clark型氧电极(YSI 5300A, YSI, USA)在400 μmol photons/(m2.s)的光强下测定藻细胞的净光合放氧速率。用恒温循环水浴连接反应槽, 使反应槽中的温度维持在(20±0.1)℃, 测定过程中三角褐指藻的细胞密度约为6.0×106cell/mL。
1.4 可溶性蛋白含量测定
用考马斯亮蓝G-250染料结合法测定可溶性蛋白(Soluble protein, SP)含量[28]。将培养样品在4℃,12000×g的条件下离心3min收集藻细胞。在收集的藻细胞中加入5 mL的蒸馏水, 然后用超声波细胞破碎仪破碎藻细胞, 并在5000 r/min下离心10min。取1 mL上清液, 再加入5 mL考马斯亮蓝G-250溶液,用紫外可见分光光度计(UV-1800, 岛津, 日本)测定其在595 nm处的吸光度, 再用标准曲线计算SP含量。用牛血清蛋白作为标准。
1.5 叶绿素含量测定
通过离心(12000×g, 5min)收集藻细胞, 弃上清液, 加入5 mL 90%的丙酮, 然后在4℃的暗环境中静置12h。提取液在20℃, 5000 r/min的条件下离心10min后, 取上清液, 于紫外可见分光光度计(UV-1800, 岛津, 日本)上测定各波长下的吸光度。根据以下公式计算藻细胞的Chl.a,c含量[29]:
Chl.a(μg/mL)=11.47×A664-0.40×A630
Chl.c(μg/mL)=24.36×A630-3.73×A664
式中,A630和A664分别代表在波长630和664 nm下的吸光度。
1.6 碳酸酐酶活性测定
CA活性用调整后的电量法进行测定[30]。将纯水置于4℃恒温循环水浴中, 通入高纯度CO2气体约60min, 制取CO2饱和水。将反应槽连接在恒温水浴循环器上, 使反应槽中的温度维持在4℃。取5 mL含藻细胞(6.0×106cell/mL)的巴比妥溶液(20 mmol/L,pHnbs8.3)置于反应槽中, 然后加入4 mL的CO2饱和水(4℃)测定pHnbs8.3降至pHnbs7.3所需的时间。CA活性通过以下公式测定: Units CA=10×(T0/T-1),其中,T0和T分别表示不存在和存在酶的情况下pH从8.3下降到7.3所需的时间。
1.7 Rubisco活性测定
Rubisco活性测定参照Helbling等[31]的方法。离心收集藻细胞后, 将酶粗提取液加入到离心管中,摇匀后将细胞置于4℃的冷水浴中用超声波进行破碎, 然后在12000×g, 4℃下离心15min, 取上清液。酶粗提的缓冲溶液(pHnbs8.00)包含50.00 mmol/L Tril-HCl、20.00 mmol/L MgCl2、0.20 mmol/L EDTA (Ethylenediaminetetraacetic acid, EDTA)和5.00 mmol/L Glutathione。Rubisco活性测定混合溶液(pHnbs8.00)中包含0.20 mmol/L还原性辅酶Ⅰ(Nicotinamide adenine dinucleotide, NADH)、3.00 mmol/L ATP (Adenosine triphosphate, ATP)、5.00 mmol/L磷酸肌酸(Phosphatecreatine, CP)、25.00 mmol/L碳酸氢钠(Sodium Bicarbonate, NaHCO3)、22.00 units磷酸肌酸激酶(Creatine phosphokinase, CPK)、18.00 units 3-磷酸甘油磷酸激酶(3-Phosphoglyceric phosphokinase)和9.00 units甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)。将酶粗提取液加入到Rubisco测定的混合溶液中, 然后用紫外可见分光光度计(UV-1800, 岛津, 日本)在20℃下测定NADH在340 nm下吸光度的变化。藻细胞Rubisco活性以mAbs 340/mg protein.s表示。
1.8 数据分析
应用软件Excel和Origin 8.51进行数据处理与分析, 用单因素方差分析(One-way ANOVA)和Student'st-test分析不同实验处理间的差异性。直方图上不同字母表示在同一光强下不同浓度CO2处理之间的显著差异, 以P<0.05为差异显著水平。数值表示为平均值± SD,n=3。
2 结果
2.1 生长
如图 1所示, 在低光强下, 不同的CO2浓度下培养的三角褐指藻比生长速率并没有存在显著的差异(P>0.05); 而在高光强下, HC条件下培养的三角褐指藻比生长速率比MC和LC条件下培养的分别增加了2.20% (P<0.05)和3.2% (P>0.05)。

图 1 不同光强和CO2浓度对三角褐指藻比生长速率的影响Fig. 1 Effect of light intensity and CO2 concentration on specific growth rate of Phaeodactylum tricornutum
2.2 净光合速率
在低光强下, 不同浓度CO2下培养的三角褐指藻的净光合速率并无显著差异(P>0.05) (图 2)。而在高光强下培养的三角褐指藻的净光合速率随着CO2浓度的增加而显著升高(P<0.05), 在HC下培养的三角褐指藻的净光合速率分别是在MC和LC下培养的1.37 (P>0.05)和1.78倍(P<0.05) (图 2)。
2.3 叶绿素含量
在低光强下, 不同浓度CO2下培养的三角褐指藻Chl.a和Chl.c含量并无显著差异(P>0.05) (图 3)。在高光强下, LC下培养的Chl.a含量分别是MC和HC下培养的1.38 (P>0.05)和2.17倍(P<0.05); LC下培养的Chl.c含量分别是在MC和HC下培养的1.20(P>0.05)和2.24倍(P<0.05) (图 3)。
2.4 可溶性蛋白含量
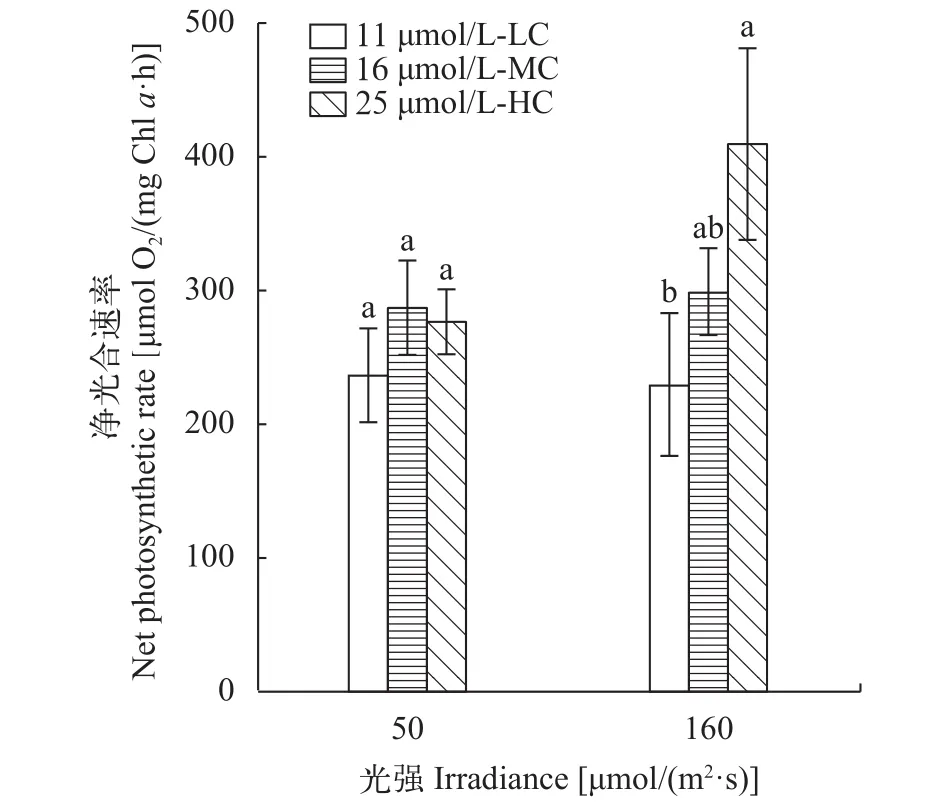
图 2 不同光强和CO2浓度对三角褐指藻净光合速率的影响Fig. 2 Effect of light intensity and CO2 concentration on net photosynthetic rate of Phaeodactylum tricornutum
在低光强下, 不同浓度CO2下培养的三角褐指藻可溶性蛋白含量并无显著差异(P>0.05) (图 4)。而在高光强下, MC和HC下培养的可溶性蛋白含量比在LC下培养的分别下降了20.0% (P<0.05)和28.8%(P<0.05) (图 4)。
2.5 碳酸酐酶活性
如图 5所示, 无论在高光强或低光强下, 三角褐指藻的胞外碳酸酐酶(eCA)活性均随CO2浓度升高而降低。在低光强下, MC和HC下培养的细胞其eCA活性分别是LC下培养的59.09% (P<0.05)和22.73% (P<0.05)。在高光强下, MC和HC下培养的eCA活性分别是LC下培养的62.71% (P<0.05)和39.98% (P<0.05) (图 5)。
2.6 Rubisco活性
如图 6所示, 在低光强下, Rubisco活性随CO2浓度增加而升高, 其均值分别为0.52、0.91和1.27×10-3mAbs/μg(SP).s, 其中在HC下培养的Rubisco活性分别是LC和MC下培养的2.42 (P<0.05)和1.39倍(P<0.05)。在高光强下Rubisco活性随CO2浓度增加而升高, 其均值分别为0.89、1.74和6.0×10-3mAbs/μg(SP).s, 其中HC下培养的Rubisco活性分别是LC和MC下培养的6.72 (P<0.05)和3.45倍(P<0.05)。
3 讨论
3.1 生长与光合作用
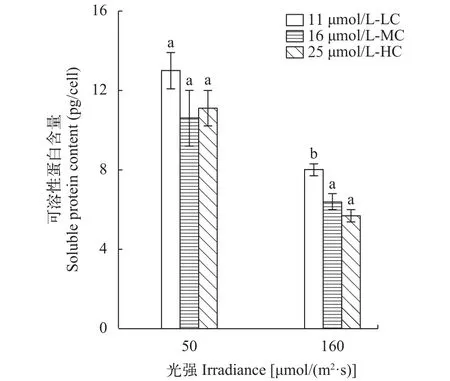
图 4 不同光强和CO2浓度对三角褐指藻可溶性蛋白含量的影响Fig. 4 Effect of light intensity and CO2 concentration on soluble protein content of Phaeodactylum tricornutum
光和CO2浓度是重要的环境因子, 对于藻类的光合作用和生长有重要的影响。早期的研究表明,高浓度的CO2和光强的增加将有利于促进藻的生长[13,16,32]。本研究结果表明, 在低光强下, CO2浓度变化对三角褐指藻的净光合速率和生长并无显著影响, 而在高光强下, CO2浓度的增加能够提高净光合速率和促进三角褐指藻的生长。CO2浓度升高能够促进藻细胞生长, 往往与藻细胞在高浓度CO2下减少了用于转运的能量输出并将这部分能量用于促进生长有关[33]。在低光条件下, 藻细胞获取光能的量减少, 对无机碳(Inorganic carbon, Ci)的利用能力受到限制[21,34], 使得藻细胞的光合作用达到饱和状态, 削弱了CO2浓度升高对净光合速率和生长的影响。因此, 在低光下, CO2浓度的变化对三角褐指藻的净光合速率和生长并无显著影响。而在高光和高浓度CO2条件下, 藻细胞能够获取更加充足的光能和碳源, 有利于提高净光合速率。此外,酸化条件下的藻细胞CCM的下调减少了能量消耗,并将这部分能量用于藻细胞的生长[17,35]。

图 5 不同光强和CO2浓度对三角褐指藻eCA活性的影响Fig. 5 Effect of light intensity and CO2 concentration on eCA activity of Phaeodactylum tricornutum
Sinutok等[36]的研究结果显示, 在光强250 μmol/(m2.s)和海洋酸化条件下Halimeda macroloba和Halimeda cylindracea的叶绿素含量明显下降, 这与我们的结果是相似的。在低光强下, 藻细胞通过增加叶绿素含量来提高光的捕获能力, 为CCM的运行提供更充足的能量[16]; 而在高光下, 藻细胞通过减少色素含量以达到光保护的目的[37]。此外, 在酸化条件下CCMs活性被削弱, 减少了能量的消耗, 促使藻细胞通过减少叶绿素含量来避免过度的光能吸收以达到光保护的目的[34]。叶绿素和SP的合成需要大量的N, 在低光下, ATP的合成减少, 导致藻细胞对N的同化能力受到限制并影响叶绿素和SP的合成,从而削弱CO2浓度对叶绿素和SP含量的影响[38]。而在高光强下, CO2浓度的升高导致三角褐指藻SP的含量减少, 这是由于在酸化条件下, 更多的N被用于藻细胞生长过程中的氮代谢和结构同化[39, 40]。

图 6 不同光强和CO2浓度对三角褐指藻Rubisco活性的影响Fig. 6 Effect of light intensity and CO2 concentration on Rubisco activity of Phaeodactylum tricornutum
3.2 酶活性
CA和Rubisco是硅藻CCMs和固碳的重要组成部分, CA通过催化CO2和相互转化的可逆反应以调节细胞内的CO2浓度, 而Rubisco是催化CO2进入生物圈的关键酶, 两者对于藻的光合固碳效率有着极为重要的影响。本研究结果表明在高、低光强下, CA活性均值随着Ci浓度的升高而降低, 这与Martin等[41,42]的研究结果是相一致的。CO2浓度的升高使得通过自由扩散进入藻细胞内部的CO2含量增加, 削弱了藻细胞对于eCA的依赖, 导致eCA活性降低。高光强对Rubisco活性是有促进作用的[43], 这是由于一方面, 光照能够增加Rubisco的表达量[44]; 另一方面, 光强的增加有利于生成更充足的ATP用于Rubisco的活化[45], 从而提高Rubisco活性。Wu等[46]的研究结果显示Rubisco活性随着CO2浓度的升高而增强, 这与我们的结果是相一致的。在酸化条件下, 藻细胞CCMs下调, 节省的能量能够用于Rubisco的活化, 提高Rubisco的活性[17,35,45]。此外, 增加CO2的浓度将提高细胞内CO2/O2值和促进Rubisco的羧化作用, 最终使藻细胞的光合效率得到增强[47]。而在低CO2浓度下, 卡尔文循环相关酶(包括Rubisco)活性的降低将导致生长所需底物和能量的缺乏, 最终影响藻细胞的增长[46]。在三角褐指藻光合作用过程中, 充足的光能有助于提高CCM的效率, CO2浓度的增加也有利于减少CCM的能量消耗, 提高光合固碳效率。因此,增加光强和提高CO2浓度能够优化硅藻CCM运行过程中的能量分配, 进而提高硅藻的光合固碳效率。

