基于超高效液相色谱-四极杆飞行时间质谱联用技术的血瘀模型大鼠血浆代谢组学分析
杨秀娟, 杨志军, 李 硕, 邓 毅*, 杨延泽, 曼 琼, 李鹏杰
(1. 甘肃中医药大学药学院, 甘肃 兰州 730000;2. 甘肃省高校中(藏)药化学与质量研究省级重点实验室, 甘肃 兰州 730000)
血瘀证是中医临床常见的证型,血瘀理论始载于《黄帝内经》[1]。目前,依据血瘀病因病机可建立如寒凝、气虚、外伤、郁怒等血瘀证动物模型,急性血瘀是其中之一。七情中“忧怒”和六淫中的“寒邪”为急性血瘀主要病因,在情绪暴怒时机体会分泌大量的肾上腺素。可给予大鼠皮下注射盐酸肾上腺素(Adr)模拟暴怒时的机体状态,并施以冰水浴刺激模拟“寒邪”刺激,二者合用可综合建立大鼠急性血瘀模型[2]。
代谢组学可从整体角度对机体生理及病理条件下产生的变化做出代谢应答,从内源性代谢物层面反应生物学事件,研究生命活动规律,已成为疾病诊断、病理生理等研究的重要手段。超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-TOF/MS)法具有高通量、高分离能力、高灵敏度和专属性等优势,可使基质干扰减少,改善极端复杂样品的分离状况[3,4]。
本研究采用UPLC-Q-TOF/MS技术测定血瘀模型大鼠血浆代谢组学数据,采用多元统计学方法筛选与血瘀证相关的生物标志物,分析代谢通路变化规律,研究血瘀证形成的代谢机制,为临床诊断血瘀证及开发相应的药物提供参考依据。
1 实验部分
1.1 仪器、试剂与实验动物
Triple TOF 5600+质谱仪(美国AB SCIEX公司); Agilent 1290 Infinity LC超高压液相色谱仪(美国Agilent公司); ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm, 1.7 μm,美国Waters分司)。SA-6000全自动血流变检测仪(北京赛科希德科技有限公司); Sysmex CA-1500全自动血凝仪(郑州瑞郎光学光源医疗电子有限公司);微量采血管40 μL(淄博来绪医用器材有限公司); 5430R低温高速离心机(德国Eppendorf公司); AL104电子分析天平(德国Mettler-Toledo公司)。
无特定病原体(SPF)级远交群大鼠(Sprague Dawley, SD)16只,雌雄各半,体重为180~220 g,由甘肃中医药大学动物实验中心提供,动物许可证号为SCXK(甘)2015-0002。适应性饲养一周后开始实验。
1.2 血瘀证大鼠模型的建立及分组
按照文献[2,5,6]的方法复制血瘀大鼠模型。SD大鼠随机分为空白对照组和血瘀模型组,每组8只。空白对照组不给予刺激,血瘀模型组于第7天皮下注射盐酸肾上腺素注射液(0.8 mg/kg)共2次,间隔时间为4 h。第1次皮下给予盐酸肾上腺素2 h后,将大鼠置于0 ℃冰水中游泳4 min,取出,擦干体表,2 h后再次皮下注射盐酸肾上腺素注射液0.8 mg/kg,禁食过夜,造成大鼠急性血瘀模型。
1.3 样品采集与血液流变学检测
造模后第9天腹主动脉取血,记录大鼠体重及体征变化。腹主动脉采血5 mL,加入已添加肝素钠的离心管中,记为样本1,用于测定血液流变学等指标。腹主动脉采血2 mL,收集在含有肝素钠的离心管中,以3 000 r/min的速度于室温离心10 min,取上清分装至1.5 mL离心管中,每管0.2 mL,置于-80 ℃冰箱冻存,用于测定血浆中代谢物,记为样本2。
采用全自动血流变检测仪测定全血黏度(WBV)(1、5、50、100和200/s切变率)、血浆黏度(PV)。
1.4 凝血功能相关指标测定
腹主动脉取血2 mL,加入已添加柠檬酸二钠的抗凝管中,采用全自动血凝仪测定活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB)。
1.5 样品制备
取1.3节样本2,在4 ℃环境下缓慢解冻后,取各组样本100 μL分别加入400 μL预冷甲醇/乙腈溶液(1∶1, v/v),涡旋混合,-20 ℃静置10 min,以12 000 r/min的速度于4 ℃离心20 min,取上清真空干燥。质谱分析时加入100 μL乙腈水溶液(乙腈:水=1∶1, v/v)复溶,涡旋,以12 000 r/min的速度于 4 ℃离心15 min,取上清液进样分析。
人人都说内蒙古的羊肉好吃。为什么好吃?其实也没什么奥秘,无非内蒙古的羊是吃沙葱的羊,沙葱本身去膻气,羊肉固然就少有膻味。
分别取按1.3节样本2方法处理的空白对照组和血瘀模型组样本各30 μL,混合,即得质控(quality control, QC)样本,用于测定进样前仪器状态及平衡色谱-质谱系统,并评价整个实验过程中系统的稳定性。
1.6 UPLC-Q-TOF/MS分析条件
样品采用Agilent 1290 Infinity LC超高效液相色谱系统(UPLC)进行分析。使用HILIC色谱柱进行分离;柱温为25 ℃;流速为0.3 mL/min;进样量为2 μL。流动相组成:A为含0.2%(体积分数,下同)乙酸铵的0.05%氨水,B为乙腈。梯度洗脱程序为:0~1.0 min, 95%B; 1.0~14.0 min, 95%B~65%B; 14.0~16.0 min, 65%B~40%B; 16.0~18.0 min, 40%B; 18.0~18.1 min, 40%B~95%B; 18.1~23.0 min, 95%B。整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性。
分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。样品经UPLC分离后用Triple TOF 5600+质谱仪进行分析。HILIC色谱分离后的ESI源条件如下:喷雾气(Gas1): 0.41 MPa;辅助加热气(Gas2): 0.41 MPa;气帘气(CUR): 0.21 MPa;离子源温度:600 ℃;离子肼电压漂移(ISVF):±5 500 V(正负两种模式);飞行时间质谱扫描质荷比范围:60~1 000;产物扫描质核比范围:25~1 000;飞行时间质谱扫描积累时间:0.20 s/spectrum;产物离子扫描积累时间:0.05 s/spectrum。二级质谱采用数据相关采集(IDA)获得,采用高灵敏度模式,IDA设置如下:排除同位素4 Da;每个周期监测候选离子:6;去簇电压(DP):±60 V(正负两种模式);碰撞能量:(35±15) eV。
1.7 数据分析
原始数据经ProteoWizard转换成.mzML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。代谢物结构鉴定采用精确质量数匹配(<25×10-6)和二级谱图匹配的方式,检索数据库。对XCMS提取得到的数据,删除组内缺失值>50%的离子峰。采用SIMCA-P14.1进行模式识别,数据经Pareto-scaling预处理后,进行多维统计分析,包括无监督主成分分析(PCA),有监督偏最小二乘法判别分析(PLS-DA)和正交偏最小二乘法判别分析(OPLS-DA)。单维统计分析包括变异倍数(FC)分析、T检验及火山图。
2 结果和讨论
2.1 模型验证
2.1.1证候变化
与空白对照组比较,造模后血瘀大鼠出现了弓背、耸毛、毛色无光泽等证候表现,蜷缩少动,喜扎堆,畏寒喜暖,四肢发冷,寒战,反应迟钝,爪尾部紫暗,耳缘及鼻唇发白,饮水、进食量减少,大便湿烂,肛门污秽。根据中医理论,造模大鼠出现上述证候,符合中医血瘀的辨证范畴。
2.1.2血液流变学变化
如表1所示,与空白对照组相比,血瘀模型组大鼠中WBV 1、5、50、100和200/s切变率显著升高,PV显著升高,差异有统计学意义。
2.1.3凝血功能变化
如表2所示,血瘀模型组大鼠PT、APTT值分别为(8.22±0.28) s和(35.17±1.40) s,与空白对照组相比,数值显著降低,差异有统计学意义(P< 0.01); FIB值为(4.54±0.39) g/L,数值显著升高,差异有统计学意义(P<0.01)。

表 1 血瘀大鼠全血及血浆黏度分析结果(n=8)Table 1 Results of the whole blood viscosity (WBV) and plasma viscosity (PV) analysis of the blood-stasis rats (n=8)
*P<0.05, **P<0.01, compared with the control group.

表 2 血瘀大鼠凝血指标(n=8)Table 2 Coagulation index in the blood-stasis rats (n=8)
PT: prothrombin time; FIB: fibrinogen; APTT: activated partial thromboplastin time. **P<0.01, compared with the control group.
综上所述,显示造模成功。
2.2 质量控制
将QC样本的总离子流图进行谱图重叠(n=6),结果见图1。结果表明,各色谱峰的响应强度和保留时间基本重叠,说明在整个试验过程中仪器误差引起的变异较小,采用XCMS软件对代谢物的离子峰进行提取,将空白对照组、血瘀模型组和QC样本提取得到的峰采用Pareto-scaling进行PCA分析,正、负离子模式下QC样本紧密聚集在一起,表明本试验的重复性好,结果见图2。
综上所述,本次试验的仪器分析系统稳定性较好,试验数据稳定可靠,在试验中获得的代谢谱差异能反映样本自身间的生物学差异。

图 1 质控血浆样品总离子流图(n=6)Fig. 1 Total ion current (TIC) chromatograms of quality control (QC) plasma samples (n=6)

图 2 电喷雾电离模式下血浆样本的PCA得分图Fig. 2 Principal component analysis (PCA) score plots of the plasma samples in the electrospray ionization mode

图 3 空白对照组与血瘀模型组大鼠血浆代谢物的(a)PCA、 (b)PLS-DA和(c)OPLS-DA图Fig. 3 (a) PCA, (b) differentiation analysis of super- vised partial least squares method (PLS-DA) and (c) orthogonal partial least squares discriminant analysis (OPLS-DA) of the rat plasma metabolites in the blank control group and blood stasis model group
2.3 多变量统计分析
血浆样品经HILIC色谱分离条件得到数据,经处理后得到PCA图(见图3a),结果显示,第一主成分(PC1)和第二主成分(PC2)维度上,空白对照组与血瘀模型组有一定的分离趋势。参考文献[7],采用PLS-DA和OPLS-DA建立代谢物表达量与样品类别之间的关系模型,来实现对样品类别的预测。PLS-DA是一种有监督的判别分析统计方法,运用偏最小二乘回归建立代谢物表达量与样品类别之间的关系模型,来实现对样品类别的预测,建立空白对照组与血瘀模型组的PLS-DA模型,经7次循环交互验证得到的模型评价参数R2Y、Q2(R2Y表示模型对Y变量的解释率,Q2表示模型预测能力)分别为0.995、0.854(正离子模式)和0.996、0.911(负离子模式),R2Y和Q2均不小于0.5,表明模型稳定可靠(见图3b)。OPLS-DAD在PLS-DA的基础上进行修正,滤除与分类信息无关的噪音,提高了模型的解析能力和有效性,建立空白对照组与模型组的OPLS-DA的模型,从图3可知,空白对照组与血瘀模型组分离趋势较好。经7次循环交互验证得到的模型评价参数(R2Y、Q2)分别为0.967、0.816(正离子模式)和0.978、0.879(负离子模式),R2Y和Q2均不小于0.5,表明模型稳定可靠(见图3c)。
2.4 单变量统计分析
采用FC分析、T检验及火山图对空白对照组与血瘀模型组的数据进行单变量分析,可筛选出血瘀模型大鼠的差异代谢物,以FC>2.0且P<0.05作为筛选标准,FC指血瘀模型组相对于空白对照组的变化倍数。火山图中偏离轴线的点为FC>2.0且P<0.05的差异代谢物(见图4)。将所得到的差异代谢物进行聚类分析,得到热图(见图5)。当筛选的代谢物合理准确,同组样本可通过聚类出现在同一簇(cluster)中,聚在同一簇内的代谢物具有相似的表达模式,本试验结果表明,空白对照组与血瘀模型组可明显聚为两类,表明所筛选的代谢物合理。
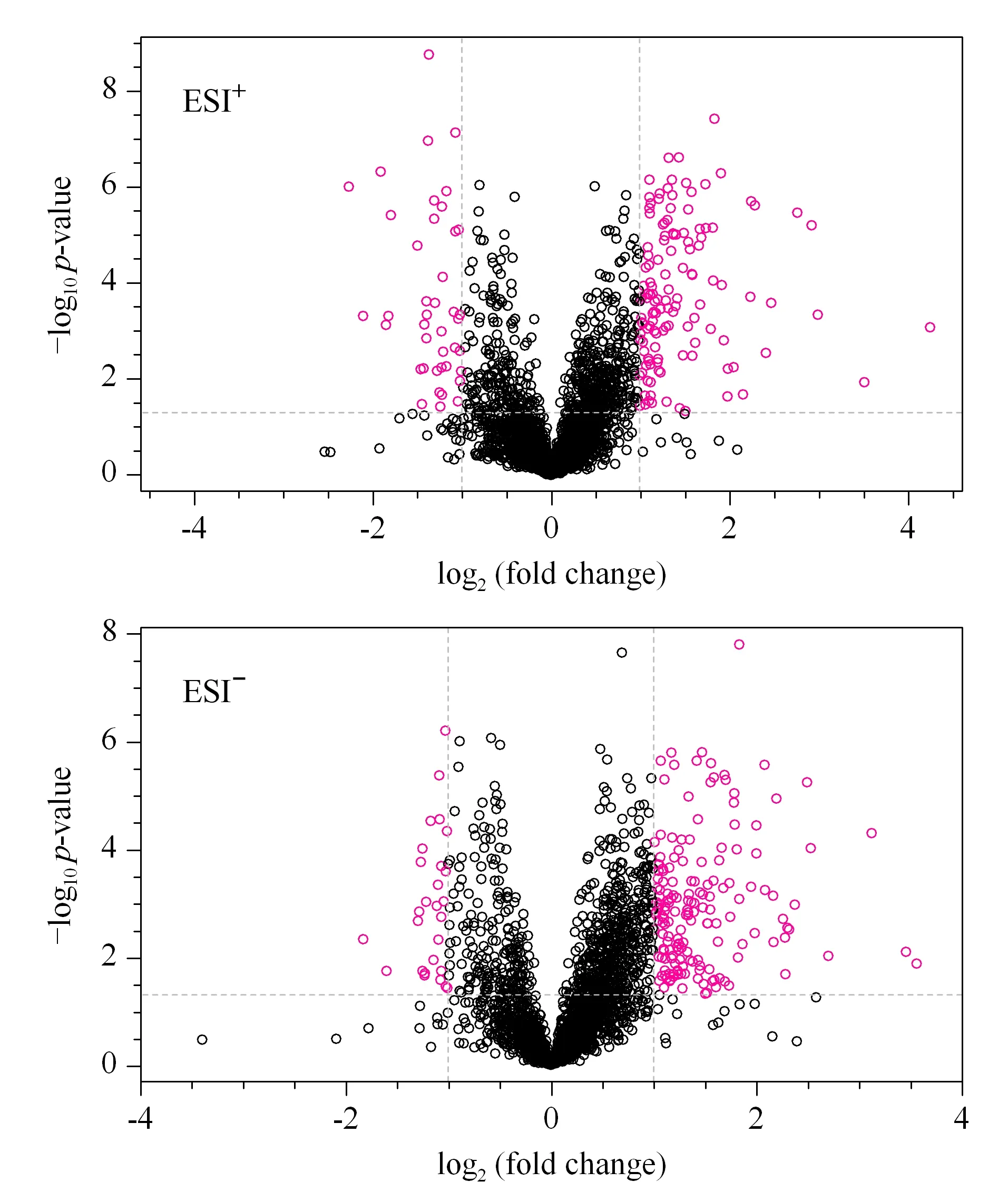
图 4 空白对照组与血瘀模型组大鼠血浆代谢物火山图Fig. 4 Volcano map of the rat plasma metabolites in the blank control group and blood stasis model group

图 5 空白对照组与血瘀模型组大鼠血浆代谢物热图Fig. 5 Heat map of the rat plasma metabolites in the blank control group and blood stasis model group
2.5 差异代谢物筛选及鉴别
与空白对照组比较,血瘀模型组共筛选出差异代谢物46个,以FC来评价血瘀模型组与空白对照组间代谢物变化的显著性,FC>1,代表代谢物相对含量升高,用“↑”表示;FC<1,代表代谢物相对含量降低,用“↓”表示。与空白对照组比较,血瘀模型组中乙酰胆碱、N6,N6,N6-三甲基-L-赖氨酸、胞嘧啶、乙酰肉碱、3-甲基组氨酸、甜菜碱、酪胺、异亮氨酸、胸腺嘧啶、二甲基甘氨酸、胆酸、甲基烟酰胺、肉碱、肌氨酸、蛋氨酸、3-甲氧基-4羟基苯基乙二醇-硫酸盐、苯基丙氨酸、葡萄糖、3-羟苯基丙酸、脱氧胞苷、胸苷、葡萄糖、乳酸显著上调,吲哚丙酸、磷脂酰胆碱(PC)(14∶0)、PC(18∶1(9Z))、PC(18∶0)、PC(16∶0)、PC(18∶1(9Z)/18∶1(9Z))、甘露醇、甘油、色氨酸等代谢物显著下调,见表3。
将筛选所得差异代谢物输入KEGG数据库(www.kegg.jp/kegg/mapper.html)。与空白对照组比较,血瘀模型组中亚油酸、亚麻酸、LysoPC(16∶0)、LysoPC(14∶0)、LysoPC(18∶0)、LysoPC(18∶1(9Z))、PC(18∶1(9Z)/18∶1(9Z))、1-硬脂酰-2-油酰-sn-甘油3-磷脂酰胆碱(SOPC)、花生四烯酸等代谢物水平显著降低,乙酰胆碱水平升高。这些代谢产物主要参与亚油酸代谢、亚麻酸代谢、甘油磷脂代谢及花生四烯酸代谢,表明脂质代谢物和胆碱类物质可能在血瘀疾病中被干扰,这与相关报道[8-10]一致。
脂质及甘油磷脂代谢:通过给予大鼠盐酸肾上腺素和冰水浴后,血瘀模型中磷脂酰胆碱代谢速度加快,磷脂酰胆碱在磷脂酶A2的作用下转化为花生四烯酸,花生四烯酸可进一步转化为血栓烷A2、血栓烷B2,造成血瘀及更严重的血栓等一系列心血管疾病[11]。LysoPC也是通过磷脂酶A2的作用由磷脂酰胆碱产生的,而磷脂酶A2可调控血管张力并诱发内皮功能障碍[12]。在血瘀形成中,LysoPC可抑制转录活动组织因子和NF-κB,通过调控组织因子的表达参与血栓形成[13]。
氨基酸代谢:苯丙氨酸是一种人体必需的芳香族氨基酸,机体的生长发育和正常生理机能的维持需要稳定的苯丙氨酸代谢状态。苯丙氨酸在血浆中水平升高可阻断苯丙氨酸代谢,从而导致血瘀。酪胺、苯酚参与酪氨酸代谢,在血瘀状态下,由于酪氨酸羟化酶和多巴胺-β-羟化酶2种合成限速酶的表达可使得儿茶酚胺和酪胺生成增加[14],在本试验中,酪胺水平升高,酪胺参与酪氨酸代谢,酪氨酸是神经递质和激素的前体,包括肾上腺素、去甲肾上腺素等,在体内具有增强新陈代谢的作用。肾上腺素和去甲肾上腺素结合引起血管收缩,增加血液黏度[9]形成血瘀。色氨酸是蛋白质生物合成的基础,是神经递质5-羟色胺合成的前体,5-羟色胺是体内重要的神经调节物质,具有很强的收缩血管作用[15],由于体内血瘀的形成,造成主要参与色氨酸代谢的L-色氨酸含量在血瘀模型中降低。异亮氨酸属于支链氨基酸,其合成所需的碳骨架来源于糖无氧代谢和有氧代谢的中间产物[16],牛磺酸与亚牛磺酸代谢通路侧面反映了机体能量代谢水平,血瘀模型中牛磺酸、牛磺胆酸盐含量下降,表明血瘀模型大鼠体内能量代谢紊乱[17]。
半乳糖代谢和糖酵解:葡萄糖、甘油、甘露糖、乳酸参与了半乳糖代谢和糖酵解,说明在血瘀证的病理变化中,心肌需要更多的能量,此时主要通过糖酵解来供应[18]。
综上,血瘀模型主要与脂质代谢(LysoPC(14∶0)、LysoPC(18∶1(9Z))、LysoPC(18∶0)、LysoPC(16∶0))、不饱和脂肪酸生物合成(花生四烯酸、亚油酸、亚麻酸)、糖酵解(葡萄糖、DL-乳酸)、半乳糖代谢(D-甘露糖、葡萄糖、甘油、乳酸)、亚油酸代谢(SOPC、亚油酸、花生四烯酸)、甘油磷脂代谢(SOPC、乙酰胆碱)、牛磺酸与亚牛磺酸代谢(牛磺酸、牛磺胆酸盐)、氨基酸代谢(色氨酸、异亮氨酸、苯丙氨酸)、酪氨酸代谢(酪胺、苯酚)等代谢通路有关。
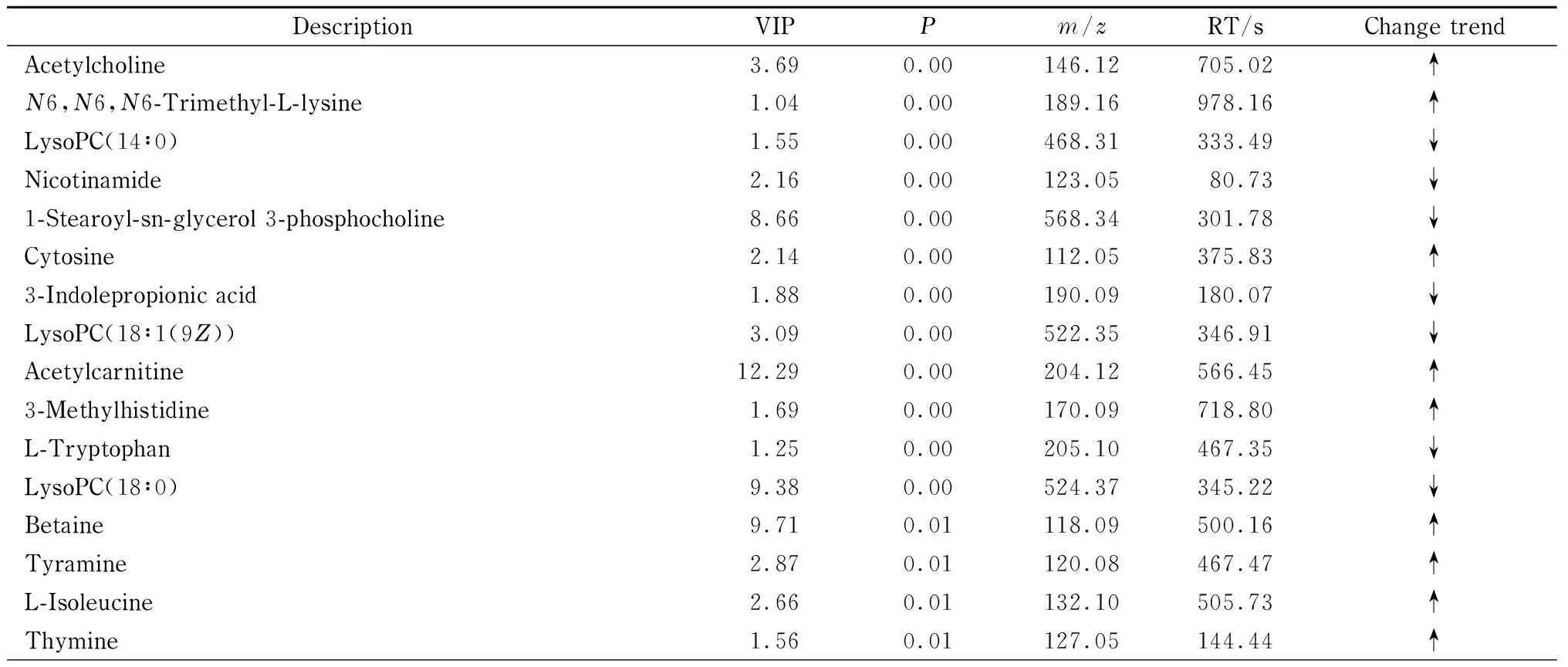
表 3 电喷雾电离模式下空白对照组与血瘀模型组中的差异代谢物Table 3 Different metabolites of the plasma sample in the blank control group and blood stasis model group in the electrospray ionization mode

表 3 (续)Table 3 (Continued)
VIP: variable importance for the projection; RT: retention time; ↑: up-regulated; ↓: down-regulated.
3 结论
本文利用代谢组学的分析手段检测血瘀模型大鼠中代谢物的变化,与空白对照组相比,血瘀模型在脂质代谢、糖酵解、氨基酸代谢及不饱和脂肪酸代谢方面发生不同程度的紊乱,与现有文献[7,8]报道情况基本相符。通过对相关代谢物及代谢通路进行深入分析,发现“生物标志物群/谱”能全面反应机体代谢功能的变化,也能更好地对疾病证候进行判别归类分析,并为研究与血瘀证相关疾病的(冠心病、脑血栓等)机制、筛查或临床药物治疗提供一种新的思路。
- 色谱的其它文章
- 高效液相色谱-串联质谱法测定蔬菜水果中双甲脒及其代谢产物
- 高效液相色谱-四极杆/静电场轨道阱高分辨质谱对水产品中未知污染物的非定向快速筛查与测定
- 高效液相色谱-四极杆飞行时间质谱检测中国杨树型蜂胶、巴西绿蜂胶和杨树胶中的酚类化合物及真伪鉴别
- γ-Al2O3-氧化石墨烯吸附材料用于尿液中核苷的检测
- 基于高效液相色谱-三重四极杆质谱技术测定荔枝和香蕉中的草铵膦及3种代谢物
- Impurity profile of macitentan in Tablet dosage form using a stability-indicating high performance liquid chromatography method and forced degradation study

