枸杞籽油对CUS致小鼠应激行为的保护作用
郑 婕,薛旻秋,权洪峰,王 锐,朱亚飞,景 晶,华 冰,彭晓东
(宁夏医科大学药学院,宁夏回药现代化工程技术研究中心,回医药现代化省部共建教育部重点实验室,宁夏回医药协同创新中心,宁夏颅脑疾病重点实验室-省部共建国家重点实验室培育基地,生育力保持教育部重点实验室,宁夏 银川 750004)
应激与多种神经、精神系统疾病的发病密切相关。慢性心理应激(chronic psychological stress,CPS)不仅引起以行为、精神、情感、学习记忆异常等为表现的脑功能性损害,同时,还是诸多神经精神系统疾病病理生理变化的诱因[1]。环磷酸腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element-binding protein,CREB)-脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号通路是与神经精神系统疾病相关的信号调节通路[2]。研究显示,应激可导致CREB-BDNF通路失调,继而引发抑郁样行为和学习记忆障碍。因此,有学者推测,CREB-BDNF信号通路上调可能是改善应激抑郁样行为和认知障碍的重要靶点[2]。枸杞子(LyciumbarbarumL.)为茄科植物宁夏枸杞的成熟果实,作为我国传统的名贵中药材和重要经济作物,具有多种明确且高效的药理活性,如神经保护、生殖保护、免疫调节、抗肿瘤、抗氧化、延缓衰老、降血糖、降血脂、抗脂肪肝等[3]。枸杞籽油(Lycium barbarum seed oil,LBSO)是以枸杞的种子为原料,采用现代萃取技术获得的富含多种生物功效的功能成分,含有不饱和脂肪酸、维生素E、卵磷脂、硒等多种生物功效的功能成分[4]。目前,有关LBSO的成份研究及其保健、药理效应的探讨尚处于初步阶段,LBSO是否对慢性应激引起的抑郁样行为和认知障碍具有改善作用?目前尚未见报道。本研究将基于CREB-BDNF信号通路,探讨LBSO对慢性应激的改善作用及其可能的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级♂ICR小鼠90只,体质量(20±2)g,宁夏医科大学动物实验中心提供,医学动物许可证号: SYXK(宁) 2011-0001。
1.1.2药物与试剂 LBSO购于宁夏沃福百瑞枸杞产业股份有限公司,为枸杞籽超临界CO2提取物;脂肪酸甲酯混标(Item No: CDAA-252795-MIX,Lot: 13260395,上海ANPEL);盐酸氟西汀分散片(fluoxetine,Flx)由Patheon France 生产,礼来苏州制药有限公司提供,用时采用生理盐水配制成混悬液,4 ℃冰箱保存备用。皮质酮ELISA试剂盒、BDNF抗体,购自Abcam公司;抗CREB(48H2)、p-CREB(Ser133)(87G3)抗体,购自Cell Signaling公司。
1.1.3仪器 GCMS-QP 2010 Plus气相色谱-质谱联用仪(日本岛津);Rxi-5Sil MS石英毛细管柱(30 m×0.25 mm,0.25 μm,美国Restek);BL-420E+生物机能实验系统、Morris水迷宫跟踪分析系统及其工作站(成都泰盟科技);JH-2张力换能器(中国北京航天医学工程研究所);MultiskanTMGO酶标仪(Thermo Fisher Scientific公司);低温高速离心机(Heal Force);BX-51显微镜(日本Olympus);ChemiDoc XRS+凝胶成像系统(Bio-Rad);图像分析软件Image-Pro Plus 6.0(美国Media-Cybornetics)。
1.2方法
1.2.1LBSO中脂肪酸GC-MS成分分析
1.2.1.1 供试溶液制备 取LBSO约0.1g,精密称定。依据药典方法进行甲酯化反应,得到供试检测液。
1.2.1.2 气质联用条件 GC条件:升温程序为初始柱温180 ℃,以3 ℃·min-1升至240 ℃,运行时间21.5 min;载气(He)流速1.41 mL·min-1;压力142.2 kPa,柱温180 ℃,注射温度260 ℃;进样量1 μL ;分流比70 ∶1。MS条件:电子轰击离子源;离子源温度230 ℃;接口温度300 ℃;质量扫描范围m/z 33~500;检测时间3.50~21.50 min。
1.2.1.3 分析结果 按GC-MS分析条件,取供试品溶液1.0 μL进样,得LBSO甲酯化产物的总离子流(total ion current,TIC)图。各色谱峰相应的质谱图经对照脂肪酸甲酯混标,人工解析及NIST08、NIST08s数据库检索,按各色谱峰的质谱碎片图与文献核对,对基峰质荷比和相对丰度等方面进行直观比较,鉴定各成分。同时采用色谱数据处理系统,以峰面积归一化法计算LBSO中各组分的相对百分含量。
1.2.2动物实验分组和给药 90只♂ ICR小鼠,适应性饲养3 d后进行实验。随机分为6组:正常组、模型组、氟西汀组及LBSO低、中、高剂量组,每组15只。除正常组群养外(5只/笼),其余各组均采用单笼饲养(1只/笼)。LBSO低、中、高剂量组和氟西汀组每天灌胃给予LBSO 2.5、5.0、10.0 mL·kg-1及氟西汀20 mg·kg-1,正常组和模型组灌胃给予等体积生理盐水,自造模d 1开始,至取材前1 d结束,持续35 d。
1.2.3建立慢性不可预见性刺激(chronically unpredicted stress,CUS)小鼠模型 参照文献[5],制备CUS小鼠模型。刺激方式包括:夹尾1 min,足底电击5 min,4 ℃冰水游泳刺激5 min,噪音刺激10 min,束缚1 h,禁食禁水24 h,通宵照明,潮湿垫料,共8种不同刺激。为了实现刺激程序的不可预见性,每种刺激不在连续的2 d内重复使用。正常组5只/笼饲养于被隔离的实验室,除更换饲料、水和垫料外,不进行任何刺激。模型组、氟西汀组、LBSO低、中、高剂量组均在灌胃给药1 h后,连续28 d进行CUS造模。整个实验周期为35 d,于d 29开始进行行为学检测,实验流程图见Fig 1。
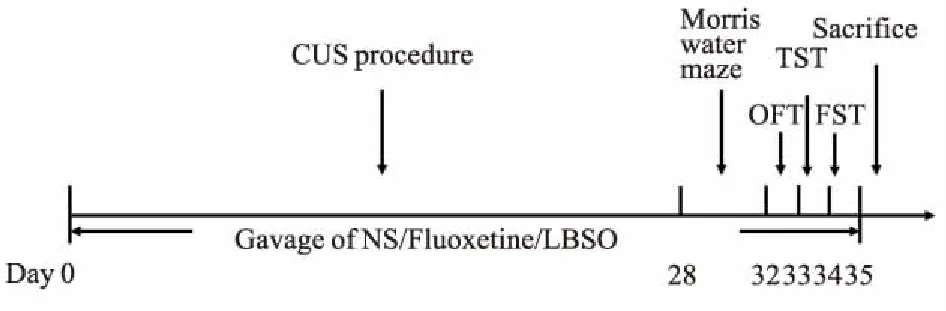
Fig 1 Flow chart of experiment
1.2.4行为学检测
1.2.4.1 旷场实验(open field test,OFT) 参照本实验室前期报道的建模方法[5],将规格为30 cm×30 cm×30 cm的无盖透明塑料箱放置在安静房间中,方箱内壁和底面涂白,底面均分为10 cm×10 cm的9个方格,摄像头垂直在方箱中心上方约30 cm。保持实验环境安静,将小鼠放入方箱中心格内,开始拍摄记录6 min,统计小鼠后4 min内水平移动格数(四肢均进入方格的穿越格数)。为了避免残留气味对下一只小鼠的影响,每只小鼠实验开始前均需要用低浓度酒精擦拭方箱,去除气味。
1.2.4.2 悬尾实验(tail suspension test,TST) 参照文献及本实验室前期报道的建模方法[5-6],在安静避光房间中,将小鼠垂直悬挂于50 cm×50 cm×50 cm的无盖敞箱中,使小鼠鼻尖至纸箱底面约5 cm,并与JH-2张力换能器相连。自悬挂开始后,通过BL-420E+生物机能实验系统记录6 min张力换能器的受力变化,统计后4 min小鼠的不动时间。
1.2.5强迫游泳实验(forced-swimming test,FST) 参照本实验室前期报道的建模方法[5],保持实验环境安静,将小鼠放入直径20 cm、高60 cm的保温桶中,每缸加入(25±1) ℃、深30 cm的温水,保证小鼠尾部无法触碰保温桶底部,上肢无法触碰保温桶上沿。自小鼠放入水中开始摄像记录6 min,统计后4 min小鼠的不动时间(小鼠漂浮在水上保持固定姿势超过2 s)。实验时每桶1只动物,实验完毕后,捞出的小鼠用热灯烤干,且每只小鼠实验前换水。
1.2.6Morris水迷宫实验(Morris water maze test,MWMT) 参照文献的方法并略有改进[7]。Morris水迷宫为直径1 m,深60 cm的圆桶,加入(25±1) ℃、深约30 cm的不透明温水,并在桶的E、N、W、S四个方向做好标记,作为小鼠入水点。实验时,采用Morris 水迷宫跟踪分析系统及其工作站记录并分析。
实验分两部分进行,第一部分空间记忆采集实验用于检测动物的学习和记忆获得能力,于d 29~31进行。将直径为3 cm的黑色平台置于第三象限中央,每天每只小鼠分别从E、N、W、S 4个入水点背向平台放入水池,记录自放入水池至小鼠站上平台的时间,即逃避潜伏期及游程。如果小鼠在90 s内未站上平台,将其引导至平台上停留5 s,并记录逃避潜伏期为90 s。第二部分空间探索实验用于测量动物对平台位置的记忆保持能力,于d 32进行。实验时移除平台,将小鼠从固定位置点放入水池,通过Morris水迷宫跟踪分析系统记录小鼠90 s内在原平台所在区域内穿行的次数,即原平台有效穿越次数。记录90 s内小鼠的游泳路线,即空间探索实验轨迹图。每次实验完成后,用热灯将小鼠毛发烤干。
1.2.7CUS小鼠血清皮质酮含量的检测 行为学实验全部完成后,禁食不禁水12 h,取材。小鼠腹腔注射4%水合氯醛10 mL·kg-1麻醉,待角膜反射消失后,摘眼球取血,4 ℃、3 000 r·min-1离心15 min,取血清,-80 ℃冻存备用。依据试剂盒要求进行检测。
1.2.8Western blot检测小鼠海马组织内BDNF、CREB、p-CREB蛋白表达 取血后,处死小鼠,打开颅腔取双侧海马,液氮速冻后-80 ℃保存。检测时,取冻存的海马组织,提取总蛋白,BCA法定量蛋白浓度。40 μg蛋白进行SDS-PAGE 凝胶电泳、转膜,5%脱脂牛奶室温封闭2 h,分别加入BDNF(1 ∶400)、CREB(1 ∶1 000)、p-CREB(1 ∶1 000)及β-tubulin(1 ∶1 000)一抗,4 ℃孵育过夜,TBST洗膜3次,加入二抗室温封闭75 min后, TBST洗膜3次,ECL显色,凝胶成像系统进行检测分析,以 β-tubulin为内参,校正 BDNF、CREB、p-CREB的蛋白表达,即蛋白相对表达量=目的蛋白条带灰度/β-tubulin条带灰度。

2 结果
2.1LBSO中脂肪酸含量从LBSO样品中共分离出5个组分,其中含量最高的是(Z)-9-十八碳烯酸,含量为66.40%,其次为反式-9,12-十八碳二烯酸,含量21.56%。另外,还含有十七酸、十八烯酸和反式-9-十八烯酸(Tab 1、Fig 2)。含量测定为本次实验提供了较为详细的LBSO脂肪酸组成。
2.2CUS应激后小鼠行为表现及LBSO的干预作用如Fig 3所示,与对照组小鼠相比,模型组小鼠旷场实验运动得分明显降低(P<0.01);悬尾及强迫游泳不动时间明显延长(P<0.05,P<0.01)。与模型组比较, LBSO高剂量组明显增加水平穿越格数(P<0.01),LBSO低、高剂量组明显缩短悬尾不动时间(P<0.05,P<0.01),在强迫游泳实验中,LBSO各剂量均能明显缩短CUS小鼠的不动时间(P<0.01)。
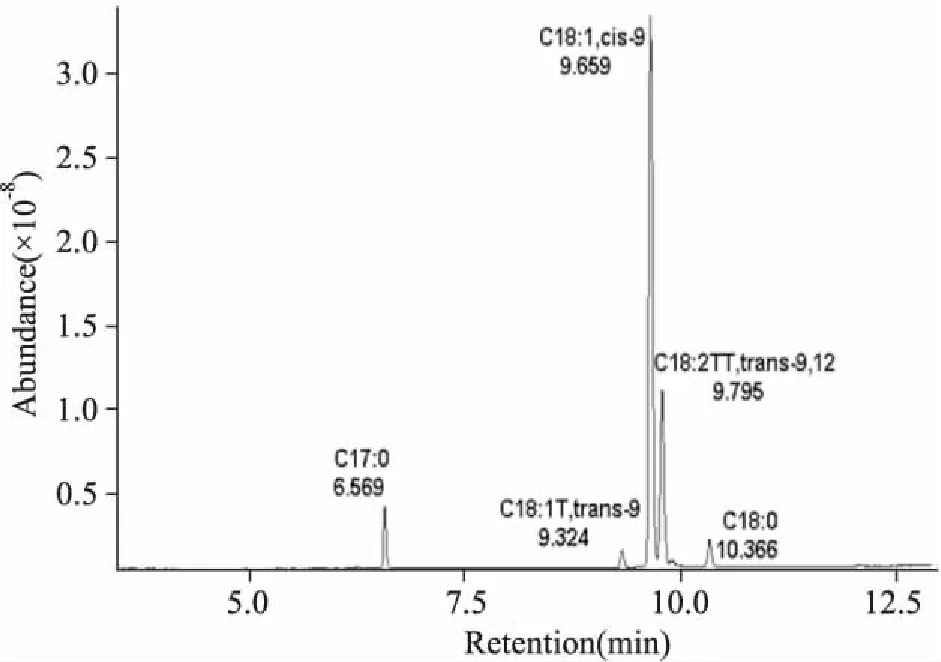
Fig 2 Total ion chromatogram of full scan in LBSO by GC-MS
Fig 4的MWMT结果显示,CUS小鼠不同程度地出现空间记忆能力损害。与对照组相比,模型组小鼠的逃逸潜伏期、平均潜伏距离明显延长(P<0.05),穿越原平台有效次数明显降低(P<0.01)。与模型组相比,LBSO高剂量组明显缩短逃逸潜伏期,增加穿越原平台有效次数(P<0.01),LBSO低、高剂量组则缩短平均潜伏距离(P<0.05,P<0.01)。
2.3LBSO对CUS小鼠血清皮质酮水平的抑制作用如Fig 5所示,与正常组相比,模型组小鼠的血清皮质酮明显升高(P<0.01);与模型组相比,LBSO高剂量组小鼠的血清皮质酮低于模型组(P<0.05)。
2.4LBSO对CUS小鼠海马组织中BDNF、CREB、p-CREB蛋白表达的影响如Fig 6所示,与正常组相比,模型组小鼠BDNF蛋白表达及p-CREB/CREB比值明显下降(P<0.05);与模型组比较,LBSO高剂量组明显上调CUS小鼠海马p-CREB、BDNF蛋白表达(P<0.05,P<0.01)及p-CREB/CREB的比值(P<0.05)。提示LBSO能够通过调节CREB-BDNF信号通路相关蛋白,减轻CUS引起的应激损害。
3 讨论
以中药枸杞子的种子为原料,采用现代萃取技术获得的富含多种生物功效成分的“枸杞籽超临界CO2提取物”已经成为替代传统工艺获得枸杞籽中油性成分的主要方法。虽然仍然称其为枸杞籽油,但其工艺水平、无溶剂残留、无污染的特性更加符合现代健康要求。研究表明,枸杞籽含油18%~22%,其中包含9种脂肪酸,亚油酸(C18:2)含 67.36%,其次是油酸(C18:1)和棕榈酸(C16),分别为7.12%、10.4%。此外,枸杞籽油中还含有维生素 A、D、E,K、Ca、Mg、Na、Fe等微量元素,磷脂、β-胡萝卜素等[4]。基于多不饱和脂肪酸在应激相关的中枢神经系统疾病方面发挥的重要作用[8],本实验以工业级枸杞籽超临界CO2提取物为研究对象,采用GC-MS方法对其脂肪酸组成进行了分析,结果发现其中含有的5个组分中以油酸(C18:1,68.32%)、亚油酸(C18:2,21.56%)及17酸(C17:0,5.82%)含量较高,此结果为LBSO后续功效学研究提供了必要的研究基础。
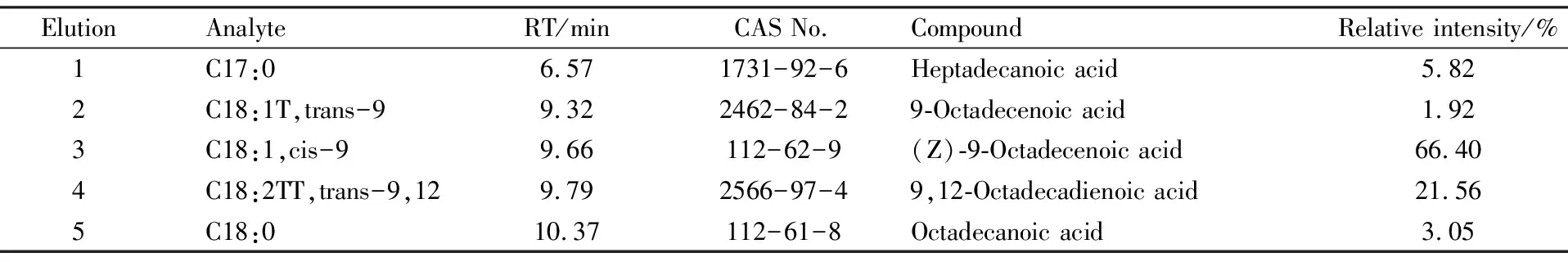
Tab 1 Identification results of fatty acids from LBSO
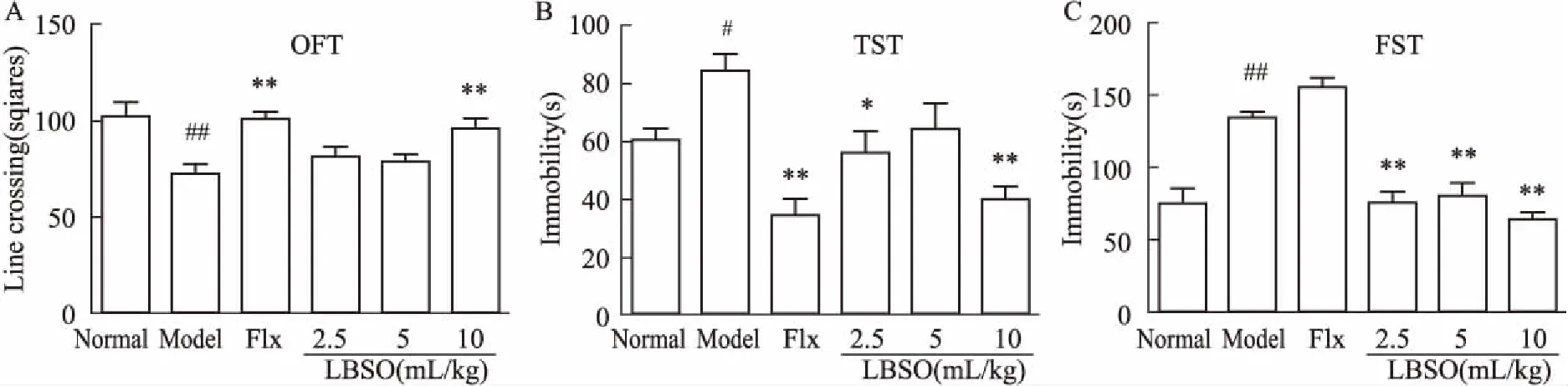
Fig 3 LBSO relieved depressive symptoms in OFT,TST and
A:LBSO increased the line crossing in the OFT; B: LBSO decreased the immobility time in the TST; C: LBSO decreased the immobility time in the FST.#P<0.05,##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel.
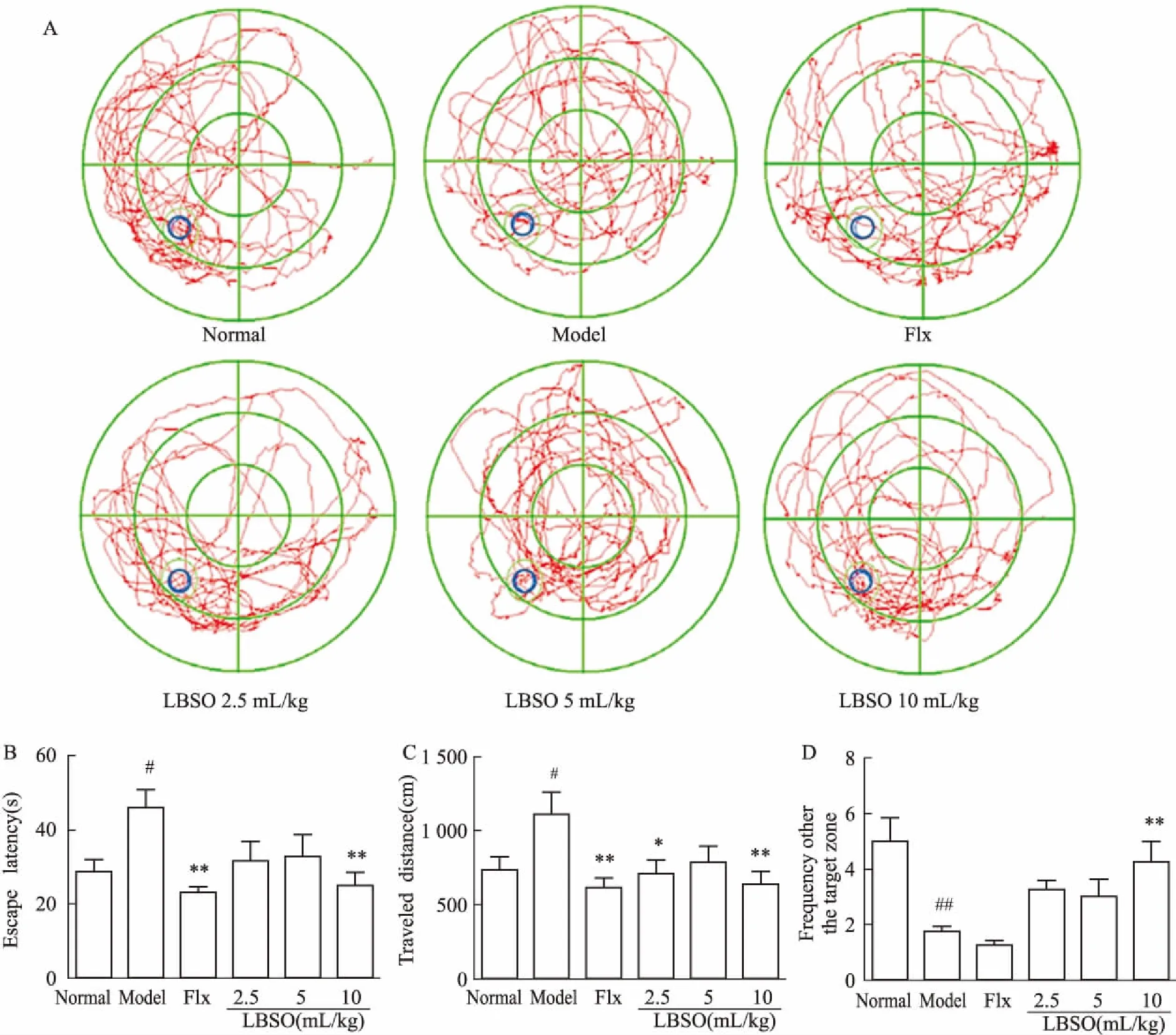
Fig 4 LBSO reversed CUS-induced spatial learning and memory damage in
A: The probe tracks of Probe Trials; B: LBSO decreased the escape latency in learning procedure; C: LBSO decreased the traveled distance in learning procedure; D: LBSO increased the frequency to enter the target zone in Probe Trials.#P<0.05,##P<0.01 vs normal;*P<0.05,**P<0.01vsmodel.
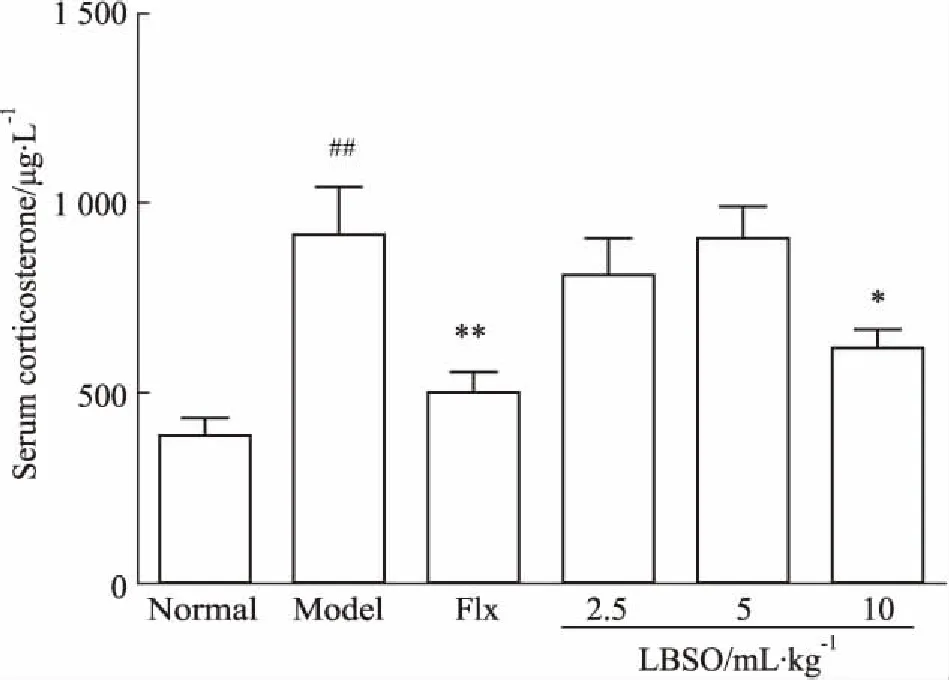
Fig 5 Effect of LBSO on serum corticosterone level
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
慢性应激与多种神经、精神系统疾病的发病密切相关。CUS动物模型是重要的慢性心理应激模型,被用于抗抑郁活性成分筛选、学习记忆研究及诸多神经精神系统疾病的机制研究[9-10]。本次实验经过28 d连续刺激,建立小鼠CUS模型,同时给予LBSO治疗,治疗后通过旷场实验、悬尾实验和强迫游泳实验,评价LBSO对CUS小鼠抑郁样行为的改善作用。结果发现,CUS小鼠的水平穿越格数明显减少,悬尾及强迫游泳不动时间明显延长,这些行为学指标说明CUS小鼠的活动度明显降低,对陌生环境的探究兴趣丧失,对绝望环境的逃脱意识明显减弱,CUS小鼠出现了抑郁样行为,模型建立成功。 LBSO干预后,CUS小鼠的行为学指标得到明显改善,表现为水平穿越格数明显增加,悬尾及强迫游泳不动时间明显缩短,提示LBSO能明显改善CUS小鼠的抑郁样行为。
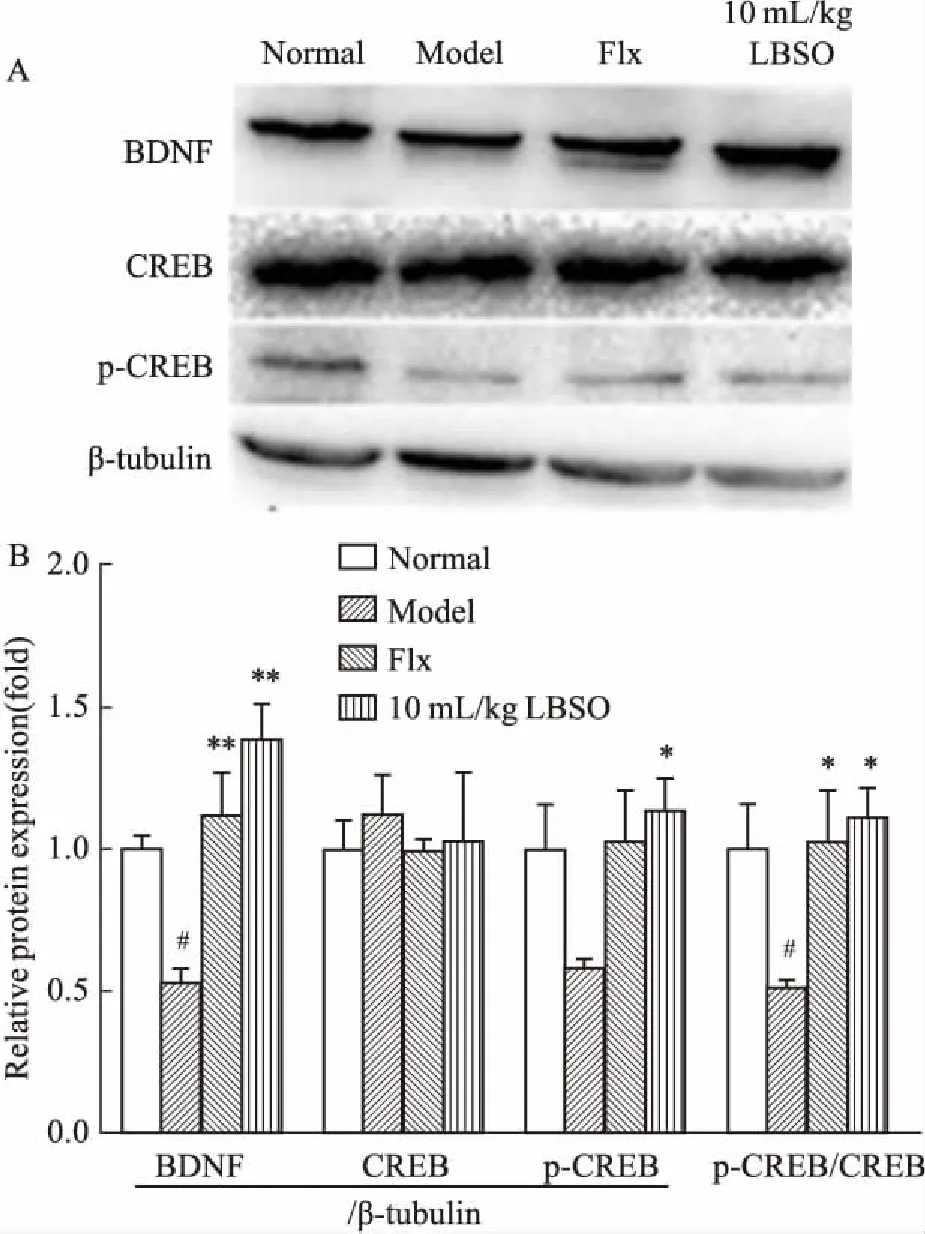
Fig 6 LBSO treatment restores the CREB-BDNF signaling
#P<0.05,##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel.
海马在情绪行为调节、学习记忆保持与调控方面发挥重要的作用,海马结构和功能损伤是慢性应激所致认知障碍、学习记忆能力降低的首要原因[11]。Morris 水迷宫是一种研究与海马功能相关的空间学习记忆模型,可较为准确地反映受试动物的空间学习记忆能力[2,7]。本研究发现,CUS小鼠在Morris 水迷宫实验中的逃逸潜伏期明显延长,平均潜伏距离增加,穿越原平台有效次数明显减少,说明CUS小鼠出现了认知及学习记忆能力障碍。LBSO干预后,能够明显缩短逃逸潜伏期和平均潜伏距离,增加CUS小鼠穿越原平台次数,提示LBSO能明显改善CUS小鼠的认知功能障碍及学习记忆能力降低。
研究表明,慢性应激动物下丘脑-垂体-肾上腺皮质轴 (hypothalamic-pituitary-adrenal axis,HPA)处于持续的激活状态,血清皮质酮升高,从而产生高皮质酮血症,抑制HPA轴负反馈调节,造成海马等部位神经元代谢与功能障碍,进而引发多种抑郁样反应[12]。本研究发现,LBSO可以明显降低由CUS诱导的血清皮质酮水平升高。提示LBSO能逆转CUS引起的HPA轴受损反馈调节,可能与其改善CUS小鼠的抑郁行为和认知功能障碍有关。
CREB介导BDNF的产生,CREB-BDNF信号通路是目前研究最为活跃的、与神经精神系统疾病相关的信号调节通路[2,13]。BDNF与应激导致的认知障碍和抑郁样行为有关,而且BDNF在慢性应激导致的抑郁症及其并发症的诊治中发挥重要作用的同时,在学习记忆过程中同样扮演重要的角色[13-14]。学者普遍认为,调节BDNF分泌的上游蛋白CREB也与应激引起的病理学改变有关[15]。CREB既是BDNF的上游信号蛋白,也是从短期记忆巩固至长期记忆的关键蛋白,并在认知障碍的发病机制中起重要作用[2,13]。本研究发现,LBSO能上调CUS小鼠海马内BDNF蛋白表达及p-CREB/CREB的比值,提示上调应激小鼠海马内CREB-BDNF信号通路关键蛋白的表达,可能是LBSO产生改善CUS小鼠的抑郁行为和认知功能障碍的关键机制。
本研究以枸杞籽超临界CO2提取物为研究对象,通过建立小鼠慢性应激模型,研究得出枸杞籽超临界CO2提取物可以改善慢性应激引起的抑郁样行为和认知障碍,并上调应激小鼠海马CREB-BDNF信号通路关键蛋白的表达。实验结果为宁夏道地药材枸杞子的经济开发提供了新的科学依据。
(致谢: 本实验在宁夏医科大学中心实验室完成,衷心感谢实验中心各位老师在整个实验过程中的悉心指导和耐心帮助。)

