两种柳珊瑚Anthogorgia caerulea和Menella kanisa的化学成分及其抗海洋污损生物附着活性研究
苏志维,易湘茜,邓家刚,郝二伟,侯小涛,米顺利,高程海
广西中医药大学海洋药物研究院 广西中药药效研究重点实验室 广西北部湾海洋中药应用技术与产品研发实验室,南宁 530200
近年来,海洋污损生物所造成的损失越来越严重,全球每年由海洋生物污损所造成的经济损失高达近百亿美元[1]。基于防污剂制成防污涂料是现行最经济可行的手段。曾经有机锡和氧化亚铜涂料是最有效的防污涂料,但是由于不易降解和三致效应造成不良生态环境影响已被国际海事组织(IMO)禁止使用。因此,当前迫切需要开发安全低毒且具选择性的环境友好型抗污损剂以取代传统的防污涂料。在海洋抗污损方面,海洋天然产物防污剂以其易降解、无毒、高效的优势倍受科研人员关注。目前,已从多种海洋动植物中获得了一系列如甾类、萜类、肽类、生物碱类等具有抗海洋生物污损附着活性的海洋天然产物[2]。
柳珊瑚中蕴含着丰富的化学成分,至今为止已发现超过800个新化合物,其中不乏抗污损活性成分[3-5]。我国北部湾海域蕴藏着丰富的柳珊瑚资源[6-8],为了充分利用我国丰富的资源,进一步寻找新的抗污损活性成分,本文对北部湾两种柳珊瑚的次生代谢产物进行了研究,并测试其抗海洋污损生物附着能力,从中发现了一个新的神经酰胺类抗污损成分。
1 材料与方法
1.1 仪器与试剂
BruckerAvance 600 型核磁共振波谱仪,TMS 为内标;waters 2695(PDA 检测器,10 mm × 250 mm,5 um,Phenomenex);N-1100 型旋转蒸发仪(上海爱朗仪器有限公司);薄层色谱硅胶与柱层析硅胶(青岛海洋化工厂);SephadexLH-20(Pharmacia Biotech.Sweden);高效液相色谱用试剂为色谱纯(德国MERCK公司),显色剂:5%硫酸乙醇溶液及5%磷钼酸乙醇溶液、其他常规试剂均为分析纯(广东光华科技股份有限公司)。
1.2 生物材料
采自广西涠洲岛海域的两种柳珊瑚,由中国科学院南海海洋研究所李秀宝博士鉴定为花柳珊瑚Anthogorgiacaerulea和小月柳珊瑚Menellakanisa,该标本现存放于广西中医药大学广西海洋药物研究院(样品编号分别为2010-GXAS-003和2010-GXAS-004)。
1.3 抗污损生物幼虫附着活性筛选
1.3.1 幼虫的培养
藤壶(Barnacleamphitrite)成虫采自广西钦州港中石化码头的柱桩上,根据Thiyagarajan等[9]方法培养,获取藤壶无节幼虫后在28 ℃下用硅藻ChaetocerosgracilisSchutt喂养,在附着测试之前,处于介虫状态的藤壶幼虫在8 ℃黑暗环境中放置 4 d。
1.3.2 抗幼虫附着活性筛选
该方法参照本实验室的操作方法进行[10],将化合物1-7分别溶解于 DMSO 溶液中,用无菌海水配制成 100、50、25、12.5、6.25、3.13、1.57 μg /mL 共7个浓度梯度。在 24 孔板的每个孔中加入 1 mL 配制好的测试样品(采用 DMSO 溶解)和15±5个游动藤壶幼虫,每个样品做 4 个平行,加含有 1 mL DMSO 的无菌海水作为阴性对照。配有测试样品的 24 孔板放于培养箱中,培养温度为 28 ℃,避光放置 24 h 后,观察实验结果。通过显微镜观察逐个记录已附着在板壁上的幼虫个数和没有附着在板壁上的幼虫个数以及已死亡的幼虫个数。统计已附着在板壁上的幼虫个数占实验用总幼虫个数的百分比,通过 EPA PROBIT ANALYSIS PROGRAM Version 1.5 软件计算受测化合物的 EC50和 LC50。
1.4 提取与分离
小月柳珊瑚Menellakanisa样品(湿重约为3.08 kg)砍碎,用乙醇-二氯甲烷(V∶V=1∶1)混合溶剂浸泡三次,每次一周,将所得粗提物加水混悬,依次用石油醚、乙酸乙酯和正丁醇各萃取三次,减压回收试剂,得乙酸乙酯萃取物7.21 g,正丁醇萃取物18.59 g。
将乙酸乙酯萃取物装柱装入正相硅胶柱层析,采用CHCl3-Me2CO系统(CHCl3∶Me2CO=1∶0.1~1∶0.8/V∶V)和CHCl3-MeOH系统(CHCl3∶MeOH=1∶0.1~0∶1/V∶V)依次梯度洗脱,根据TLC法检测结果,将成分相近的流份进行合并为11个组分C1-C11。组份C6(455mg)经半制备高效液相色谱进行分离,获得新化合物1(5.3mg)。
将正丁醇萃取物装入正相硅胶柱层析,采用CHCl3-MeOH系统(CHCl3∶MeOH=1∶0.1~0∶1/V∶V)依次梯度洗脱,根据TLC法检测结果,将成分相近的流份进行合并为8个组分D1-D8。组份D4(169 mg)经半制备高效液相色谱进行分离,获得化合物2(9 mg),组分D6(446.1 mg)先经Sephadex LH-20凝胶柱(CHCl3∶MeOH =1∶1/V∶V)分离后得流份d1~d7,d7再经半制备高效液相色谱进行分离,获得化合物3(3.3 mg),化合物4(0.7mg)。
柳珊瑚Anthogorgiacaerulea(湿重约5.0 kg)切碎,用乙醇-二氯甲烷(V∶V=1∶1)混合溶剂浸泡三次,每次一周,将所得粗提物加水混悬,依次用石油醚、乙酸乙酯和正丁醇各萃取三次,减压回收试剂,得乙酸乙酯萃取物24.82 g,正丁醇萃取物16.28 g。
将乙酸乙酯萃取物装入正相硅胶柱层析,采用CHCl3-Me2CO系统(CHCl3∶Me2CO=1∶0.1~1∶0.8)和CHCl3-MeOH系统(CHCl3∶MeOH=1∶0.1~ 0∶1/V∶V)依次梯度洗脱,根据TLC法检测结果,将成分相近的流份进行合并,初步分为8个组分J1-J8。组份J7(254.1 mg)先用HPLC分析柱确定分离条件,再用HPLC半制备柱进行分离纯化,在梯度MeOH∶H2O=90∶10/V∶V处,获得化合物5(1.1 mg)。
将正丁醇萃取物装入硅胶柱层析,采用CHCl3-MeOH系统(CHCl3∶MeOH=1∶0.1~0∶1/V∶V)依次梯度洗脱,根据TLC法检测结果,将成分相近的流份进行合并,初步分为6个组分K1-K6。组份K4(385.6mg)经HPLC半制备柱进行分离纯化,获得化合物6(1.2 mg),组份K5(72.7 mg)经半制备高效液相色谱进行分离,获得化合物7(1.9 mg)。
2 结构鉴定
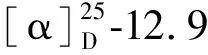
由13C NMR、DEPT谱及高分辨质谱m/z536.503 9[M+H]+,(calcd for C34H66NO3,536.503 7,m/z558.486 0[M+Na]+,(calcd for C34H65NO3Na,558.486 2)可以确定其分子是为C34H65NO3(不饱和度为3)。1H NMR谱中δH6.26(1H,brs,H-N)处有酰胺的N-H的特征吸收峰,在低场区存在4个烯质子信号:δH5.78(1H,dt,J=15.5,6.6 Hz,H-4′),5.56(1H,dt,J=15.5,6.6 Hz,H-3′),5.41(1H,dt,J=15.5,6.6 Hz,H-7′),5.38(1H,dt,J=15.5,6.6 Hz,H-6′);三个连氧质子信号:δH4.32 (1H,m,H-2′),3.95(1H,dd,J=11.3,3.6 Hz,Ha-1′′),3.69(1H,dd,J=11.3,3.6 Hz, Hb-1′′);一个连氮质子:3.90(1H, m, H-1′);在高场区有5个亚甲基质子信号:δH2.23 (2H,t,J=7.7 Hz,H-2),2.13(2H,q,J=7.2,6.7 Hz,H-6),2.07(2H,q,J=7.2, 6.7 Hz,H-7),1.96(2H,q,J=7.0,Hz,H-10),1.63(2H,m,H-3);19个无支链脂肪链质子信号:δH1.34-1.24 (38H, m, H-4, 5, 8, 9, 11~15, 5′, 8′~16′);以及两个端甲基质子信号:0.87 (6H, t,J=6.6 Hz, H-17′及H-16),这表明了此化合物有可能为神经酰胺类化合物。根据1H NMR、13C NMR和DEPT及HSQC谱对化合物1的C、H分别进行相应的归属(见表1),低场区δC174.1 (C-1)表明是一个酰胺基,同时给出4个烯碳信号:δC133.7 (C-4′), 131.5 (C-3′), 129.3 (C-7′), 129.1 (C-6′),2个连氧碳信号:δC74.8 (C-2′), 62.6 (C-1′′),以及1个连氮碳信号:δC54.56 (C-1′)。以上信号提示化合物1与N-(1-羟甲基-2-羟基)4, 8-二烯-十七烷基-十六脂肪酸酰胺结构非常相近[11]。仔细比较其NMR数据,发现化合物1的C-6′, 7′的化学位移130.6 (C-7′), 130.4 (C-6′)向低场移,表明双键位置在C-6′, 7′位。这一推论也被观测到的H-3′/C-2′,C-4′,H-4′/C-2′,C-6′,H-5′/C-4′,C-6′,H-7′/C-6′,H-8′/C-6′的HMBC相关所证实。1H-1H COSY图谱的信号可以进一步证实分别存在-CH2-(CH2)13-CH3及-CH-(CH)4-CH2-(CH)2-(CH2)9-CH3两个结构片段单独的自旋系统。在NOE图谱中,H-3′分别H-2′, 1′, 5′有相关信号,H-7′与H-5′,9′有相关信号说明C-3′, 4′,C-6′, 7′构成的双键均为反式的,同时H-2和H-1′′的NOESY有相关,表示它们位于同侧,说明1′-CH2OH和2′-OH为R构型。在上述分析的基础上,确定化合物1的结构为N-(1-羟甲基-2-羟基) 3, 6-二烯-十七烷基-十六脂肪酸酰胺(N-[(1-hydroxymethyl)-2-hydroxy-3,6-heptadecadienyl]-hexadecanamide)。化合物1的核磁数据及相关详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
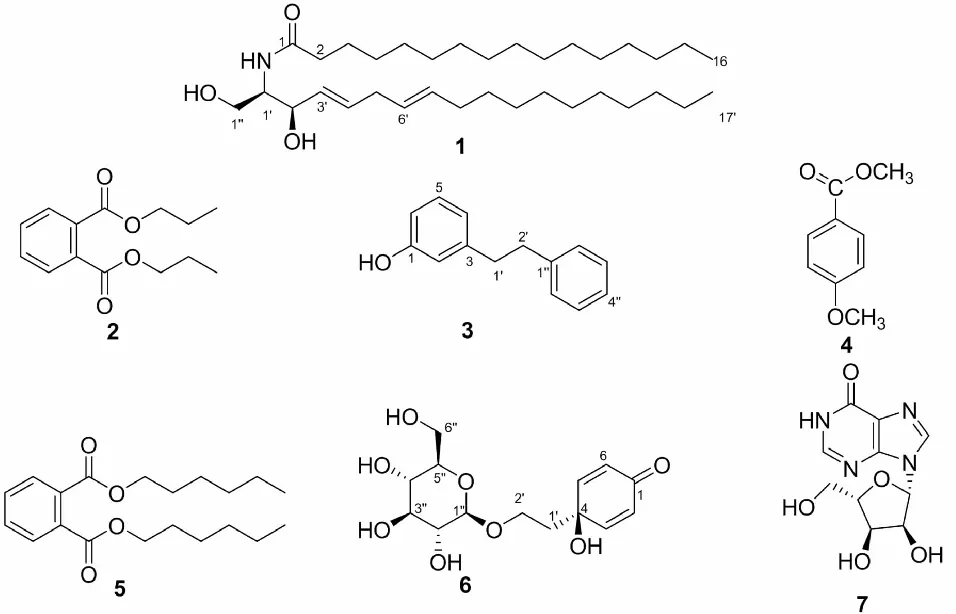
图1 化合物1~7的结构Fig.1 Structures of compounds 1-7

图2 化合物1的1H-1H COSY、NOESY及HMBC主要相关信号Fig.2 Key correlations of 1H-1H COSY、NOESY and HMBC for Compound 1
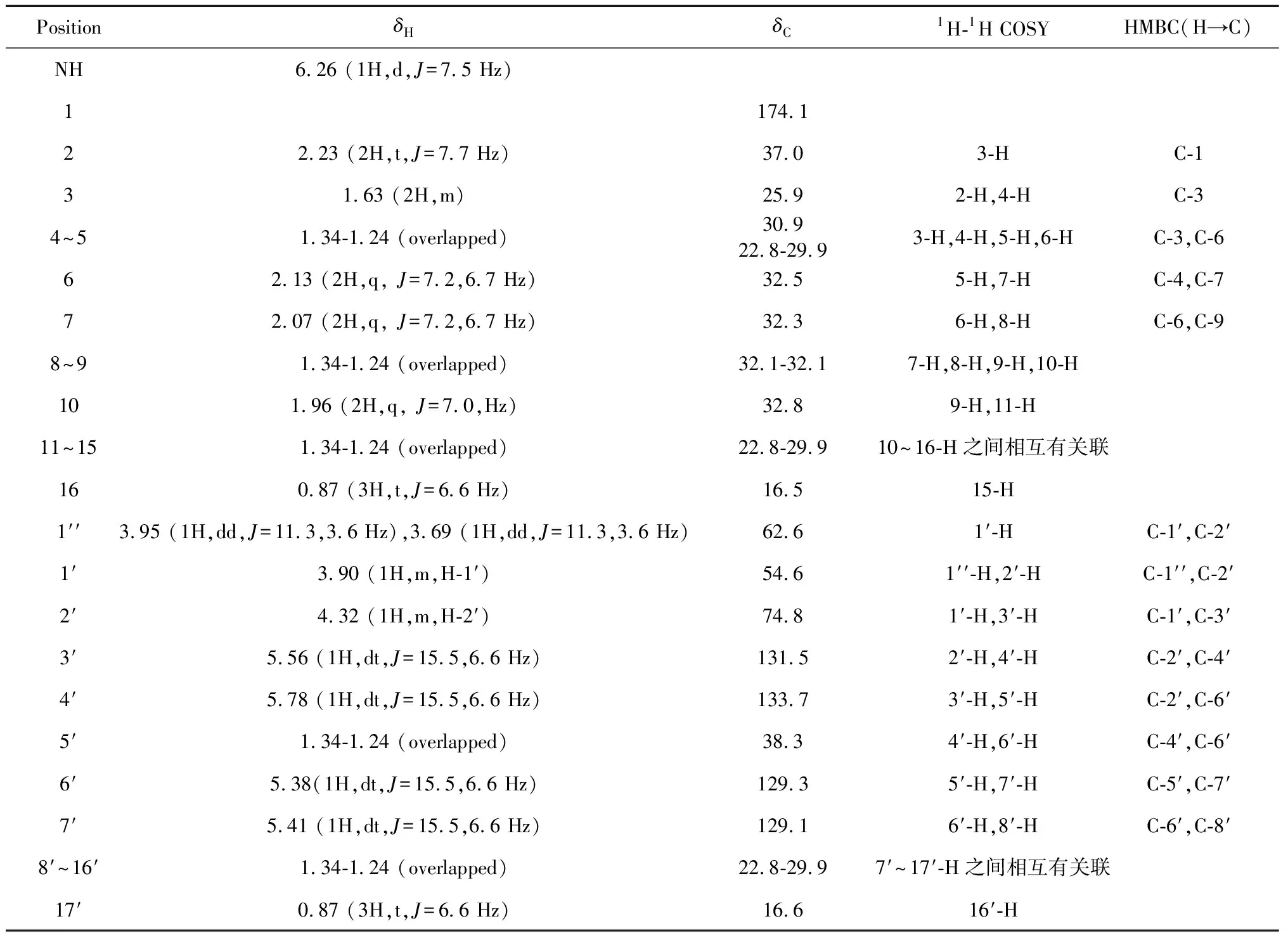
表1 化合物1的1H、13C谱及1H-1H COSY和HMBC的主要相关信号Table 1 1H,13C NMR data and key 1H-1H COSY,HMBC correlations of 1
化合物2黄色粉末,溶于甲醇;C14H18O4, ESI-MS:m/z251 [M+H]+;1H NMR (600 MHz,MeOD)δH:7.73 (2H, dd,J=6.0,3.6 Hz,H-3,6),7.62(2H,dd,J=6.0, 3.6 Hz,H-4,5),4.07(2H,t,J=6.6 Hz,H-1′,1′′),2.01(2H,m,H-2′,2′′),0.99(6H, t,J=6.6 Hz,H-3′,3′′);13C NMR(150 MHz,MeOD)δC:166.8(CO),131.9(C-1,2), 130.4(C-4,5),129.3(C-3,6),64.9(C-1′,1′′),31.3(C-2′,2′′),19.3(C-3′,3′′)。化合物2核磁数据与文献[12]所报道的邻苯二甲酸二丙酯的核磁数据基本一致,因此该化合物被鉴定为邻苯二甲酸二丙酯(Dipropyl phthalate)
化合物3无色结晶,溶于甲醇;C14H14O,ESI-MS:m/z199 [M+H]+;1H NMR(600 MHz,MeOD)δH:7.45(2H,m,H-3′′,5′′),7.40(2H,m,H-2′′,6′′),7.34 (1H, d,J= 7.8 Hz,H-4′′),7.28(1H,t,J= 1.8 Hz,H-5),7.27(1H,t,J= 2.4 Hz,H-6),7.16(2H,m,H-2,4),3.16(4H,m,H-1′,2′);13C NMR(150 MHz,MeOD)δC:156.8(C-1),143.9 (C-3),143.1(C-1′′),136.6(C-5),133.6(C-3′′,5′′),131.0(C-2′′,6′′),129.4(C-4′′),128.9(C-4),127.0(C-2),121.5(C-6),40.7(C-1′),33.3(C-2′)。化合物3核磁数据与文献[13]所报道的3-(2-苯乙基)苯酚的核磁数据基本一致,因此该化合物被鉴定为3-(2-苯乙基)苯酚(3-(2-phenylethyl) Phenol)。
化合物4无色结晶,溶于甲醇;C9H10O3, ESI-MS:m/z166 [M]+;1H NMR(600 MHz,MeOD)δH:7.07(2H,d,J=8.4 Hz,H-2,6),6.71(2H,m,H-3,5),3.66(3H,s,4-OCH3), 3.53(3H,s,OCH3);13C NMR(150 MHz,MeOD)δC:173.3(CO),156.3(C-4),130.0(C-2,6),125.0(C-1),115.0(C-3,5),55.2(4-OCH3),51.1(OCH3)。化合物4核磁数据与文献[14]所报道的对甲氧基苯甲酸甲酯的核磁数据基本一致,因此该化合物被鉴定为对甲氧基苯甲酸甲酯 (Methyl ester ofp-methoxybenzoicacid)。
化合物5黄色粉末,溶于氯仿;分子式 C20H30O4,ESI-MS:m/z335 [M+H]+;1H NMR (600 MHz,CDCl3)δH:8.19(2H,dd,J=5.6,3.6Hz,H-3,6),7.71(2H,dd,J=5.6, 3.6Hz, H-4,5),4.22(4H,m,H-1′,1′′),1.68(4H,m,H-2′,2′′),1.31(8H,m,H-3′,4′,3′′,4′),1.25(10H,m,H-5′,5′′),0.91(6H,m,H-6′,6′′);13C NMR(150 MHz,CDCl3)δC:167.1(CO),133.5(C-4,5),131.6(C-1,2),127.5(C-3,6),65.4(C-1′,1′′),32.6(C-2′,2′′),31.2(C-4′,4′′),29.7(C-3′,3′′),24.5(C-5′,5′′),15.0(C-6′,6′′)。化合物5核磁数据与文献[15]所报道的邻苯二甲酸二己酯基本一致,因此该化合物被鉴定为邻苯二甲酸二己酯(Dihexyl phthalate)。
化合物6淡黄色粉末,溶于DMSO;分子式C14H20O8,ESI-MS:m/z317.22 [M+H]+;1H NMR(600 MHz,DMSO)δH:7.03(2H,J=9.0 Hz,H-3,5),6.96(2H,d,J=9.0 Hz, H-2,6),4.17(1H,d,J=7.6 Hz,H-1′′),4.06(1H,s,H-5′′),3.90-3.78(2H,m,H-2′′, 3′′),3.61-3.45(4H,m,H-4′′,5′′,6′′),3.05(2H,m,H-2′),1.90(2H,m,H-1′);13C NMR(150 MHz,DMSO)δC:185.5(C-1),153.5(C-3,5),126.5(C-2,6),102.9(C-1′′),76.9(C-5′′),76.8(C-2′′),73.5(C-4′′),70.1(C-4),67.5(C-2′),64.0 (C-6′′),42.2(C-1′)。化合物6核磁数据与文献[16]所报道的梾木甙的核磁数据基本一致,因此该化合物被鉴定为梾木甙(Cornoside)
化合物7白色粉末,溶于DMSO;分子式C10H12N4O5,ESI-MS:m/z269 M+H]+;1H NMR (600 MHz,DMSO)δH:8.29(1H,s,H-2),8.04(1H,s,H-8),5.85(1H,d,J=6.0, H-1′),5.25(1H,m,3′-OH),4.49(1H,s,H-2′),4.11(1H,m,H-3′),3.94(1H,m, H-4′),3.65(1H,m,H-5′);13C NMR(150 MHz,DMSO)δC:156.3(C-6),148.3(C-4), 146.9(C-8),138.7(C-2),124.5(C-5),87.6(C-1′),85.8(C-4′),74.1(C-2′),70.4(C-3′),61.4(C-5′)。化合物7核磁数据与文献[17]所报道的肌苷的核磁数据基本一致,因此该化合物被鉴定为次黄嘌呤核苷(Inosine)。
3 抗污损生物附着活性研究
通过测试两种柳珊瑚中的化学成分1~7抗藤壶幼虫附着活性发现,除化合物3,7外均表现潜在的抗海洋污损生物藤壶幼虫附着活性,其EC50值均低于25 μg/mL(美国海军研究中心认定能做海洋抗污损剂最低标准),且LC50(半数致死浓度)也均高于 100 μg/mL (表2)。
表2化合物1~7的抗藤壶幼虫附着活性
Table 2 Anti-larval settlement activity of compounds1-7againstB.amphitrite

化合物CompoundEC50(μg/mL)LC50(μg/mL)18.72±0.72>100212.34±0.75>1003NAND415.33±0.83>100518.74±1.14>20066.89±1.22>1007NA>100
注:NA表示其EC50大于25 μg mL-1,无抗污损活性,ND表示由于化合物质量太少或溶解度太小无法测试。
Note:NA indicated the EC50is more than 25 μg mL-1,no anti fouling activity,ND indicated the compound quality or solubility is too low to carry out the experiment.
4 结论
通过现代各种分离鉴定方法,从北部湾两种柳珊瑚Anthogorgiacaerulea和Menellakanisa提取物中共分离鉴定了7个化合物,并采用典型海洋污损生物藤壶的幼虫筛选模型,测试了化合物1~7的抗海洋污损生物附着能力,发现除化合物3,7外均显示出具有开发成海洋抗污剂的潜力(EC50< 25 μg /mL),其中以化合物6的活性最好,新化合物1的活性次之,其抗藤壶幼虫附着EC50分别为6.89,8.72 μg/mL。

