锁阳原花青素提取方法及抗氧化和抗糖基化研究
张喜峰,陈雨迪,崔 晶,程雯慧
1河西学院农业与生物技术学院;2甘肃省河西走廊特色资源利用重点实验室,张掖 734000
锁阳(CynomoriumsongaricumRupr.)为锁阳科、锁阳属多年生肉质寄生草本,国内主要分布于新疆、甘肃、内蒙、宁夏等地;其含有多糖、皂苷、原花青素、木脂素和生物碱等多种活性物质[1-3];原花青素作为黄酮类化合物一种,由于具有功能强大的活性和保健功效,已引起国内外研究人员广泛关注,抗氧化和抗糖基化是其最重要功能活性[4,5];国内外研究表明,原花青素可通过清除自由基、螯合金属离子、抑制蛋白质结构修饰等多种作用抑制晚期糖基化终产物(AGEs)形成[6,7]。目前,对锁阳原花青素相关研究主要侧重离体化学研究[8];而采用不同提取方法对锁阳原花青素生物活性影响的相关研究较少,尤其对抗糖基化的能力缺乏基础研究。
活性氧和活性氮自由基可氧化损伤生物体内生物大分子,从而诱发癌症、衰老、动脉粥样硬化和糖尿病并发症等。在氧气和过渡金属的存在下,与高血糖有关的许多生化途径通过自氧化产生的自由基损伤蛋白质、脂类和核酸,此过程为糖基化过程,即游离氨基与还原糖的醛基之间发生非酶促反应,在高血糖的生理环境中,导致AGEs形成加速[9]。AGEs和氧化应激的过量积累可引起多种细胞变化,导致宏观和微血管并发症,如动脉粥样硬化、糖尿病视网膜病变、肾病和神经病变等[10]。
据报道,抗氧化剂和自由基清除剂抑制糖基化过程[11]。抗氧化剂可能是预防糖尿病并发症的有效策略之一[12]。研究表明,具有抗氧化和抗糖基化特性的化合物在治疗糖尿病方面更有效[13]。因此,寻找有效抑制AGEs形成的膳食植物和水果已成为研究热点之一。
因此,本试验采用甘肃瓜州8月份采收的锁阳为材料,研究不同提取方法对锁阳原花青素得率的影响,并对其体外抗氧化、抗糖基化活性进行了比较研究,为锁阳原花青素的提取和天然糖基化抑制剂的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
锁阳由甘肃微藻工程技术研究中心提供,儿茶素标准品(成都德思特生物技术有限公司)。
AE124电子天平(上海恒平科学仪器有限公司);JPT-10型架盘天平(常熟市衡器厂);DD-5M立式大容量离心机(湖南凯达科学仪器有限公司);XO-SM50超声波微波组合反应系统(南京先欧生物科技有限公司);JRA-6数显磁力搅拌水浴锅(金坛市杰瑞尔电器有限公司)。
1.2 试验方法
1.2.1 提取方法
超声波提取法:准确称取锁阳粉末2 g,按照一定固液比加入体积分数为70%乙醇,在一定温度下超声处理2~10 min,过滤后,得上清液;滤渣按照上述步骤重复一次,合并上清液。
乙醇/硫酸铵双水相提取法:准确称取锁阳粉末2 g,按照一定固液比加入30%无水乙醇(w/w)20%硫酸铵(w/w),在一定温度下加热处理20~60 min,过滤,静置分层后,收集上层提取液。滤渣按照上述步骤重复一次,合并上清液。
水提法:准确称取锁阳粉末2 g,按照一定固液比加入蒸馏水,在恒温水浴中提取50~90 min,过滤,收集滤液;滤渣按照上述步骤重复一次,合并上清液。
微波提取法:准确称取锁阳粉末2 g,按一定料液比加入体积分数为70%乙醇,微波处理0~12 min,过滤,收集滤液;滤渣按照上述步骤重复一次,合并上清液。
酶解法:准确称取锁阳粉末2 g,加入一定量果胶酶,在最适pH条件下,在一定温度下酶解30~70 min,高温将酶灭活后,过滤,收集滤液;滤渣按照上述步骤重复一次,合并上清液。
1.2.2 原花青素含量的测定及得率计算
采用香草醛-浓盐酸法测定原花青素含量[14];将上述方法制备的原花青素稀释一定倍数后各取0.50 mL,加入质量分数为4%香草醛3 mL,再加入浓HCl 1.5 mL,避光反应30 min后,在500 nm波长处测其吸光值;以0.5 mL蒸馏水代替上清液,重复上述操作,设置空白对照。根据样液测定的吸光值,计算提取液的浓度。
原花青素得率(%)=
1.2.3 锁阳原花青素提取工艺优化
以单因素试验为基础,对超声波提取法以料液比、超声功率、提取温度、提取时间为考察因素,进行L9(34)正交设计试验;
乙醇/硫酸铵双水相萃取法:以料液比、提取温度、提取时间为考察因素,进行L9(33)正交设计试验。
水提法:以料液比、提取温度、提取时间为考察因素,进行L9(33)正交设计试验;
微波法:以料液比、微波功率、提取时间为考察因素,进行L9(33)正交设计试验;
酶解法:以料液比、加酶量、提取温度、提取时间为考察因素,进行L9(34)正交设计试验;
1.2.4 原花青素体外抗氧化评价
DPPH·清除能力测定:参考Köksal等[15]方法略有修改,将上述不同提取方法制备的2 mL原花青素溶液(0.1~0.5 mg/mL)与2 mL浓度为0.15 mmol/L DPPH混匀后,黑暗环境下静置30 min,测定其在517 nm处吸光值标记为As;将2 mL原花青素溶液分别与2 mL无水乙醇充分混匀后,暗环境下静置30 min,将其在517 nm处吸光值标记为Ab;将2 mL无水乙醇与2 mL DPPH充分混匀后,暗环境下静置30 min,将其在517 nm处吸光值标记为A0;采用同浓度Vc代替原花青素溶液作阳性对照,按照以下公式计算清除率。

表2 乙醇/硫酸铵双水相提取法正交试验因素水平表Table 2 The factors and levels table of orthogonal test with ethanol-ammonium sulfate two-phase extraction
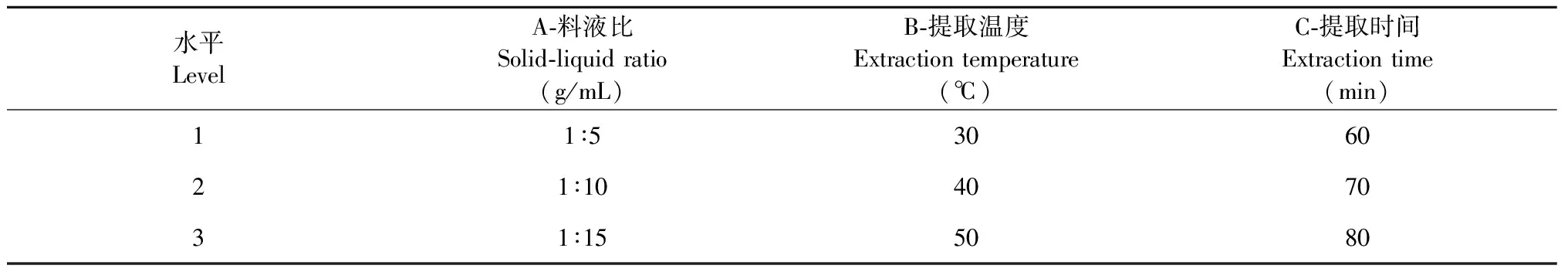
表3 水提法正交试验因素水平表Table 3 The factor and levels table of orthogonal test with hot water extraction method

表4 微波法正交试验因素水平表Table 4 The factors and levels table of orthogonal test with MAE method

表5 酶解法正交试验因素水平表Table 5 The factors and levels table of orthogonal test with enzymatic extraction method
·OH清除能力测定:将1 mL FeSO4溶液(10 mmol/L)、1 mL水杨酸(6 mmol/L)、1 mL原花青素溶液(0.1~0.5 mg/mL)、1 mL H2O2(20 mmol/L)充分混匀后,37 ℃恒温水浴30 min,在510 nm波长处测吸光度Ai;将1 mL FeSO4溶液(10 mmol/L)、1 mL水杨酸(6 mmol/L)、1 mL原花青素溶液、1 mL H2O充分混匀后,37 ℃恒温水浴30 min,在510 nm波长处测吸光度Aj;将1 mL FeSO4溶液(10 mmol/L)、1 mL水杨酸(6 mmol/L)、1 mL H2O、1 mL H2O2(20 mmol/L)充分混匀后,37 ℃恒温水浴30 min,在510 nm波长处测吸光度A0;采用同浓度Vc代替原花青素溶液作阳性对照,按下述公式计算清除。
1.2.5 原花青素抗糖基化能力评价
1.2.5.1BSA-葡萄糖模拟体系的建立
采用BSA-葡萄糖模拟体系评价蛋白质非酶反应过程中AGEs形成情况[16],取浓度为0.15 mol/L的BSA溶液和葡萄糖溶液各1 mL,加入1 mL原花青素溶液(0.1~0.5 mg/mL)充分混匀,在温度为37 ℃条件下水浴6天后,在λex/λem=370 nm/440 nm测定不同浓度下的荧光值,采用同浓度的氨基胍(AG)代替原花青素作为阳性对照。以不添加原花青素但水浴6天的BSA-葡萄糖模拟体系为对照组;不添加原花青素也不水浴的BSA-葡萄糖模拟体系为空白组。按以下公式计算锁阳原花青素对BSA-葡萄糖模拟体系AGEs相对抑制率。
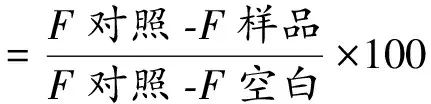
式中F样品为加入锁阳原花青素提取液且水浴的反应液的荧光值;F对照为不添加原花青素但水浴的BSA-葡萄糖模拟体系的荧光值;F空白为不添加原花青素也不水浴的BSA-葡萄糖模拟体系的荧光值。
1.2.5.2 BSA-丙醛酸模拟体系的建立
丙醛酸作为非酶糖基化中间产物,可利用BSA-丙醛酸模拟体系评价蛋白质非酶反应过程中间产物形成;取浓度为0.15 mol/L的BSA溶液和0.06 mol/L丙醛酸溶液各1 mL,加入1 mL原花青素溶液(0.1~0.5 mg/mL)充分混匀,在温度为37 ℃条件下水浴6天后,在λex/λem=370 nm/440 nm测定不同浓度下的荧光值;采用同浓度的AG代替原花青素作为阳性对照。以不添加原花青素但水浴6天的BSA-丙醛酸模拟体系为对照组;不添加原花青素也不水浴的BSA-丙醛酸模拟体系为空白组。按1.2.5.1公式计算锁阳原花青素对BSA-丙醛酸模拟体系AGEs相对抑制率。
1.3 数据处理
正交试验数据分析用SPSS 19.0软件,制图采用Origine 9.0软件。原花青素与抗氧化、抗糖基化相关性分析采用Pearson法。
2 结果与讨论
2.1 不同提取方法对锁阳原花青素得率的影响
2.1.1 超声波提取法
根据单因素试验确定原花青素提取适宜条件为料液比1∶10(g/mL)、超声功率90 W、提取温度50 ℃、提取时间15 min;在此基础上,进行正交试验设计,结果如表6所示。
由表6极差分析可知,影响锁阳原花青素得率的4个因素依次为料液比>提取时间>提取温度>超声功率。依据各个因素的K值大小可知,超声法提取锁阳原花青素的最佳工艺为A2B3C1D2,即料液比 1∶10(g/mL)、超声功率100 W、提取温度30 ℃、提取时间15 min。

表6 超声法提取锁阳原花青素正交试验设计与结果Table 6 The orthogonal experimental design and results of Cynomorium songaricum Rupr.procyanidins with UAE method
续表6 Continued table 6

编号No.ABCD原花青素得率Yield of procyanidins(%)6231212.90731327.53832137.85933216.37K17.728.579.157.34K211.137.838.199.76K37.258.657.739.01R4.430.821.421.70
注:表中K表示每个因素对应水平实验结果均值;R表示极差,每列最大K值与最小K值得差值,下同。
Note:K represent the average values of experimental results;R refers to the results of extreme analysis,the same as in the following tables.
2.1.2 乙醇/硫酸铵双水相提取法
由表7极差分析可知,乙醇/硫酸铵双水相提取法中影响锁阳原花青素得率3个因素的主次关系为:料液比>提取温度>提取时间,根据K值大小,确定最优化工艺为A2B2C3,即料液比1∶10(g/mL)、提取温度50 ℃、提取时间50 min。
表7乙醇/硫酸铵双水相提取法提取锁阳原花青素正交试验设计与结果
Table 7 Orthogonal experimental design and results ofCynomoriumsongaricumRupr.procyanidins with ethanol-ammonium sulfate two-phase extraction method

编号No.ABC原花青素得率Yield of procyanidins(%)111111.12212211.54313311.89421211.62522311.99623110.9573139.0183219.9593328.20K111.5210.5810.67K211.5211.1710.43K39.0510.3311.96R2.430.840.54
2.1.3 水提法
由表8极差分析可知,影响水提法提取锁阳原花青的主次顺序为料液比>提取时间>提取温度,是影响水提法制备锁阳原花青素的主次因素,其最佳工艺为A2B2C1,其最佳工艺原花青素得率为9.11%。因此,水提法提取锁阳原花青素的最佳工艺,即为料液比1∶10(g/mL)、提取温度40 ℃、提取时间60 min。
2.1.4 微波法
以微波法提取锁阳原花青素单因素试验确定条件为基础,以原花青素得率为评价指标,由表9极差分析可知,微波法提取锁阳原花青素的3个因素,影响大小为:料液比>提取时间>微波功率。各个因素中K值大小可知,其最优化工艺为A3B2C3,对该工艺进行验证,得到微波法提取锁阳原花青素得率平均值为15.31%。
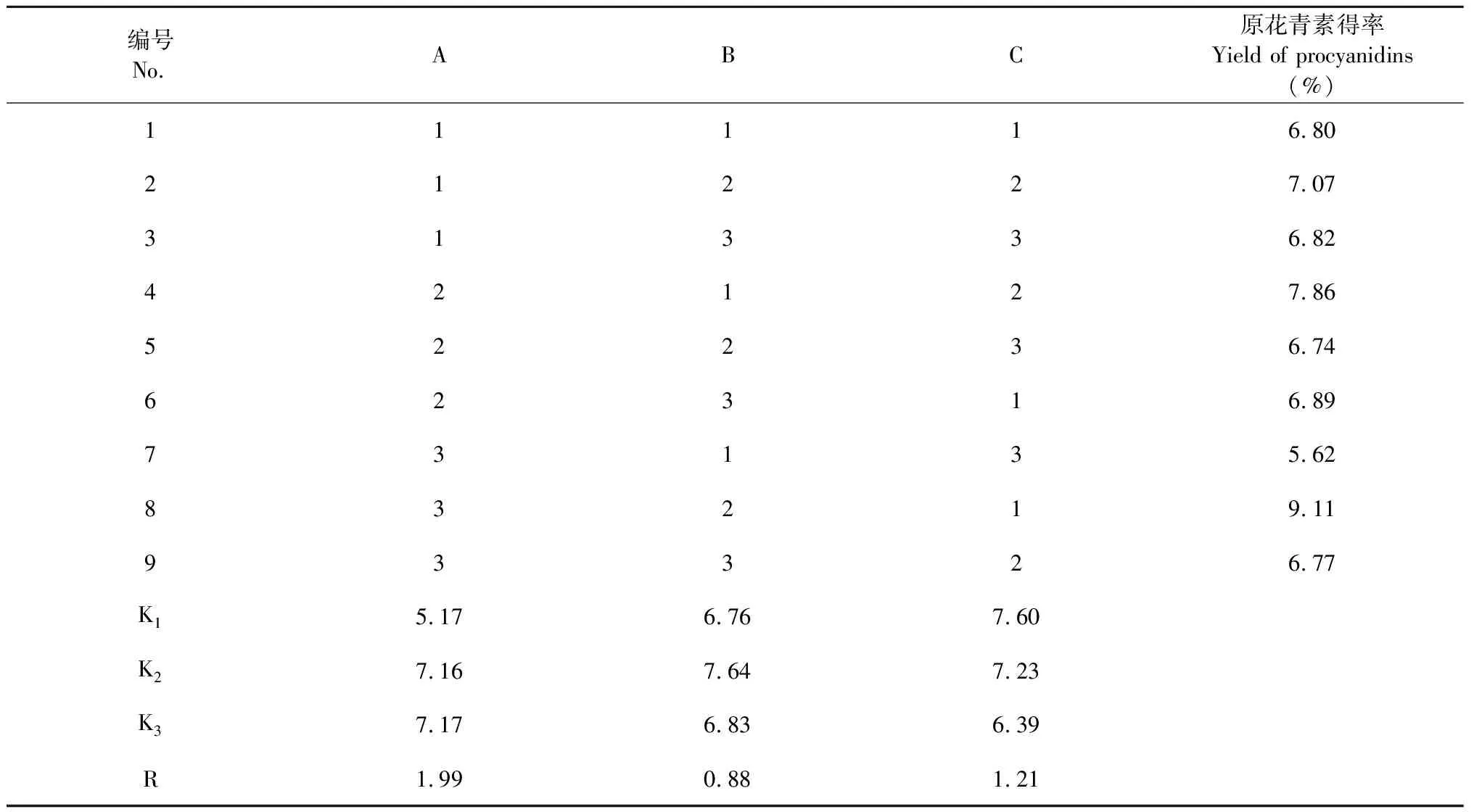
表8 水提法提取锁阳原花青素正交试验设计与结果Table 8 Orthogonal experimental design and results of Cynomorium songaricum Rupr.procyanidins with hot water extraction method

表9 微波法提取锁阳原花青素正交试验设计与结果Table 9 Orthogonal experimental design and results of Cynomorium songaricum Rupr.procyanidins with MAE method
2.1.5 酶法
由极差分析可知,酶法提取中影响锁阳原花青素提取的4个因素,其主次顺序为:料液比>温度>提取时间>酶量。得出其最优工艺为A2B2C2D2,即酶法提取锁阳原花青素的最佳工艺为:料液比1∶10(g/mL)、加酶量5%、温度50 ℃、提取时间50 min。锁阳原花青素平均得率为13.79%(表10)。

表10 酶解法提取锁阳原花青素正交试验设计与结果Table 10 Orthogonal experimental design and results of Cynomorium songaricum Rupr.procyanidins with enzymatic extraction method
2.1.6 不同提取方法所得原花青素含量的比较
从表11可以看出,与水提法相比,超声波法、乙醇/硫酸铵双水相提取法、微波法、酶法均显著提高锁阳原花青素得率(P<0.05),均有效减少了提取时间。其中微波法提取效果最好,其得率最高为(15.31±1.2)%;与水提法相比,其得率提高了122.2%,且提取时间仅为19 min;这是由于水分子能够吸收微波能量,促使植物细胞膨胀,有效增加提取溶剂和植物材料的接触面积;同时,增加植物组织内部和溶剂间浓度梯度,传质驱动力显著增强,有利于原花青素的提取;超声波法提取原花青素,使其得率提高88.53%,提取时间仅为水提法的1/4。其原因是利用超声波的空穴作用、机械作用和热效应,促进植物组织细胞壁的破碎,使原花青素快速释放,缩短了时间[17]。乙醇/硫酸铵双水相提取法使原花青素得率提高74.02%,提取时间为100 min。这是因为该体系采用有机溶剂结合盐形成两相体系,对原花青素进行提取,利用有机溶剂对植物细胞穿透作用强的特点,在未加其它辅助方法,提取时间相对较长;但此法可有效实现目标产物和杂质的有效分离;酶解法提取,采用较温和的生物酶法,对细胞壁进行水解,促使原花青素有效释放;采用果胶酶对细胞壁进行了部分裂解,使原花青素缓慢释放,所以提取时间相对较长。综上所述,微波法是提取锁阳原花青素的最优方法,且提取时间大大缩短。

表11 不同提取方法所得锁阳原花青素含量的比较Table 11 Effects of extract methods on the yield of Cynomorium songaricum Rupr.procyanidins
2.2 不同提取方法对原花青素体外抗氧化活性的影响
2.2.1 不同提取方法对原花青素DPPH·清除能力效果的影响
不同方法提取的原花青素对DPPH·清除能力的结果如图1所示。不同方法提取的原花青素对DPPH·清除能力随着原花青素浓度的增加呈逐渐上升趋势,清除能力大小依次为微波法>酶解法>超声波法>乙醇硫酸铵双水相提取法>水提法。但上述五种提取方法所得原花青素对DPPH·自由基的清除能力均低于Vc;曲线回归方程计算可知,微波法、酶解法、超声波法、乙醇硫酸铵双水相提取法、水提法得到的原花青素对DPPH·的半数清除浓度IC50分别为0.224、0.271、0.314、0.356、0.438 mg/mL。说明原花青素体外抗氧化活性与其提取方法密切相关,其可能影响原花青素聚合度。

图1 不同提取方法对原花青素的DPPH·清除能力(A-超声波法;B-乙醇/硫酸铵双水相提取法;C-水提法;D-微波法;E-酶解法;F-Vc)Fig.1 DPPH· radicals scavenging activity at different concentrations(A represents UAE,B represents Ethanol-ammonium sulfate two-phase extraction,C represents water extraction,D represents MAE,E represents enzymatic hydrolysis,F represents ascorbic acid)
2.2.2 不同提取方法对原花青素·OH清除能力效果的影响
羟自由基作为活性氧(ROS)之一,在正常机体代谢中处于稳定的状态;当防御体系受到破坏或者产生过量自由基时,氧化应激就会发生;芬顿反应可产生羟自由基,其与水杨酸反应后,生成在510 nm处有特殊吸收的化合物;天然抗氧化剂可清除ROS或阻止ROS形成。由图2可知,Vc比锁阳原花青素具有更强的清除·OH能力;原花青素对·OH清除作用呈现浓度-依赖性;微波法提取的原花青素清除·OH基能力最强,酶法次之,乙醇法和水提法相近,超声法最弱。曲线回归方程计算可知,其半数清除浓度IC50分别为0.236、0.316、0.333、0.356、0.411 mg/mL。此结果与2.3.1均表明微波法制备的原花青素的抗氧化能力最好,具有适合聚合度,有利于其抗氧化能力的保持。
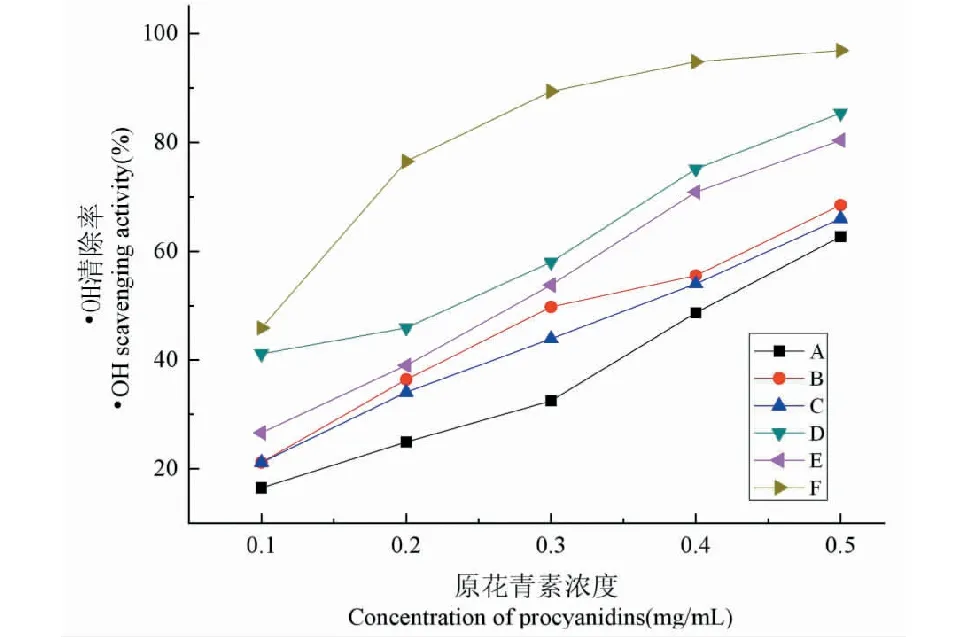
图2 不同提取方法所得锁阳原花青素的·OH清除能力(A-超声波法;B-乙醇/硫酸铵双水相提取法;C-水提法;D-微波法;E-酶解法;F-Vc)Fig.2 Scavenging effect of Cynomorium songaricum Rupr.procyanidins on hydroxyl radicals( A represents UAE,B represents Ethanol-ammonium sulfate two-phase extraction,C represents water extraction,D represents MAE,E represents enzymatic hydrolysis,F represents ascorbic acid)
2.3 不同提取方法对原花青素抗糖基化活性的影响
在非酶促条件下,蛋白质中游离氨基与还原糖羰基之间会形成AGEs产物,该产物在λex/λem=370 nm/440 nm所测定的荧光值,可反映AGEs形成水平。由图3A可知,在BSA-葡萄糖模拟体系中,比较了5种提取方法所获得的原花青素对糖基化抑制效果的影响,微波法、乙醇/硫酸铵双水相提取法、酶法制备的原花青素具有较高的糖基化抑制率,且高于阳性对照组(AG);在0.1~0.3 mg/mL范围内,超声波法提取的原花青素相比阳性对照,具有较高的糖基化抑制率;当浓度为0.3~0.5 mg/mL时,超声波法与阳性对照对糖基化抑制率曲线基本重合;水提法制备的原花青素对糖基化抑制效果最弱,且低于阳性对照。图3B研究了不同方法制备的原花青素对BSA-丙醛酸模拟体系形成的糖基化产物抑制效果,在原花青素质量浓度为0.1~0.5 mg/mL范围内,微波法制备的原花青素具有最高的抑制率,阳性对照AG和乙醇/硫酸铵双水相提取法制备的原花青素具有相同的抑制效果;与阳性对照相比,酶法、微波法和水提法对糖基化产物抑制效果较小;说明不同方法制备的原花青素均对糖基化产物具有一定程度的抑制效果,可知原花青素的抑制不仅作用于糖基化产物形成的中期,且在糖基化产物形成各个阶段均有一定抑制作用。

图3 不同方法制备原花青素及阳性对照组AG在BSA-葡萄糖(A)和BSA-MGO模拟反应体系(B)下的糖基化抑制率(A-超声波法;B-乙醇/硫酸铵双水相提取法;C-水提法;D-微波法;E-酶解法;F-AG)Fig.3 Glycation inhibition rates of aminoguanidine (AG) and different extraction methods for extracting proanthocyanidins from Cynomorium songaricum Rupr.in BSA-Glucose model (A) and BSA-MGO model (B)(A represents UAE,B represents Ethanol-ammonium sulfate two-phase extraction,C represents water extraction,D represents MAE,E represents enzymatic hydrolysis,F represents aminoguanidine)
2.4 不同提取方法获得的原花青素与其抗氧化、抗糖基化线性回归分析
不同提取方法制备的原花青素均有一定的抗氧化性和抗糖基化,为探究原花青素和抗氧化、抗糖基化之间的关系,以不同提取方法制备的原花青素含量为自变量,抗氧化性和抗糖基化活性为因变量,进行线性方程拟合,并比较其相关系数(表12)。乙醇/硫酸铵双水相提取法和微波法制备原花青素与其抗氧化线性回归系数均呈现显著差异(P<0.05),而上述二者方法与抗糖基化回归系数小,且差异不显著;水提法与其抗糖基化活性回归系数呈现显著差异(P<0.05);糖基化反应进程可导致自由基的产生,引起蛋白质构象改变、糖链分子断裂及糖基化产物氧化等进程,使氧化应激加剧,因此,抗氧化性在一定程度上可反映抗糖基化能力,但抗氧化性能力与抗糖基化活性之间未呈现因果关系,说明原花青素还具有金属络合、影响蛋白质硫醇基团、抑制糖基化中间产物的形成等作用,从而通过上述可能的途径抑制糖基化终产物的形成,因此,原花青素可能通过其它机理抑制糖基化。
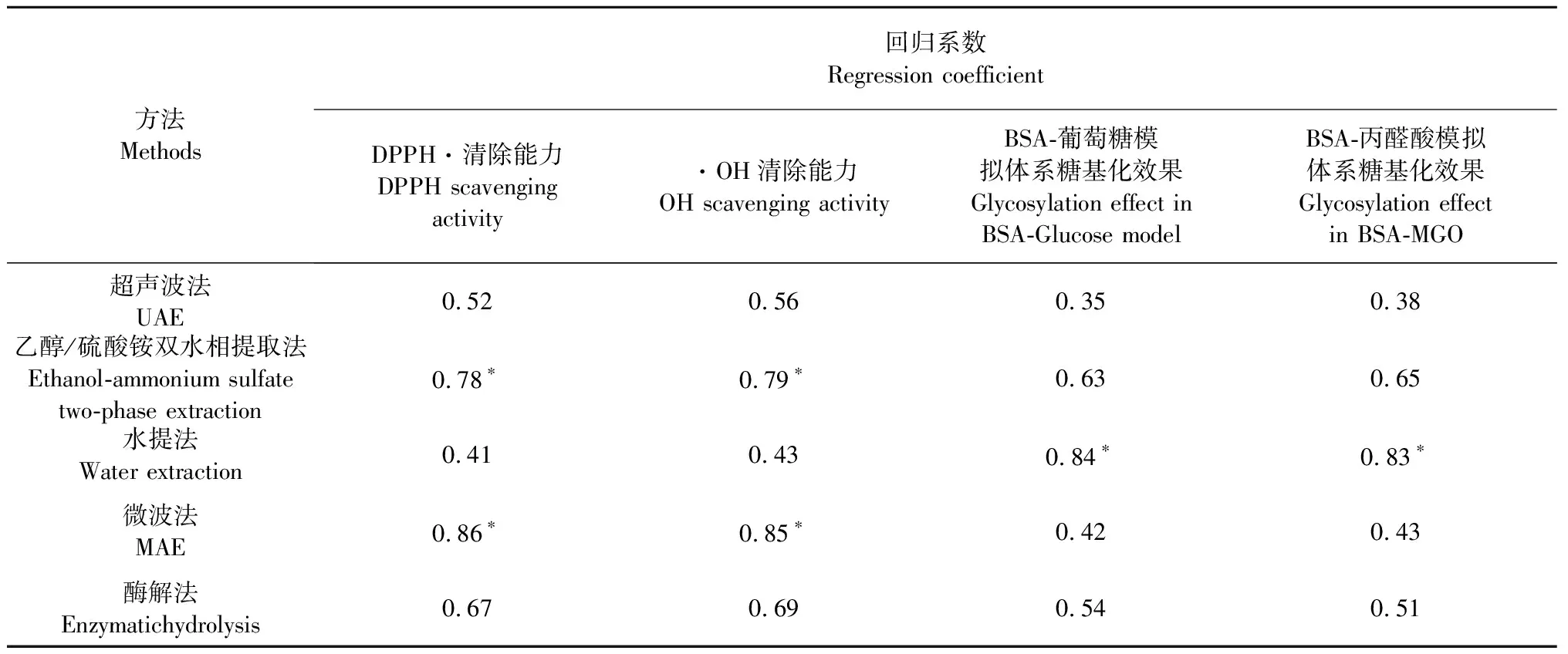
表12 不同方法提取的原花青素与抗氧化、抗糖基化线性回归系数Table 12 Linear regression coefficient between proanthocyanidins extracted by different methods and antioxidant and antiglycosylation
注:*表示P<0.05。
Note:*5% significance level.
3 结论
本试验结果表明,微波法对锁阳原花青素提取效果最佳,该法提取时间较短,操作方便,得率较高;不同提取方法获得的原花青素均有一定抗氧化和抗糖基化能力,微波法制备的原花青素清除DPPH·和·OH效果最好。抗氧化能力与抗糖基化无相关性,微波法和乙醇/硫酸双水相提取法获得的原花青素与抗氧化能力呈显著线性关系(P<0.05),而水提法获得的原花青素与抗糖基化能力呈显著线性关系(P<0.05)。因此,锁阳原花青素可作为抗氧化剂和较好的糖基化反应的抑制剂,为天然抗氧剂和抑制剂的开发提供参考依据,但不同提取方法对锁阳原花青素结构的影响及其与抗氧化活性和抗糖基化之间的关系,有待进一步分析。

