猪肌源性前体脂肪细胞的分离培养和成脂诱导分化研究
张宁芳,成志敏,乐宝玉,秦本源,王媛媛,王鹤洁,高鹏飞,郭晓红,李步高,曹果清
(山西农业大学 动物科技学院,太谷 030801)
猪肉是人们主要的动物性蛋白来源,猪肉中的肌内脂肪含量(intramuscular fat, IMF)是影响猪肉口感的关键因素[1]。肌内脂肪是一种分布于肌肉组织的白色脂肪,主要影响猪肉的嫩度、大理石纹与多汁性等,猪肉的理想肌内脂肪含量为2.5%~3.0%[2],适当地提高肌内脂肪沉积是改善肉质品质的关键。
脂肪的形成主要是经历脂肪细胞的增殖、分化以及三酰甘油的沉积,该过程涉及一系列分化转录因子的调控[3]。目前,确定的分化转录因子主要包括过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors, PPARs)家族、CCAAT增强子结合蛋白(CCAAT /enhancer binding protein, C/EBP)、脂肪酸结合蛋白(fatty acid-binding protein, FABP)、类固醇调节元件结合蛋白(sterol regulatory element-binding protein, SREBP)、锌指蛋白423(zinc finger protein 423, ZFP423)、激素敏感脂肪酶(hormone sensitive lipase, HSL)和PRDM16 (PRD1-BF1-RIZ1 homologous domain containing protein 16)等。PPARγ和C/EBPα是脂肪细胞分化成熟的主要调节因子,其中PPARγ被认为是最关键的脂肪形成的转录调控因子[4],C/EBPs属于高度保守的亮氨酸锌指蛋白家族,有6种亚型,其中,α、β亚型在脂肪分化中起促进作用,主要在脂肪分化早期进行表达[5]。FABP4涉及肌内脂肪的积累和发展[6],PRDM16是新发现的能够决定棕色脂肪细胞分化的关键转录调控因子,属于锌指蛋白家族[7]。SREBP1是一类能够调控不饱和脂肪酸的合成、胆固醇合成以及葡萄糖代谢的转录调控因子,也被称为脂肪细胞定向分化因子(adipocyte determination and differentiation 1, ADD1)[8]。HSL是参与脂肪分解代谢的关键酶,主要在脂肪的分解过程中发挥作用[9]。Gupta等[10]在研究前体脂肪细胞分化时从EBF家族中分离出ZFP423,并将其鉴定为前体脂肪细胞分化的转录调节因子。
肌内脂肪细胞是由肌内脂肪前体细胞分化而来,用于前体脂肪细胞分离培养的材料主要源于皮下、腹膜以及内脏等脂肪组织[8],而肌源性前体脂肪细胞需要分离肌肉中含有的脂肪组织。幼龄仔猪中分离获得的细胞分化程度低,增殖能力强,易于培养,但较难分离出肌肉中的脂肪组织,而成年个体肌肉中具有增殖分化能力的前体脂肪细胞数量较少,因此,如何有效获得肌源前体脂肪细胞并进一步研究肌内脂肪沉积机制值得探讨。在前体脂肪细胞的分离方面,常规的组织块培养法无法分离出均一的细胞,有些学者联合使用多种酶进行消化[11],减少了组织处理时间,降低了污染,达到较好效果。原代前体脂肪细胞可以发生自发充脂现象,而传代细胞失去分化特性,需要在体外添加诱导因子促进其分化。
对前体脂肪细胞进行诱导分化有多种方法,适宜浓度的油酸可以起到较好的诱导作用,该法具有诱导因子单一、分化时间短、分化率高等特点[12]。另一种较为常用的方法是“激素鸡尾酒”法[13],主要是4种诱导因子(胰岛素+地塞米松+IBMX+罗格列酮)的单独或联合使用。细胞系具有标准的诱导分化方案,但是就原代细胞来说,由于分离细胞使用物种的年龄、组织等差异,造成诱导因子的使用量存在差异。
肌源性前体脂肪细胞是研究肌内脂肪形成的良好细胞模型,因此,分离和培养猪的肌源性前体脂肪细胞对于研究肌内脂肪的形成与肉质品质的改善具有重要的指导意义。本研究以仔猪背最长肌为材料,参考分离FAPs[14]细胞的方法,采用胶原酶消化法成功分离培养猪肌源性前体脂肪细胞,并在细胞水平上对其增殖与分化以及分化过程中成脂相关基因的时序表达进行研究,为研究猪的肌内脂肪沉积机制提供相应的材料。
1 材料与方法
1.1 主要试剂
DMEM低糖培养基、PBS购自博士德生物工程有限公司;胎牛血清FBS、胰蛋白酶购自Gibco公司;青链霉素混合液、Ⅱ型胶原酶、油红O染液、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)、胰岛素购自索莱宝公司;罗格列酮购自Sigma公司;Trizol购自Ambion公司;反转录和实时荧光定量试剂盒购自TaKaRa公司;引物由上海生工生物工程有限公司合成。
1.2 样品采集与处理
选取15日龄杜长大三元仔猪(山西省清徐海旺养殖场)1头,颈部处死,用水冲洗后再用75%酒精喷洒全身,采集背最长肌组织,分别用75%酒精和添加1%双抗的PBS清洗数次,置于新的添加1%双抗的PBS中带回实验室。
1.3 猪肌源性前体脂肪细胞的原代培养
将肌肉组织用预冷的含1%双抗的PBS清洗,转入培养皿中,剪去肉眼可见的血管和结缔组织,再次将组织进行漂洗,然后将组织剪成约1 mm3的小块,将其转入15 mL离心管中,加入约两倍体积的浓度为0.2%的Ⅱ型胶原酶消化液,37 ℃振荡消化1 h,消化完成后,加入等量完全培养基(DMEM/低糖+10%FBS和1%双抗)终止消化。将所得的细胞消化液经500 r·min-1离心5 min,之后将所得上清经70和40 μm细胞筛组合过滤,滤液以2 000 r·min-1离心10 min,弃上清加入2 mL完全培养基重悬细胞,接种在60 mm培养皿中,置于37 ℃,5%CO2的培养箱中进行培养,24 h后进行首次换液,之后每2 d更换1次完全培养基。
1.4 猪肌源性前体脂肪细胞的传代培养
待细胞生长汇合至80%左右,即可对细胞进行传代培养。弃去培养基,加入不含双抗的PBS清洗2~3次,加入浓度为0.25%的胰蛋白酶1 mL,37 ℃消化细胞,待显微镜下观察细胞变圆后,立即加入等量完全培养基终止消化,轻轻吹打混合,将液体转移至15 mL离心管中,1 000 r·min-1离心3 min,弃上清,用完全培养基重悬细胞,1∶2传代继续培养。
1.5 猪肌源性前体脂肪细胞的生物学特性观察
1.5.1 形态学观察 原代细胞培养24 h换液后进行第1次观察,随后每隔1 d观察1次,并拍照记录。传代后细胞同样进行观察记录。
1.5.2 生长曲线 选择P3代细胞进行生长曲线的绘制。将细胞复苏,接种至10 cm培养皿中,待细胞生长汇合至80%左右,将细胞进行消化制成细胞悬液,接种于24孔板中,每隔12 h,用血球计数板对细胞进行计数,每次取样至少3个孔,多次计数取其平均值。细胞密度=细胞数/mL=4大格细胞总数/4×104,然后以培养时间为X轴,细胞密度为Y轴,绘制细胞生长曲线。
1.6 猪肌源性前体脂肪细胞的成脂诱导分化
取原代培养代数较早的细胞进行成脂诱导分化,将传代细胞接种于12孔板中,采用“激素鸡尾酒”法进行诱导[13],待细胞完全汇合后,更换诱导分化培养基(DMEM/低糖+10%FBS+1%双抗+5 μg·mL-1胰岛素+1 μmoL·L-1地塞米松+0.5 mmoL·L-1IBMX+1 μmoL·L-1罗格列酮),记为第0天,之后每2 d更换1次诱导分化培养基,在分化第6天后,将诱导分化培养基更换为维持分化培养基(DMEM/低糖+10% FBS+1% 双抗+5 μg·mL-1的胰岛素),在诱导分化的3、6、9 d收集细胞,用于后续RNA的提取。
1.7 猪肌源性前体脂肪细胞的油红O染色
待肉眼可见脂滴形成后,进行油红O染色,将细胞用PBS清洗3次,4%多聚甲醛室温固定10 min,弃去多聚甲醛,加入新的多聚甲醛静置1 h,ddH2O清洗3次,加入60%异丙醇静置5 min,弃去异丙醇直至细胞完全干燥,然后加入油红O染液染色10 min,ddH2O洗涤4次,在显微镜下进行观察。
1.8 RNA提取及成脂相关基因qRT-PCR检测
将收集的细胞进行总RNA提取,然后将RNA按说明书反转录为cDNA。采用qRT-PCR的方法检测成脂相关基因PPARγ、FABP4、C/EBPα、C/EBPβ、ZFP423、SREBP1、PRDM16和HSL的相对表达量,18S为内参基因,引物序列见表1。反应体系为10 μL:SYBR 5 μL,Rox 0.2 μL,上下游引物各0.15 μL,cDNA 2 μL,ddH2O 2.5 μL。反应程序:95 ℃预变性20 s;95 ℃变性20 s,60 ℃退火及延伸20 s,36个循环。结果根据2-ΔΔCT法计算。
表1引物序列
Table1Primersequences

基因Gene引物序列(5′→3′)Primer sequence产物长度/bpProduct length登录号Accession numberPPARγF: CTATTCCATGCTGTCATGGGTG107NM_214379.1R: ACCATGGTCACCTCTTGTGAC/EBPαF: GTGGACAAGAACAGCAACGAG115NC_010448.4R: CCAGCACCTTCTGTTGAGTCTC/EBPβF: CTGGAGACGCAGCATAAGGT110NC_010459.5R: TGCTTGAACAAGTTCCGCAGFABP4F: TGGTACAGGTGCAGAAGTGG108NC_010446.5R: TTCTGGTAGCCGTGACACCTZFP423F: CACCTGACCGTGCACTACAT128NC_010448.4R: CAGTGGTACAGCACGAAGGTPRDM16F: CCTGTGACGACCAGAACCTC112NC_010448.4R: GCGCCTTCTTTCACATGGACSREBP1F: GCGAGTCAAGACCAGTCTCC156NC_010454.4R: TCCCCATCCACGAAGAAACGHSLF:ACCTGGATGTGCACTTCTGG82NC_010448.4R: GCCGATGCCATGTTTGCTAG18SF: CCCACGGAATCGAGAAAGAG122NW_018085108.1R: TTGACGGAAGGGCACCA
1.9 数据分析
试验均设置3个重复,所有数据使用GraphPad Prism5软件中的One-way ANOVA进行方差分析和显著性检验,P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 猪肌源性前体脂肪细胞的形态学观察
2.1.1 原代培养 猪的背最长肌组织经胶原酶消化法分离得到肌源性前体脂肪细胞。如图1所示,接种时的细胞呈圆球状悬浮于培养液中,大约6~7 h,发现少量细胞贴壁,形态为似圆型、梭型以及各种不规则形状。24 h进行首次换液,用不含双抗的PBS洗去未贴壁的细胞以及杂质,细胞生长明显加快。在原代培养过程中发现,有的细胞自发发生分化,形成肉眼可见的脂滴,随着培养天数的增加,脂滴变大并发生融合。

A~F. 1~6 d图1 原代细胞的形态(100×)Fig.1 The morphology of primary cell(100×)
2.1.2 传代培养 待贴壁细胞生长至80%时即可进行传代培养,按1∶2的比例进行第1次传代。较原代细胞来说,传代细胞呈现均一的成纤维细胞样,生长状态良好(图2)。
图2 传代细胞的形态(100×)Fig.2 The morphology of passage cell(100×)
2.1.3 生长曲线 P3代肌源性前体脂肪细胞在接种后,贴壁细胞数有所减少,可能是消化过程中的胰酶或者吹打造成细胞的死亡;第0~24 小时,细胞数平稳增加;从第24~60小时呈指数增加,随后又趋于平稳,总体上,该传代细胞的生长趋势呈现S型(图3)。
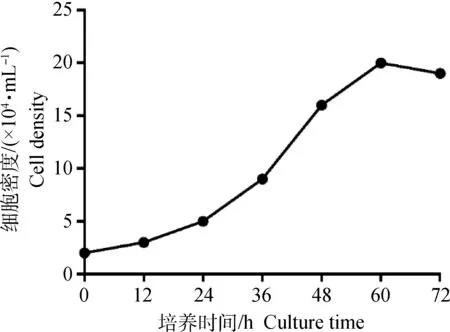
图3 生长曲线Fig.3 Cell growth curve
2.2 猪肌源性前体脂肪细胞的诱导分化以及油红O染色
在接种后的第3天或者第4天(视具体情况而定)时,贴壁细胞完全汇合后,更换诱导分化培养基,细胞迅速进入分化状态,形态上由梭型慢慢变为椭圆状,分化第6天,细胞质中开始出现小的脂滴,继续培养后,可以观察到细胞内的脂滴增加,脂滴体积慢慢变大并发生融合,在分化12 d左右,可以看到脂滴明显增多。使用油红O染色后可以观察到脂滴被染为红色,说明细胞已经分化为成熟的脂肪细胞(图4)。
2.3 猪肌源性前体脂肪细胞成脂诱导分化过程中成脂关键基因的时序表达
诱导分化的3、6、9 d分别代表脂肪细胞分化的早期、中期以及末期。共检测了PPARγ、FABP4、C/EBPα、C/EBPβ、ZFP423、SREBP1、PRDM16和HSL8个基因的时序表达变化,图5显示,所有基因在细胞分化的早期均有表达。随分化时间的延长,PPARγ的表达量逐渐升高,随后呈现下降的趋势,在分化的各个时间段差异极显著(P<0.01)。FABP4、C/EBPα以及SREBP1的变化趋势基本一致。C/EBPβ和PRDM16基因的表达量随着分化时间的增加而加强,且都在分化的第9天达到最大。ZFP423在分化早期与后期表达量基本处于同一水平,在分化第6天的表达量最大,但各个阶段未见显著差异。HSL基因在分化早期表达量最高,随着时间的增加表达量逐渐下降,第9天的表达量最低,且各时间点均差异极显著(P<0.01)。

A.明场;B.油红O染色A.Bright field;B.Oil red O staining图4 诱导分化和油红O染色的脂肪细胞(100×)Fig.4 Adipogenic differentiation and Oil red O staining of adipocytes(100×)

不同大写字母表示组间差异极显著(P<0.01)Different capitals indicate extremely significant differences among different groups (P<0.01)图5 成脂分化过程中各基因mRNA时序表达Fig.5 The mRNA temporal expression of genes in adipogenic differentiation process
3 讨 论
肌内脂肪含量是反映猪肉品质的一个关键指标,与其他的脂肪组织相比,具有不同的发育和代谢方式,不同物种的肌内脂肪也存在差异[12,15]。因此,肌源性前体脂肪细胞能够为研究肌内脂肪提供简便的细胞模型。
目前,对于家畜前体脂肪细胞的分离培养多集中在皮下以及内脏脂肪组织,而肌源性前体脂肪细胞是从肌肉中分离的前体脂肪细胞[11],该细胞的增殖分化等在肌内脂肪的研究中更具有代表性。原代细胞的分离培养主要包括组织块培养法和酶消化法,前者得到的细胞数量较少,且耗费时间,而酶消化法能够在短时间分离出大量成分均一且增殖旺盛的细胞。对于牛肌内前体脂肪细胞的培养主要是通过剥离肌肉组织中的脂肪组织进行消化培养[16]。耿晓晖等[17]培养绵羊的肌内脂肪细胞时采用组织块法,并使用流氏细胞仪对混合细胞进行分选纯化。在本试验中,选用的仔猪年龄较小,在肌肉中难以分离附着在其上的脂肪组织,主要是采用整体消化取上清的办法分离细胞,根据离心力的大小进行差速筛选。存在的问题是可能获取的细胞中前体脂肪细胞所占比例较少,因此,出现诱导分化后脂滴较少的情况。此外,在消化过程中涉及消化酶的选择、细胞筛孔径的大小和离心力的选择,都会影响原代细胞的分离与培养。有研究采用Ⅰ型胶原酶在37 ℃消化1 h,2 000 r·min-1离心5 min进行猪前体脂肪细胞的分离[18];八眉猪和绒山羊的肌内脂肪细胞培养分离时,均使用Ⅱ型胶原酶进行消化,先2 000 r·min-1离心10 min,再1 500 r·min-1离心10 min[19-20]。猪的前体脂肪细胞培养使用Ⅰ、Ⅱ型胶原酶均可,本实验室在比较两种胶原酶的分离效果后,选择Ⅱ型胶原酶进行消化。此外,在分析各个实验室方法的基础上,对传统的消化法进行了改良,将分离FAPs细胞的方法与常规分离方法进行结合,采用胶原酶消化1 h成功获得猪的肌源性前体脂肪细胞,减化了对组织的处理,增加了细胞分离的成功率[14]。
原代培养的前体脂肪细胞可以自行分化,而传代培养的细胞已经失去此特性,因此需要添加诱导因子促进分化。常用诱导分化方法包括油酸、“激素鸡尾酒”法以及诱导因子的单独或联合使用。诱导因子包括胰岛素、地塞米松、IBMX和罗格列酮[13]。林森等[12]使用100 μmoL·L-1的油酸诱导液对山羊前体脂肪细胞进行诱导分化,在2 d后即可看到细胞内充斥着小脂滴。赵存真等[15]、张萌萌等[16]、耿晓晖等[17]、杜琛等[19]均使用不含罗格列酮的诱导分化培养基对前体脂肪细胞进行诱导,在诱导2 d后更换为只含有胰岛素的维持分化培养基,在分化第8天进行油红O染色,均观察到成熟的脂肪细胞。而在八眉猪[20]前体脂肪细胞诱导分化时,额外添加100 nmoL·L-1的罗格列酮已达到更好的分化效果。本次试验中选择了八眉猪前体脂肪细胞的诱导分化方案,但没有达到预期效果,可能与本研究中前体脂肪细胞来源于肌肉,含有一定数量的肌细胞有关。此外,体外培养条件下前体脂肪细胞的分化时间进程也存在差异,可能与细胞的种类、分化试剂的浓度等有关。
PPARγ和C/EBPα被认为是脂肪细胞分化过程中必不可少的转录因子[21]。PPARγ是脂肪细胞分化过程中最关键的转录因子,迄今为止,尚未发现任何一种因子能够在缺失PPARγ的情况下诱导脂肪形成[22-23]。PPARγ主要在脂肪生成的早期表达量迅速增加,同时它也在脂质代谢、脂肪形成、细胞分裂和凋亡等多种生物学过程中发挥着重要的调节作用[21,24]。小鼠的3T3-L1细胞系是体外研究前体脂肪细胞分化的常用模型,在小鼠3T3-L1诱导分化过程中,发现下调该基因的表达分化受到明显的抑制[25]。本研究中,诱导第6天时PPARγ的表达达到最高峰,之后逐渐下降,说明分离的细胞在体外诱导第6天时才处于分化早期,表明体内与体外的分化存在差异,在不同的细胞中进行诱导分化也存在差异。在脂肪细胞分化期间,C/EBPβ是最先表达的基因,可以诱导C/EBPα和PPARγ的表达而启动生脂信号[26-27]。本研究中,C/EBPβ在第3天的表达量都高于C/EBPα和PPARγ,随后都呈现增加的趋势,符合上述研究结果。同样,在3T3-L1细胞系中诱导分化后,C/EBPβ的表达逐渐增加,在48 h后即达到高峰,之后逐渐回落[28]。SREBP1是在肝中发现的一类能够调控脂肪合成的转录调控因子[29],是脂肪酸、三酰甘油合成代谢的激活剂,能够促进它们的合成与吸收,也能够通过促进脂肪合成相关酶的活性,进而促进PPARγ的转录活性[30],参与脂肪合成[31]和脂质沉积[32]。在3T3-L1分化过程中,SREBP1 mRNA表达水平呈上升趋势,该试验中SREBP1的表达在分化中期最高,末期出现下降,推测是细胞生长空间的问题。HSL主要参与脂肪的分解过程,是参与脂肪组织的三酰甘油分解与释放游离脂肪酸的关键酶和限速酶,除能够调控脂肪组织的分解以外,也能够影响动物组织的脂肪沉积。本研究中,HSL表达量在分化早期最高,之后随着分化的进行,其表达量逐渐下降,与Harada等[33]研究结果相符。FABP4属于脂肪酸结合蛋白超家族,相对分子质量约14.6 ku。该基因在脂肪组织中高表达,同时作为细胞中胞质蛋白,约占成熟脂肪细胞总蛋白的6%[34]。在3T3-L1前体脂肪细胞分化过程中,FABP4的表达及活性显著增强[35],本试验结果与其相符。此外,在本试验中发现,FABP与PPARγ、C/EBPα的表达趋势大体相同,原因是FABP4是PPARγ信号调控通路下游基因,且活化的PPARγ和C/EBPs能够与FABP4相互作用并提高其表达[36]。有研究指出,FABP4不仅是脂肪细胞分化晚期的标志之一[34],而且还是影响肌内脂肪含量的候选基因之一[37],这为研究肌内脂肪沉积机制提供了进一步的基础。ZFP423是锌指蛋白家族成员,多种锌指蛋白都可以与PPARγ和C/EBPs作用,促进或抑制脂肪细胞的分化[38]。同时,ZFP423基因对于间充质干细胞定向形成脂肪前体细胞起到决定性作用[10]。在3T3-L1前体脂肪细胞中,过表达ZFP423促进脂肪生成,敲除ZFP423基因则会抑制脂肪生成[23],说明ZFP423对于脂肪分化是必不可少的,与本研究结果一致。PRDM16是通过筛选得到的在棕色脂肪中特异表达的基因,该基因能够调控棕色脂肪的定向分化,属于锌指蛋白家族[39-40]。PRDM16能够促进棕色脂肪相关基因的表达,并抑制白色脂肪相关基因的表达[41]。PRDM16基因在间质-血管细胞分化前或分化中表达,此外,在成熟的白色脂肪细胞中也存在表达[39]。综上表明,从油红O染色以及成脂相关基因的表达可以说明本研究所建立的肌源性前体脂肪细胞分离培养以及成脂诱导的方法是可行的,不仅为前体脂肪细胞的分离培养提供简便可行的方案,而且为肌内脂肪沉积机制的研究提供了相应的基础。
4 结 论
本研究成功分离培养了猪的肌源性前体脂肪细胞,并在体外诱导分化为成熟脂肪细胞。成脂相关基因PPARγ、C/EBPα、C/EBPβ、ZFP423、FABP4以及SREBP1在诱导分化第6天表达量较高,而脂肪分解关键基因HSL的表达随细胞成脂分化的进行极显著降低。本试验为深入研究猪肌内脂肪的沉积机制提供了良好的细胞模型。

