内质网应激对心肌梗死后心力衰竭大鼠心肌组织的作用
王晶晶 张 杰 卢 静
(1. 首都医科大学实验动物部,北京 100069)(2. 首都医科大学公共卫生学院临床流行病学北京市重点实验室,北京 100069)
心力衰竭(heart failure,HF)是各种严重心脏疾病共有的一个主要并发症或“最后共同通道”。心力衰竭患者一旦出现典型症状,病情将进行性加重,死亡率与恶性肿瘤病人相仿[1-2],但目前对于其机制、诊断和治疗的认识还远远不够。随着研究的不断深入,发现心肌细胞的不正常凋亡在心衰中起着重要的作用[3-4]。同时发现内质网应激(endoplasmic reticulum stress,ERS)是使心肌细胞不正常凋亡的新途径。本实验通过建立大鼠急性心肌梗死模型,观察心肌梗死后心力衰竭大鼠8周内内质网特异性分子伴侣的表达变化与心衰大鼠心肌细胞凋亡的关系,探讨急性心肌梗死后大鼠心力衰竭的过程中,内质网应激在心肌细胞凋亡中的作用,从而为心衰病人的治疗提供新的思路。
1 材料与方法
1.1 动物分组及模型建立
SPF级雄性SD大鼠80只,体质量200~220 g。由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号:SCXK(京)2012-0001;饲养于首都医科大学实验动物中心SPF级实验室,实验动物使用许可证号:SYXK(京)2013-0004。
动物经适应性喂养一周后,随机分为假手术组,手术组。假手术组仅进行开胸手术,不结扎冠脉,随机分0周组、2周组、4周组、6周组、8周组,每组存活动物不低于5只。手术组根据参考文献[5-7]的方法,结扎大鼠左冠状动脉前降支,肢体导联出现1个明显的ST段弓背抬高,心肌梗死模型成功,模型成功率为98%。手术组术后随机分为术后2周组、4周组、6周组、8周组共4组,每组存活动物不低于5只。
1.2 主要试剂及仪器
Trizol试剂(Invitrogen公司),RNA反转录试剂盒(Promege公司),QPCR试剂盒(ABI公司)、引物合成(上海生工生物工程技术服务有限公司合成)。
EL-420F生物机能实验系统(成都泰盟生物科技有限公司,国产),荧光定量PCR仪(Bio-RAD公司,IQ5美国)、高速冷冻离心机(Thermo公司,德国)。
1.3 方法
1.3.1血流动力学指标测定:分别测定假手术组各组在0周、2周、4周、6周、8周的心率(HR);左心室压力最大上升速率(dp/dt max);左心室最大下降速率(-dp/dt max);左心室收缩压(LVSP)、左心室舒张末压(LVEDP);测定手术组术后2周组、术后4周组、术后6周组、术后8周组大鼠在2周、4周、6周、8周的心率(HR);左心室压力最大上升速率(dp/dt max);左心室最大下降速率(-dp/dt max);左心室收缩压(LVSP)、左心室舒张末压(LVEDP)。
1.3.2心肌组织提取总RNA,逆转录为cDNA:手术组术后2周组、4周组、6周组、8周组大鼠分别于术后2周、4周、6周、8周处死并取其心肌组织;假手术组大鼠分别在0周、2周、4周、6周、8周处死并取其心肌组织。采用Trizol试剂[6-7]分别提取假手术组各组大鼠、手术组各组大鼠的心肌组织中总RNA,利用RNA反转录试剂盒将心肌总RNA反转录为cDNA。
1.3.3引物设计:引物根据GenBank数据库中的基因组序列,利用生物学软件Primer5.0自行设计。
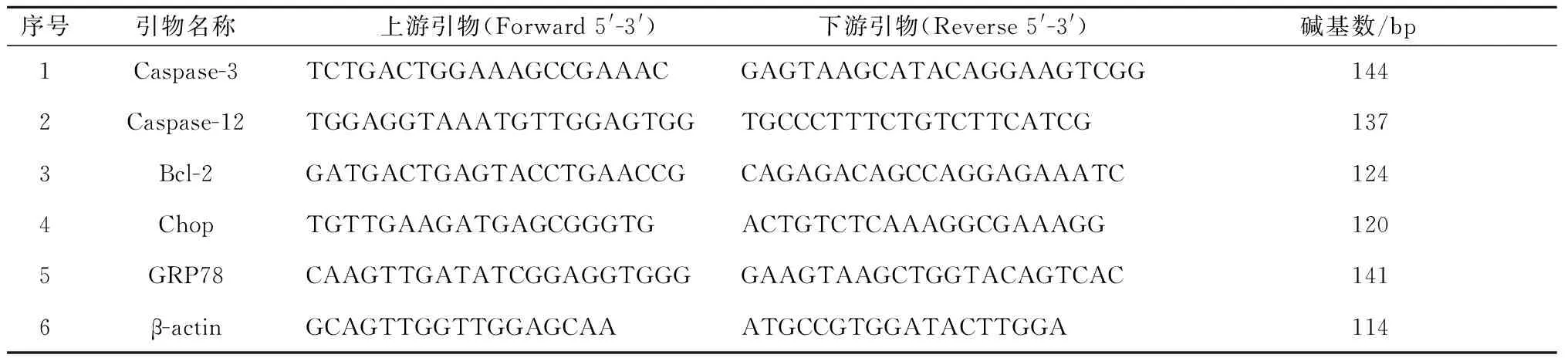
表1 引物序列
1.3.4荧光定量PCR法(QPCR)测定Caspase-3, Caspase-12, Bcl-2,CHOP, GRP78在心肌组织中的的表达量:利用QPCR反应试剂盒(SYBR GREEN法)采用20 μL反应体系。PCR反应程序:95 ℃预变性3 min,95℃10 s,55℃30 s,40个循环。PCR产物应用随机软件进行分析得到相关的光密度值。每个样本做3平行样,最后取基因或蛋白的光密度值与相应的β-actin光密度值的比值进行分析。
1.4 统计方法
采用SPSS 19.0统计软件进行分析,组间的数据比较采用S-N-K 检验,蛋白及基因的表达量与时间的相关性分析采用Speaman相关。检验水准为0.05。
2 结果
2.1 血流动力学测定
假手术组大鼠2、4、6、8周的血流动力学各项指标与该组0周时的相比均无统计学意义(P>0.05),结果见表2;手术组大鼠的心率随着饲养时间的增长逐渐加快,术后2周、4周、6周、8周组大鼠左心室收缩压(LVSP)与假手术组的相比有明显下降,差异有统计学意义(P≤0.01);手术组大鼠术后2周、4周、6周、8周组的左心室收缩压(LVEDP)与假手术组相比明显升高,差异有统计学意义(P≤0.01);手术组术后2周组与假手术组大鼠的左心室压力最大上升速率(+dp/dt max)相比差异有统计学意义(P≤0.05),手术组大鼠术后4周、6周、8周组与假手术组的左心室压力最大上升速率(+dp/dt max)相比有明显下降,差异有统计学意义(P≤0.01);手术组术后2周组与假手术组大鼠的左心室压力最大下降速率(-dp/dt max)相比差异有统计学意义(P≤0.05),手术组大鼠术后4周、6周、8周组与假手术组大鼠的左心室压力最大下降速率(-dp/dt max)相比有显著下降,差异有统计学意义(P≤0.01),结果见表3。
2.2 不同组的大鼠心肌组织中Caspase-12, Caspase-3, Bcl-2,CHOP, GRP78的表达
手术组大鼠术后2、4、6、8周组心肌组织中Caspase-12的表达量随着饲养时间的延长表达量增加,与假手术组相比差异有统计学意义(P≤0.01);手术组大鼠术后2、4、6、8周组心肌组织中Caspase-3的表达量随着饲养时间的延长表达量增加,术后4、6周组与假手术组相比差异有统计学意义(P≤0.05),术后2、8周与假手术组相比差异有统计学意义(P≤0.01);大鼠手术组术后2、4、6、8周组心肌组织中Bcl-2的表达量随着术后饲养时间的延长而降低,2、4、6、8周组与假手术组相比差异有统计学意义P≤0.01);大鼠术后2、4、6、8周组心肌组织中CHOP的表达量随着饲养时间的延长表达量增加,术后2、4周组与假手术组相比差异有统计学意义(P≤0.01),术后6、8周组与假手术组相比差异有统计学意义(P≤0.05);大鼠手术组术后2、4、6、8周组心肌组织中GRP78蛋白的表达量随着饲养时间的延长表达量增加,术后6周组与假手术组相比差异有统计学意义(P≤0.05);术后8周组心肌组织中的GRP78蛋白含量与假手术组相比差异有统计学意义(P≤0.01),结果见表4。
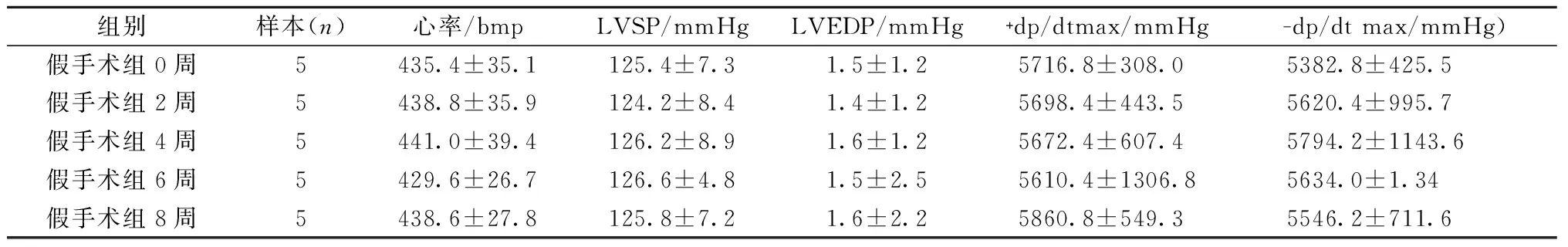
表2 假手术组大鼠不同时间的血流动力学检测结果
注:A:与假手术组比P≤0.05; AA:与假手术组比P≤0.01 Note:A:P≤0.05vssham group, AA:P≤0.01vssham group

表4 各组大鼠心肌组织基因/蛋白含量表达
注:A:与假手术组比P≤0.05; AA:与假手术组比P≤0.01 Note:A:P≤0.05vssham group,AA:P≤0.01vssham group
2.3 术后饲养2、4、6、8周与手术组大鼠心肌组织中Caspase-12, Caspase-3, Bcl-2,CHOP, GRP78含量的相关性
手术组大鼠心肌组织中Caspase-12, Caspase-3,CHOP, GRP78的表达量随着术后饲养时间的增长而增加,其表达量与时间呈正相关,心肌组织中Bcl-2的表达量随着术后饲养时间的增长而减低,其表达量与时间呈负相关,结果见表5。

表5 大鼠术后饲养时间与大鼠心肌组织中蛋白/基因表达量的相关性
3 讨论
心力衰竭是心脏结构与功能严重减退的临床表现,然而对心肌梗死后心力衰竭的发生、发展机制仍未完全阐明。急性心肌梗死后心肌细胞的死亡会导致心室重塑和心力衰竭,而心室重构的发生与心肌细胞凋亡又有着重要联系。研究显示心肌细胞凋亡在心肌梗死后心室重塑和心衰发展中发挥重要作用,而心肌细胞凋亡与内质网应激的发生又密切相关[8-9]。
内质网是广泛存在于真核细胞内的重要细胞器,当机体受到如缺氧、中毒、电解质酸碱平衡紊乱等刺激时,其相应的跨膜信号传导蛋白将会被激活,破坏内质网内环境的稳定,抑制内质网蛋白质合成功能,诱导细胞发生内质网应激[10-11]。内质网应激早期,是通过激活未折叠蛋白反应(unfolded protein response,UPR)保护由ERS引起的细胞损伤,恢复细胞功能恢复内质网稳态,维持细胞的正常功能并使之生存,是细胞的一种自我保护性机制。
UPR是由内质网分子伴侣GRP78/Bip (glucose-regulated protein78/binding immunoglobulin protein)和内质网上PERK、ATF6、IRE1应激感受蛋白所介导发生的。正常情况下GRP78与PERK、ATF6、IRE1连接呈无活性状态,当内质网内积聚大量未折叠蛋白时,GRP78与三者解离,激活PERK、ATF6、IRE1,启动UPR反应,从而对细胞起到保护作用。因此GRP78在应激条件下对细胞起保护作用,而它的诱导产生则被广泛用于标志ERS和UPR的发生[12]。
本实验中发现急性心肌梗死后心力衰竭的大鼠心肌组织中GRP78蛋白持续表达,并随着术后饲养时间的延长,心力衰竭的严重程度增强。这说明在急性心肌梗死到心力衰竭的病理过程中内质网应激反应被激活。这可能是由于急性心肌梗死的大鼠在发展成慢性心力衰竭的过程中,随着大鼠心肌细胞的缺血,心脏输出量降低,心脏功能减弱,使得内质网负荷逐渐加重,从而诱导了ERS和UPR反应的发生。
大鼠在发生急性心肌梗死后发展到心力衰竭的过程中,体内的ERS持续存在,过强或过久的ESR,使得UPR的保护作用不能与ESR带来的损伤相抗衡。由于不能通过UPR的启动恢复细胞正常功能,内质网上与ERS相关的跨膜蛋白信号将会激活下游的凋亡信号分子:Caspase-12,GADD153/CHOP(growth arrest and DNA-damage-inducible gene 153或C/EBP homologous protein),从而导致心肌细胞凋亡[13]。已有的研究表明,内质网应激是除了线粒体外,另一条诱导细胞凋亡的新途径,过强的或长时间的ERS反应可以引起细胞凋亡[14-15]。
Caspase-12是内质网膜独有的蛋白水解酶,特异性结合于内质网膜上。正常情况下以无活性的前提存在,当发生ESR时Caspase-12被激活,进而激活下游的Caspase-3,从而诱导细胞凋亡的发生。实验证明Caspase-12是内质网应激诱导凋亡的特异性分子,是不通过线粒体凋亡途径的独立信号转导途径介导细胞凋亡的[15-16],因此可以把Caspase-12的活化作为ERS途径细胞凋亡的标志[15]。
而GADD153/CHOP是b-ZIP转录因子,属于CCAATP增强子连接蛋白的转录因子C/EBP家族,在正常生理状态下CHOP基本检测不到,当内质网应激持续时间过长或程度过重时,其活性被显著激活,引发高水平的ERS[16]。 因此CHOP是内质网应激的标志,它是是通过下调Bcl-2表达、耗竭谷胱甘肽、促进反应氧族产生等导致细胞凋亡。
我们在实验中发现心肌梗死后心力衰竭的大鼠术后2周、4周、6周、8周组的心肌组织中Caspase-3,Caspase-12,CHOP 的表达量随着术后饲养时间的延长,心力衰竭的严重程度而增加。Bcl-2的表达量随着术后饲养时间的延长,心力衰竭的严重程度而减少。这说明大鼠从心肌梗死发展到心力衰竭的过程中,内质网上始终有ESR的发生。持续存在的ESR,使与内质网相关的凋亡信号分子被激活,引发心肌细胞凋亡,并使细胞凋亡贯穿于心肌梗死到心力衰竭的整个过程。
综上所述,大鼠从急性心肌梗死发展到心力衰竭的病理生理过程诱导了内质网应激的发生,持续、严重的内质网应激激活了与内质网应激相关的细胞凋亡通路,使得心肌细胞凋亡。提示ERS参与了大鼠从急性心肌梗死到心力衰竭发生、发展过程。内质网应激诱导的心肌细胞凋亡作用可能是心肌梗死后导致心力衰竭发生的机制之一。

