不同营养支持方式治疗神经内科危重症患者的比较研究
刘春,陈洁,华平,沙瑞娟
神经内科危重症患者多伴有严重意识障碍、吞咽困难等症状,加上危重患者机体分解代谢率增高,蛋白质分解超过合成,患者的营养状况常常恶化,对临床治疗、康复及预后产生不良影响[1-3]。营养支持作为危重症患者常规治疗的一部分,具有重要的临床价值[4]。本研究旨在探讨不同营养支持方式对神经内科危重症患者的疗效,现报道如下。
1 资料与方法
1.1 一般资料
选择2011年1月至2016年10月我科收治的神经内科危重症患者98例,男51例,女47例;年龄29~83岁;发病24 h内入院,均伴有意识障碍或吞咽困难,不能正常进食;排除代谢性疾病者、消化道疾病者、严重肝肾等器官功能障碍者、重度心力衰竭患者、恶性肿瘤患者等。本研究经医院伦理委员会批准,患者家属均知情并签署治疗同意书。
采用随机数字表法将全部患者随机分为2组,各49例。肠外营养组男26例,女23例,平均年龄(58.65±3.15)岁,包括脑梗死22例、脑出血21例、蛛网膜下腔出血2例,脑静脉窦血栓3例、吉兰-巴雷综合征1例;肠内营养组男25例,女24例,平均年龄(59.03±3.45)岁,包括脑梗死25例,脑出血20例、蛛网膜下腔出血1例、重症肌无力2例、吉兰-巴雷综合征1例。2组性别、年龄及患病种类差异无统计学意义(P>0.05),具有可比性。
1.2 方法
2组均针对原发疾病给予对症支持治疗、降颅压、脱水、改善微循环及免疫球蛋白、糖皮质激素等治疗。入院后,肠外营养组于发病48 h内开始给予肠外营养7 d,输液泵24 h持续泵入营养液,含45%葡萄糖、25%中长链脂肪乳、10%复方氨基酸、微量元素、电解质、维生素等;7 d后改为肠内营养,方法同肠内营养组。肠内营养组于发病48 h内开始给予肠内营养,经鼻饲管12 h持续泵入肠内营养混悬液(能全力,纽迪希亚制药有限公司生产),有合并其他系统疾病者给予特殊配方肠内营养混悬液(均由华瑞制药有限公司提供),如瑞代(糖尿病专用配方)、瑞高(高蛋白比配方)、瑞能(高脂肪比配方)等。按25 kcal/(kg·d)计算每日所需能量,每3小时抽吸胃残液1次,保证胃潴留量<150 mL。2组均观察14 d。
于治疗前、后,对2组的营养状况、免疫功能、胃肠功能恢复、并发症等方面进行比较。于治疗前、后抽取患者清晨空腹静脉血,检测其血清总蛋白(total protein,TP)、血清白蛋白(albumin,ALB)、血红蛋白(hemoglobin,HB)、总淋巴细胞计数(total lymphocyte count,TLC)、IgM、IgG、HLA-DR 的水平;同时记录肠鸣音恢复时间、肛门排气时间、排便时间、住院时间,比较身体质量指数(body mass index,BMI),并观察患者出现腹泻、腹胀或便秘、肺部感染等并发症的情况。
1.3 统计学处理
2 结果
2.1 2组治疗前后营养指标变化比较
2组治疗前,各营养指标差异无统计学意义(P>0.05);2组治疗后TP、ALB、HB、BMI均低于同组治疗前,但肠内营养组高于肠外营养组,差异均有统计学意义(P<0.05),见表1。
表1 2组治疗前后营养指标比较(±s)
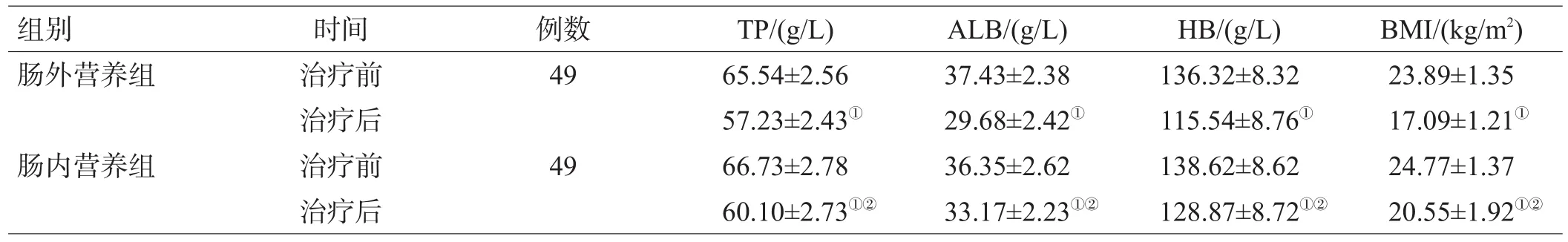
表1 2组治疗前后营养指标比较(±s)
注:与治疗前比较,①P<0.05;与肠外营养组比较,②P<0.05
组别肠外营养组肠内营养组时间治疗前治疗后治疗前治疗后例数49 49 TP/(g/L)65.54±2.56 57.23±2.43①66.73±2.78 60.10±2.73①②ALB/(g/L)37.43±2.38 29.68±2.42①36.35±2.62 33.17±2.23①②HB/(g/L)136.32±8.32 115.54±8.76①138.62±8.62 128.87±8.72①②BMI/(kg/m2)23.89±1.35 17.09±1.21①24.77±1.37 20.55±1.92①②
2.2 2组免疫功能改变比较
2组治疗前TLC和HLA-DR差异无统计学意义(P>0.05);2组治疗后TLC和HLA-DR均高于同组治疗前,但肠内营养组高于肠外营养组,差异有统计学意义(P<0.05)。2组治疗前IgM和IgG差异无统计学意义(P>0.05),治疗后肠外营养组IgM和IgG均低于同组治疗前,肠内营养组IgM和IgG与治疗前差异无统计学意义(P>0.05),且高于肠外营养组(P<0.05),见表2。
表2 2组治疗前后免疫功能比较(±s)

表2 2组治疗前后免疫功能比较(±s)
注:与治疗前比较,①P<0.05;与肠外营养组比较,②P<0.05
组别肠外营养组肠内营养组时间治疗前治疗后治疗前治疗后例数49 49 TLC/(×109/L)1.01±0.31 1.19±0.41①1.02±0.71 1.29±0.22①②HLA-DR/%60.02±4.82 66.01±5.95①61.55±5.77 69.98±5.22①②IgM/(g/L)2.11±0.32 1.48±0.25①2.09±0.37 1.92±0.22②IgG/(g/L)12.60±0.76 9.15±1.19①12.32±1.13 10.21±1.26②
2.3 2组胃肠功能恢复比较
肠内营养组肠鸣音恢复时间、肛门排气时间、排便时间及住院时间均短于肠外营养组,差异有统计学意义(P<0.05),见表3。
表3 2组胃肠功能恢复情况比较(±s)

表3 2组胃肠功能恢复情况比较(±s)
注:与肠外营养组比较,①P<0.05
组别肠外营养组肠内营养组例数49 49肠鸣音恢复时间/h 44.3±4.3 36.7±3.2①肛门排气时间/h 61.5±7.2 50.1±6.9①排便时间/d 4.3±0.8 3.0±0.4①住院时间/d 51.7±1.2 32.1±1.3①
2.4 2组并发症发生情况比较
肠外营养组发生腹泻或腹胀便秘4例,肺部感染18例,不良反应总发生率44.90%(22/49),肠外营养组发生腹泻或腹胀便秘3例,肺部感染10例,不良反应总发生率26.53%(13/49),肠内营养组的不良反应发生率低于肠外营养组,差异有统计学意义(P<0.05)。
3 讨论
神经内科危重症患者常因意识障碍或吞咽困难而不能正常进食,且机体处于高分解代谢状态,影响营养物质的正常摄取和利用,出现营养不良及免疫功能低下,加重病情,出现感染等多种并发症,甚至发生多组织器官功能障碍或死亡[5,6]。合理、有效的营养支持是临床治疗的重要环节[7]。肠外营养是临床常用的一种营养支持方法,可减少食物对胃肠道的刺激,但也会减弱胃肠道的吸收功能,且静脉输注液体会增加患者呼吸和循环系统的负担,使营养物质不能很好代谢,并引发各种并发症[8]。而肠内营养可使食物对胃粘膜产生直接刺激,利于粘膜屏障功能的恢复和维持,促进营养成分的吸收,减少各种感染和应激性溃疡的发生,对患者临床康复和预后起到积极的促进作用,且能提高患者对临床治疗的耐受性[9]。国际及国内众多指南已明确肠内营养优先于肠外营养,但是目前也有专家认为肠外与肠内营养的优先性一致。
本研究结果显示,2组的临床营养指标(TP、ALB、HB、BMI)均低于同组治疗前,但肠内营养组好于肠外营养组(均P<0.05),这提示神经内科危重患者发病2周内的营养状况降低,但肠内营养有助于缓解营养状况的降低。治疗后,肠外营养组的体液免疫功能降低(P<0.05),肠内营养组与治疗前无明显降低,且好于肠外营养组(P<0.05)。治疗后,2组的TLC及HLA-DR均高于治疗前,且肠内营养组高于肠外营养组,这提示肠内营养可提高患者的细胞免疫功能。肠内营养组患者胃肠功能恢复指标(肠鸣音恢复时间、肛门排气时间、排便时间)均优于肠外营养组,并发症的发生率低于肠外营养组,住院时间短于肠外营养组。
综上所述,早期给予肠内营养支持较简单的肠外营养更有助于改善神经内科危重症患者的营养状况,提高其免疫功能,促进肠功能恢复,并改善预后。但需要注意的是,肠内营养支持要根据患者的具体情况进行个体化分析并制定营养支持方案,严格计算每日所需热量,并根据患者病情的变化及时调整方案。此次研究也存在一定弊端,样本量较少,患者年龄跨度较大等,因此仍需要进一步扩大再研究。

