犬表皮生长因子受体2胞外Ⅳ区(her-2-ECD-4)抗原表位分析及单克隆抗体制备
赵冰冰,刘 娜,肖 敏,常宏建,任晓丽,张 佩,雷 磊,牟 婧,刘 云
[1.东北农业大学动物医学学院,黑龙江 哈尔滨 150030;2.黑龙江省实验动物与比较医学重点实验室(外科),黑龙江 哈尔滨 150036]
人表皮生长因子受体2(her-2,ErbB2)是人乳腺肿瘤靶向治疗的重要治疗手段[1]。人her-2蛋白序列N端胞外区(her-2 N-terminal extracellular domain,her-2-ECD)为前630,胞外区又分为4个亚区,Ⅰ(1-195)、Ⅱ(196-319)、Ⅲ(320-488)、Ⅳ(489-630)[2],其中Ⅳ区(her-2-ECD-4)为一段富含半胱氨酸的区域,临床上已经在使用的曲妥珠单抗(Trastuzumab)即为针对人her-2-ECD-4的抗肿瘤药物。自1998年美国FDA批准人源化曲妥珠单抗(Trastuzumab)用于临床后,其已取得了令人瞩目的效果,但临床治疗结果证明Trastuzumab虽然能一定程度上增加her-2阳性乳腺癌肿瘤患者的生存率,但是高达70%患者最终获得性耐药[3]。另外,对于her-2过表达的乳腺癌肿瘤患者,Trastuzumab的疗效并不如预期试验那么好,且具有一定的肝脏和肾脏毒性。犬her-2基因与人her-2基因具有很高的相似性,犬乳腺肿瘤在母犬中也具有一定的发病率,犬her-2基因同样作为犬乳腺肿瘤的标记物,在临床检测和治疗中具有一定的价值,然而,犬her-2过表达与犬乳腺肿瘤发展和预后之间的关系尚不明确,因此其在分子生物学、病理组织学及临床病况数据等方面的信息还需进一步进行研究,以明确其与犬乳腺肿瘤之间的关系[4]。所以分析犬her-2-ECD-4蛋白的生物学信息,并制备其单克隆抗体,对犬乳腺肿瘤的检测试剂盒及抗肿瘤药物的开发具有指导作用,另外对犬是否能成为人乳腺肿瘤药物改良的动物模型具有探究价值。
1 材料与方法
1.1 菌株、质粒、细胞及实验动物 DH5α、BL21(DE3)购自北京全式金生物技术有限公司;原核表达载体pET-32a(+)和骨髓瘤细胞SP2/0由东北农业大学动物医学学院预防兽医学研究室冻存;犬乳腺肿瘤细胞系CHmm由日本东京大学农学部生命科学科大学院兽医外科研究室馈赠。4周龄SPF级BALB/c雌鼠,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂和仪器 羊抗鼠IgG酶标抗体和山羊抗兔IgG酶标抗体(辣根过氧化物酶HRP标记),购自北京中杉金桥生物技术有限公司;HAT、HT、弗氏完全佐剂、弗氏不完全佐剂,购自Sigma公司(美国)。限制性内切酶购自 TaKaRa公司(中国大连)。DMEM完全培养基、胎牛血清,均购自 GIBCO公司;Anti-ErbB2 antibody,购自Abcom公司。
1.3 表位分析 利用TMHMM Server 2.0软件分析跨膜区找到其胞外区,对比人her-2胞外区分区情况,确定犬her-2胞外区Ⅳ区蛋白序列,利用Prot-Param在线分析工具分析蛋白的理化性质。将得到的蛋白序列再用 DNAStar、sopma、SWISS-MODLE 等软件分析,结合分析结果,确定该段蛋白序列可能的抗原表位。
1.4 犬her-2-ECD-4单克隆抗体制备
1.4.1 重组蛋白表达及免疫 将构建好的重组质粒转入BL21,用IPTG诱导重组蛋白表达,超声破碎菌体后发现其为部分可溶性表达,即选择镍柱纯化重组蛋白,纯化后的抗原蛋白透析浓缩后即用于免疫小鼠。小鼠免疫程序为初次免疫,用弗氏完全佐剂和抗原蛋白混合,皮下多点注射;第二次免疫,用弗氏不完全佐剂和抗原蛋白混合,腹腔注射;第三次免疫,只用抗原蛋白,腹腔注射;最后的加强免疫用抗原蛋白,腹腔注射。
1.4.2 细胞融合和筛选阳性融合细胞 将免疫小鼠眼球采血后脱颈处死,取其脾脏研磨后与培养状态良好的生长至80%骨髓瘤细胞sp2/0融合,并加到铺好饲养层细胞的96孔培养板里,每孔100 μL。待融合细胞生长至孔的2/3时,用间接ELISA检测方法检测杂交瘤细胞阳性情况。
1.4.3 单克隆抗体亚类鉴定应用 SBA ClonotypingTMSystem/HRP抗体亚类鉴定试剂盒(Southern Biotech公司)鉴定单克隆抗体的亚类。具体方法:取已包被的间接ELISA板,以杂交瘤细胞上清为一抗,以1∶2 500倍稀释的 HRP标记的羊抗鼠 IgA、IgM、IgG1、IgG2a、IgG2b、IgG3 为二抗 ,TMB 室温避光显色15 min,读取OD450nm。
1.4.4 单克隆抗体识别表位鉴定 利用DNAStar的Protein分析出的抗原性分布将目的蛋白序列分成几个小段分别合成多肽,该多肽由生工生物工程(上海)股份有限公司合成。将合成好的多肽按照说明书处理后包被96孔酶标板,用ELISA方法检测杂交瘤细胞上清识别的多肽部位。合成的多肽序列如下,见表1。
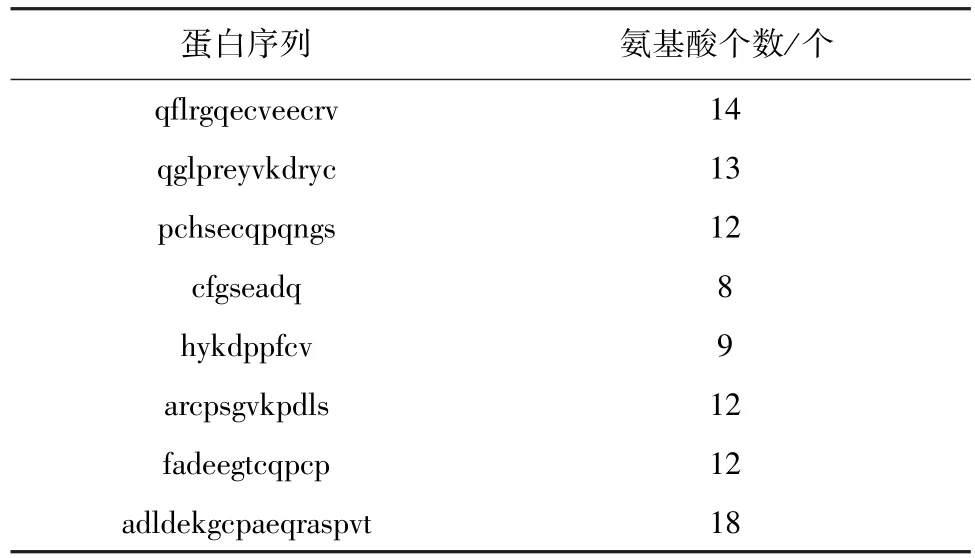
表1 合成犬her-2-ECD-4多肽序列
1.4.5 腹水制备和纯化 无菌液体石蜡注入小鼠腹腔,1周后将筛选过的阳性杂交瘤细胞注入小鼠腹腔,5×105个/d。7~10 d后小鼠腹部隆起,取腹水,离心去除油脂沉淀,测定效价。置-80℃保存。采用辛酸-饱和硫酸铵方法纯化抗体。
2 结果
2.1 犬her-2蛋白序列分析 犬her-2胞外区分析显示,犬的her-2胞外区氨基酸序列为1-652(见图1)。结合犬her-2胞外区三级结构建模(见图2),最终确定犬her-2-ECD-4氨基酸序列为cyplcahghc wgpgptqcvn csqflrgqec veecrvlqgl preyvkdryc lpchsecqpq ngsvtcfgse adqcvacahy kdppfcvarc psgvkpdlsf mpiwkfadee gtcqpcpinc thscadldek gcpaeqrasp vt共142个氨基酸。

图1 犬her-2蛋白质序列TMHMM分析

图2 犬her-2-ECD SWISS-MODLE三级结构建模
2.2 犬her-2-ECD-4蛋白理化性质分析 犬her-2-ECD-4蛋白理化性质分析显示,犬her-2蛋白在该区段半胱氨酸含量为14.1%,而脯氨酸含量则较低,为10.6%。等电点为5.25。它的不稳定指数为56.69。亲水性为-0.376,是亲水性蛋白(见表2)。
2.3 犬her-2-ECD-4表位预测 结合蛋白一级结构分析、二级结构分析及三级结构建模,通过对氨

表2 犬her-2-ECD-4蛋白理化性质分析
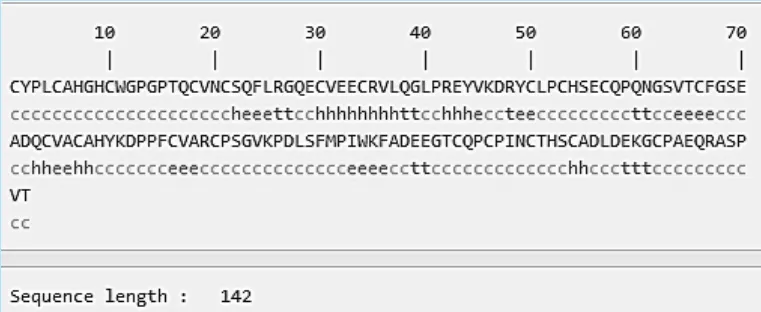
图3 犬her-2-ECD-4sopma二级结构预测,其中c为无规卷曲,t为β-转角
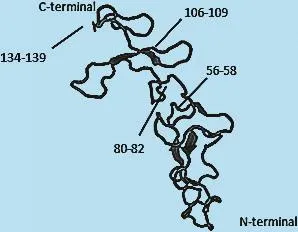
图4 犬与人her-2-ECD-4 SWISSMODLE三级结构建模
2.4 重组抗原鉴定 将重组蛋白进行Western Blot分析,显色后目的条带大小与预期符合,由图5可知重组蛋白与人免疫原Anti-ErbB-2抗体具有良好的反应性。

图5 犬her-2-ECD-4重组蛋白的Western Blot分析

表4 单克隆抗体表位鉴定
2.5 单克隆抗体Western Blot鉴定 用免疫印迹分析的方法,以犬乳腺肿瘤细胞系CHmm中提取的蛋白为抗原,各株杂交瘤细胞上清为抗体,人免疫原anti-ErbB-2为阳性对照,pet-32a(+)空载体为阴性对照进行分析,显色后结果如下图6。结果显示,本试验中获得的杂交瘤细胞株上清与anti-ErbB-2在同样的位置出现特异性条带,且空载体部分无条带,表明其为识别犬her-2的特异性抗体。
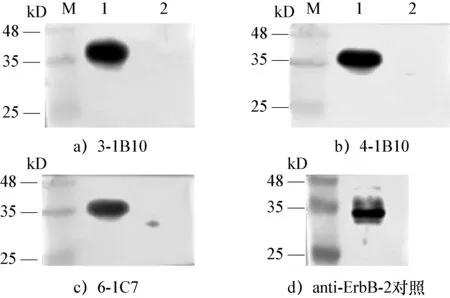
图6 单克隆抗体Western Blot
2.6 单克隆抗体亚类鉴定 用Southern Biotech公司的SBA ClonotypingTMSystem/HRP抗体亚类鉴定试剂盒,对所获得的3株单抗进行抗体亚类鉴定,结果如表3所示。

表3 MAb的亚类鉴定
2.7 单克隆抗体表位鉴定 用间接ELISA的方法,将合成的多肽对筛选出的杂交瘤细胞上清进行鉴定,结果发现,3-1B10和4-1B2均识别同一段多肽即hykdppfcv,6-1C7识别的多肽序列为pchsecqpqngs。如图表4。这两端多肽序列包含本文预测出的抗原表位 ykd(56-58)和 ecq(80-82)。
2.8 腹水效价测定及纯化 将得到的腹水从1∶100开始进行倍比稀释,用间接ELISA方法检测,以小鼠阴性血清作为阴性对照,阳性血清为阳性对照,P/N比值大于2.1的最大稀释倍数为其效价。见表5。

表5 腹水效价测定
将得到的腹水用辛酸-饱和硫酸铵方法进行纯化,经过纯化透析等过程后,将得到的抗体SDSPAGE检测,并用BCA试剂盒测其浓度,结果显示,其在25 kD左右有1条轻链,在48 kD-63 kD之间有一条重链,见图7,浓度测定结果显示其浓度为3.037 mg/mL。
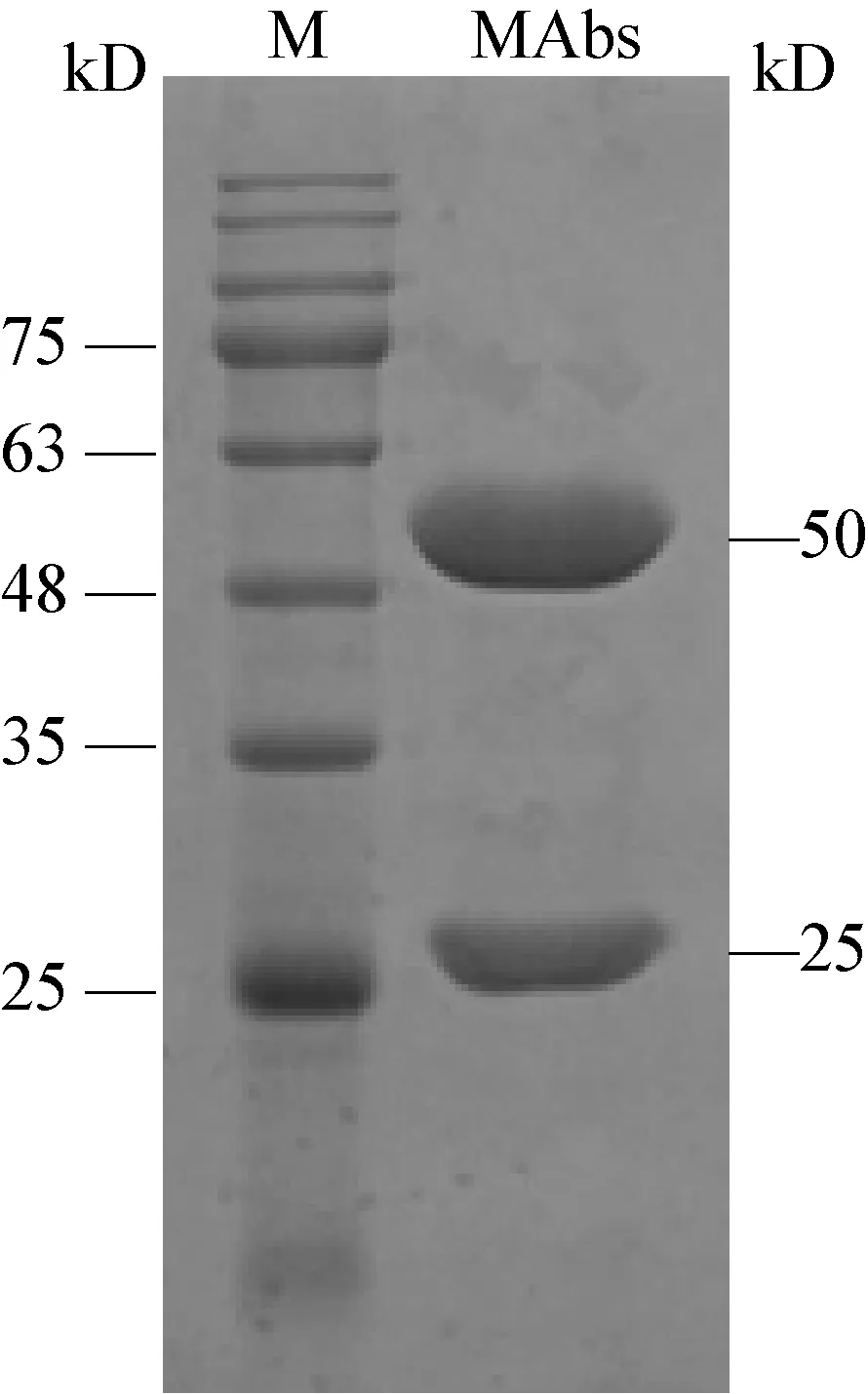
图7 抗犬her-2单克隆抗体SDS-PAGE
3 讨论
在人类医学中,利用抗体治疗和检测相关肿瘤疾病已经成为一种常见的对抗癌症的方法[5],其中,曲妥珠单抗(Trastuzumab)即是一个典型的例子。相比于人类医学中肿瘤靶向治疗手段的不断深入和发展,目前兽医上针对犬乳腺肿瘤还没有最佳的治疗方法,通常人类临床的治疗方案如被动免疫,于兽医上也没有实现[6]。在兽医学中,除了利用免疫组化、荧光原位杂交及Hercept Test试剂盒等方法检测临床犬乳腺肿瘤中her-2表达情况外,尚无蛋白信息学方面的分析。
生物信息学在预测蛋白质结构和功能以及确定蛋白质生物学特性等方面具有重要作用,已广泛应用于蛋白质抗原表位的分析预测[7]。在本研究中,用TMHMM Server 2.0分析NCBI上提供的犬her-2蛋白序列,犬her-2-ECD为1-652,比人该区域多了30个氨基酸。通过氨基酸序列的对比,我们得到了犬her-2-ECD-4的氨基酸序列。已知人her-2-ECD氨基酸序列中Ⅰ区和Ⅲ区上含有受体潜在配体结合位点,Ⅱ区和Ⅳ区富含半胱氨酸,参与同源二聚体和异源二聚体的形成[8],猜测犬的蛋白序列也具有相同的情况。在理化性质分析结果中可以看到犬her-2-ECD-4与人一样为富含半胱氨酸的区域,容易形成链与链之间的相互作用[9],结合二级结构分析,此区域中无规卷曲占比很大,为65.49%,而无规卷曲是易形成抗原表位的结构[10-11],另外其亲水性为-0.376,是亲水蛋白,在抗原蛋白制备时易于得到可溶性蛋白,方便后面的蛋白纯化工作,由此可见,该区域为制备犬her-2抗体的较理想抗原。
在实际应用中,抗原的表位仍需要具体的实验验证。本研究获得了3株能持续分泌抗体的杂交瘤细胞株,通过验证发现它们识别的多肽序列中含有本文预测的抗原表位序列,这一结果不仅一定程度上说明该实验获得了针对犬her-2的特异性单抗,且也说明了蛋白生物信息学分析方法可为该方向的实验研究提供基本的方向和思路。
目前,Trastuzumab在人医临床中已沿用多年,在此基础上的抗her-2疫苗也在临床试验中,如NeuVaxTM,CD8+T-cell-eliciting vaccine和AdHER2/neu dendritic cell vaccine[12-13]。目前报道过两种犬嵌合型抗体:一种是西妥昔单抗,是小鼠-人嵌合抗表皮生长因子受体抗体,另一种是利妥昔单抗样抗体,可靶向B细胞抗原分化簇[14-15]。但上述两种抗体成本太高,限制了其在兽医肿瘤学中的发展。Rungsipipat等人于实验中证实了人her-2抗体与犬乳腺肿瘤组织之间具有交叉反应[16],这说明her-2单抗作为检测或治疗手段应用于兽医临床的可行性,但人源性单抗可能会因其特异性和免疫原性引发用药动物过敏[17],所以人源性单抗用于犬乳腺肿瘤的治疗可能不会获得较好的治疗效果,另外犬her-2过表达与犬乳腺肿瘤发展的关系没有人那么明确,事关癌症相关标记物和通路时,由人类医学过渡到兽医学需谨慎从事。犬乳腺肿瘤中her-2的诊断和生物学作用以及其是否作为乳腺癌her-2过表达模型均需要进一步探究[18]。那么针对犬的her-2单抗就具有了研究价值。

