低锌饮食对大鼠二次打击惊厥模型远期惊厥阈和锌转运体3的影响
陈妮娜, 倪宏
(苏州大学儿科临床研究院, 江苏 苏州 215000)
癫痫是大脑神经元突发性的异常放电,导致短暂大脑功能障碍的一种慢性疾病,其特征为反复发作、自发发作。锌是体内数百种酶和其他蛋白质的重要辅助因子,参与细胞分化、增殖、凋亡等过程[1]。锌在脑内的分布不均衡,在前脑某些特定的部位浓度最高,如海马、杏仁核和皮层[2-3]。脑内约90%的锌与金属硫蛋白结合,另外约10%的游离锌存在于突触前囊泡中,在信号传导过程中发挥重要作用。癫痫的发作与锌在体内的代谢异常密切相关,有学者认为癫痫患者血液或者脑脊液中的锌含量增高[4-5],但也有学者报告是降低的[6-7]。因此,研究锌代谢异常在癫痫的发作机制中具有重要意义。
锌转运蛋白(ZnTs)家族有10个成员,能够促进细胞质锌的外流以及使锌在各细胞器内区室化改变,从而降低细胞质锌的含量,对锌稳态的维持至关重要[8]。ZnT3表达在含锌神经元的突触小泡膜上,并将锌离子转运到突触小泡内。ZnT3表达量变化直接影响突触小泡游离锌离子的浓度。本实验通过腹腔注射氯化锂-匹罗卡品制备大鼠癫痫持续状态模型,以低锌饮食喂养2周,观察大鼠二次打击惊厥阈及死亡率,检测大鼠大脑皮层ZnT3表达量,以探讨低锌饮食对大鼠二次打击惊厥模型远期惊厥阈、死亡率和ZnT3的影响。
1 材料与方法
1.1 实验动物
60只27日龄(P27)健康SD大鼠,雄性,体重80~100 g,购自昭衍(苏州)新药研究中心有限公司,动物许可证号:SCXK(苏)2018—0006。在室温25 ℃,湿度45%环境喂养,每日12 h光照,自由进食和饮用去离子水。
1.2 主要药品和试剂
氯化锂(美国Sigma公司),实验时取127 mg溶于10 mL生理盐水中备用。匹罗卡品(美国Sigma公司),实验时取320 mg溶于10 mL生理盐水中备用。氢溴酸东莨菪碱(Scopolamine hydrobromide,苏州氩氪氙贸易有限公司),实验时取1 mg溶于10 mL生理盐水中备用。青霉素(华北制药有限公司);ZnT3兔多克隆抗体(1 ∶1 000,Synaptic Systems公司);羊抗兔IgG(联科生物科技公司);锌测定试剂盒(世纪沃德生物科技公司)。
1.3 大鼠惊厥持续状态模型的建立
用于制备惊厥模型的雄性成年SD大鼠40只,于P27腹腔注射氯化锂(127 mg/kg),24 h后即P28腹腔注射氢溴酸东莨菪碱(1 mg/kg),以减少外周胆碱能反应,30 min后腹腔注射匹罗卡品(320 mg/kg)诱导癫痫发作。按照Racine分级[9],将大鼠行为分为Ⅰ-Ⅴ级,若给药后大鼠痫性发作未到达Ⅳ级,则视为诱导失败。
1.4 动物分组与饮食干预
将60只P27健康雄性SD大鼠随机分为对照组、低锌饮食组、惊厥组、惊厥低锌饮食组,其中对照组和低锌饮食组各10只,惊厥组和惊厥低锌饮食组共有备用大鼠40只,制备癫痫持续状态模型成功的大鼠随机分配到2组中。前2天(即P27、P28)各组均予常锌饮食(锌44 mg/kg)喂养,致惊厥后对照组和惊厥组继续予常锌饮食喂养,低锌饮食组和惊厥低锌饮食组予低锌饮食(锌 2.7 mg/kg)喂养。喂养2周后予青霉素(剂量为每天5.1×106U/kg)二次打击,记录青霉素注射后大鼠首次出现惊厥发作的时间(惊厥阈)、死亡时间及死亡率,观察时间为1 h。观察结束后取脑组织,冰上迅速分离大脑皮层,装进已标记的EP管中,放入-80 ℃冰箱冻存。
1.5 体重及血清锌浓度检测
制备惊厥模型后,各组大鼠隔日称体重。2周后各组大鼠麻醉后心脏采血, 3 000 r/min离心10 min后取上清液于已标记的EP管中。按锌测定试剂盒说明书,取12 μL样品(血清、锌标准液及去离子水作为空白),加入200 μL的试剂一37℃水浴5 min,于570 nm处读取光密度D1;加入试剂二水浴5 min后读取D2,△D=D2-D1。样本浓度=(△D样品/△D标准)×标准品浓度。
1.6 蛋白质印迹法检测大脑皮层ZnT3蛋白表达
取各组大鼠大脑皮层组织,在冰上充分研磨后加入蛋白裂解液,在超声细胞破碎仪中低温匀浆,15 000 r/min 4 ℃离心30 min,取上清液。用蛋白质定量试剂盒(BCA法)测定蛋白浓度,配平。制备10%的SDS-PAGE下层分离胶和5%的上层压缩胶,上样体积10 μL,电泳90 min分离ZnT3,100 V转膜60 min,5%脱脂奶粉封闭2 h。加兔多克隆一抗ZnT3(1 ∶1 000),4 ℃孵育过夜,加入羊抗兔IgG室温下孵育1.5 h,最后加入ECL化学发光液,成像仪扫描结果。以Image J软件计算各条带的灰度值,以β-微管蛋白为内参,以ZnT3与β-微管蛋白灰度比值作为ZnT3蛋白相对表达量。
1.7 统计学处理

2 结果
2.1 氯化锂-匹罗卡品诱导惊厥发作的行为特点
惊厥组和惊厥低锌饮食组大鼠于腹腔注射匹罗卡品后20~30 min即出现相应的外周胆碱能反应,主要表现为立毛、呆滞、流涎、结膜充血等,同时或者先后出现刻板动作,主要表现为面部抽搐、反复咀嚼、点头动作、湿狗样抖动,同时或者交替出现单侧或者双侧的前肢阵挛,后期反复双侧前肢阵挛,大鼠出现直立行为,偶可见跌倒发生,部分大鼠以Racine Ⅳ级或Ⅴ级发作为首发表现。对照组和低锌饮食组予生理盐水代替氯化锂、匹罗卡品腹腔注射,未出现以上发作行为。本实验中达到Ⅳ级及以上发作的大鼠有29只,诱导成功率为72.5%(29/40)。诱导成功的老鼠中有4只因全身强直抽搐当场死亡,剩余25只随机分入惊厥组和惊厥低锌组,有3只在持续惊厥后第2天死亡,总死亡率为24.1%(7/29)。惊厥组及惊厥低锌饮食组各随机选出10只进行后续实验,剩余2只大鼠备用。
2.2 4组大鼠不同日龄体重比较
惊厥前各组大鼠体重比较差异无统计学意义。惊厥第3天、5天、7天惊厥组、惊厥低锌饮食组体重明显低于对照组(P<0.05);惊厥第9天惊厥低锌饮食组体重明显低于对照组(P<0.05);惊厥第11天、13天、15天各组大鼠体重比较差异无统计学意义。见表1。表明惊厥急性期大鼠体重明显降低,后逐步恢复增长。
2.3 血清锌浓度比较
对照组、低锌饮食组、惊厥组、惊厥低锌饮食组大鼠血清锌浓度分别为(39.04±5.74)、(34.53±7.12)、(31.35±6.38)、(29.89±7.11)μmol/L,差异有统计学意义(F=3.755,P=0.019)。惊厥组和惊厥低锌饮食组血清锌浓度明显低于对照组,差异有统计学意义(P<0.05);低锌饮食组与对照组、惊厥低锌饮食组与惊厥组比较,差异均无统计学意义(P>0.05)。表明大鼠持续惊厥后2周血清锌浓度明显降低。
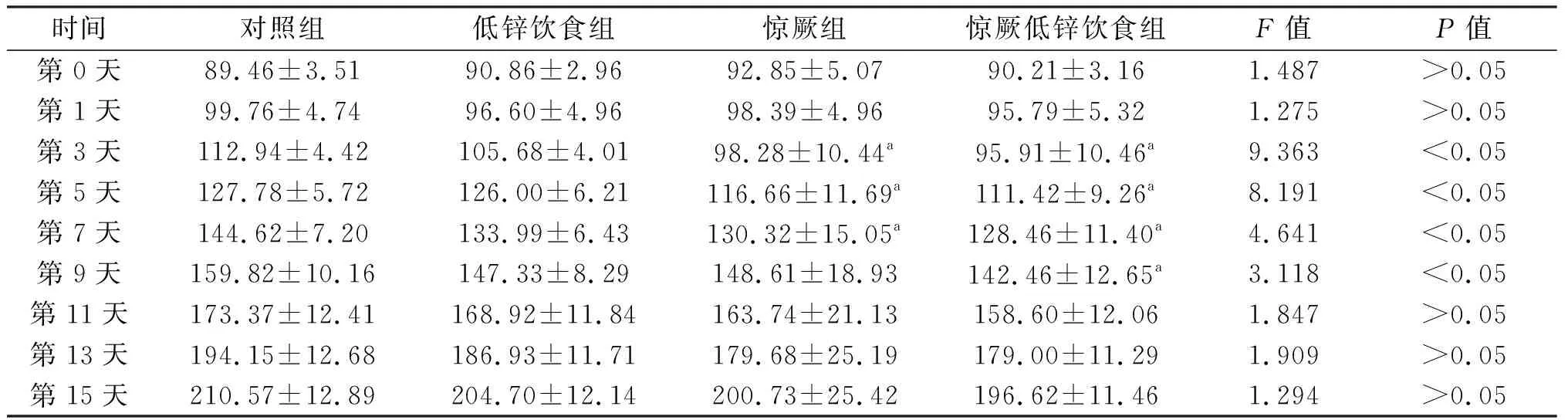
表1 各组大鼠不同日龄体重比较 g,n=10
a:P<0.05,与对照组比较
2.4 二次打击后惊厥发作的行为特点及惊厥阈
2.4.1 二次打击惊厥发作的行为特点 喂养第15天大鼠腹腔注射青霉素后约20 min陆续出现惊厥发作,表现为活动增多、咀嚼、节律性点头、甩尾,单双侧的前肢阵挛、抽搐伴或不伴后肢直立,不协调爬行,严重者可出现全身强直—阵挛发作,四处窜逃并伴有尖叫,最后失去平衡而跌到,甚至死亡。结果显示:各组大鼠二次打击后均出现惊厥发作,惊厥发生率为100%。
2.4.2 惊厥阈比较 对照组、低锌饮食组、惊厥组、惊厥低锌饮食组大鼠惊厥阈分别为(43.84±5.40)、(35.02±6.81)、(35.22±6.56)、(27.96±6.83)min,差异有统计学意义(F=10.222,P<0.05)。低锌饮食组、惊厥组、惊厥低锌饮食组惊厥阈明显低于对照组(P<0.05),惊厥低锌饮食组明显低于低锌饮食组和惊厥组(P<0.05)。表明大鼠持续惊厥后2周再次受到打击,易感性明显增加;且低锌饮食喂养2周亦可使二次打击时的易感性增加,二者具有增强效应。
2.5 二次打击后大鼠生存时间及生存率比较
对照组、低锌饮食组、惊厥组、惊厥低锌饮食组大鼠的生存时间分别为(57.50±1.73)、(52.06±3.22)、(46.98±4.25)、(36.29±3.89)min,见图1。经log-rank法检验,惊厥低锌饮食组生存时间明显低于对照组和低锌饮食组(χ2分别为9.994、6.707,P<0.05);低锌饮食组与对照组、惊厥低锌饮食组与惊厥组相比,差异无统计学意义(χ2分别为1.204、2.812,P>0.05)。表明低锌联合惊厥处理能明显减少二次打击后的生存时间,二者互为增强作用。各组生存率分别为80%、60%、50%、20%,经Fisher精确检验,差异无统计学意义(P=0.073)。

图1 各组大鼠二次打击后生存时间比较
2.6 ZnT3在各组大鼠大脑皮层的表达
蛋白质印迹检测结果显示,各组大鼠大脑皮层ZnT3蛋白表达的总体差异有统计学意义(F=34.646,P<0.05)。低锌饮食组明显低于对照组(P<0.05),惊厥低锌饮食组明显低于惊厥组(P<0.05),表明低锌饮食喂养2周可使大鼠大脑皮层ZnT3蛋白表达降低;惊厥组与对照组、惊厥低锌饮食组与低锌饮食组比较均明显降低(P<0.05),表明大鼠持续惊厥后2周可使大鼠大脑皮层ZnT3蛋白表达降低。见图2。
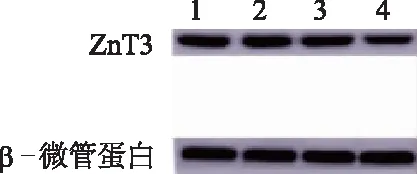

1: 对照组; 2: 低锌饮食组; 3: 惊厥组; 4: 惊厥低锌饮食组。*:P<0.05,与对照组比较;#:P<0.05,与惊厥组比较;△:P<0.05,与低锌饮食组比较
图2各组大鼠大脑皮层ZnT3蛋白表达
3 讨论
锌多分布于海马的齿状回苔藓纤维突触的囊泡中,在神经元活动时,释放到突触间隙,调节突触传递。锌不仅直接结合突触后受体,还能进入突触后神经元发挥多种生理功能。锌能够发挥抑制或促进神经元兴奋性的作用,提示可能具有促惊厥和抗惊厥特性。ZnT3对锌具有高度专一性,负责将锌转运至突触囊泡中,再释放入突触间隙发挥调节功能[10]。
本实验低锌饲料喂养2周大鼠尚未出现明显的缺锌症状,如脱毛、脱皮、红肿、食欲不振等,体重增长未出现明显缓慢,血清锌浓度亦未明显降低。说明低锌饲料喂养2周,大鼠尚处于代偿期,体内血清锌浓度仍较为稳定。惊厥后大鼠血清锌浓度和惊厥阈明显降低;惊厥联合低锌处理可明显降低血清锌浓度、惊厥阈及生存时间。表明缺锌可增加癫痫发作的易感性。
锌缺乏能增加神经损伤、促进神经元死亡,且可能是通过调节ZnT3的表达量而发挥作用。在海人酸诱导的癫痫模型中,通过原子光谱分析发现模型组动物海马和大脑内其他区域的锌离子减少[11];ZnT3敲除小鼠比正常小鼠更容易受到红藻氨酸诱导的癫痫发作[12],且海马苔藓纤维锌离子染色完全缺如;减少突触锌可能有助于神经元兴奋过度,增加热性惊厥的风险[13]。另有研究表明了矛盾的结果,在刺激前反复注射膜透性锌螯合剂可降低点燃诱发的癫痫发作和后放电的持续时间[14]。锌发挥保护作用可能需要一个合适的浓度范围,超出这个范围则发挥神经毒性作用。
本研究表明缺锌能增加癫痫发作的易感性,这种现象可能是低锌饮食通过下调ZnT3的表达,破坏大脑锌稳态导致的。本实验为癫痫发生与锌的关系提供了新的切入点,但尚缺高锌饮食干预来探究锌的合适浓度范围,仍需更多的研究来揭示锌与癫痫之间的关系及相关的具体机制。

