急性单核细胞白血病相关抗原基因MLAA-22全长的克隆及生物信息学分析
筛选具有临床应用价值的肿瘤抗原基因是开展免疫治疗的前提,也是肿瘤免疫治疗研究中的关键问题。本实验组前期构建了具有单核细胞分化特点的人U937细胞定向克隆cDNA表达文库,并采用急性单核细胞白血病患者的混合血清对所建文库进行免疫筛选,获得了急性单核细胞白血病多个肿瘤相关抗原[1]。MLAA-22是其中具有代表性的基因之一,由于从cDNA文库中筛选得到的基因一般都是编码基因的部分片段,前期仅采用电子克隆的方法拼接获得了cDNA全长[2]。本研究以建库所用人U937细胞系为对象,应用RACE法克隆MLAA-22基因的全长cDNA序列,并对MLAA-22序列进行生物信息学分析预测,为进行后期的功能研究提供了可靠的数据平台。
1 材料与方法
1.1 材料及试剂
人急性单核细胞白血病细胞株U937购自中科院上海细胞库。细菌菌株:大肠杆菌DH5α购自TIANGEN生物公司。质粒:pMD-18T载体,购自Takara公司。T4 DNA连接酶、Taq DNA Polymerase、High Fidelity PrimeScript RT-PCR、DNA凝胶回收试剂盒、High Fidelity PrimeScript RT-PCR Kit、5'-Full RACE Kit、3'-Full RACE Kit均购自Takara公司;质粒快速提取试剂盒购自TIANGEN公司。
1.2 实验方法
1.2.1 细胞培养 U937细胞常规培养于含10%的胎生血清,100 μ/mL青霉素和100 μ/mL链霉素的RPMI1640培养液中,培养条件为37 ℃,5%CO2,饱和湿度。定期观察细胞生长情况,当细胞处于对数生长期时,用于实验研究。
1.2.2 RACE实验 5'-Full RACE:根据从cDNA文库中已得到的MLAA-22基因(AY288965)的cDNA序列,使用引物设计专用软件分别设计其下游特异性引物GSP2(外侧引物):5'-ACTGAGCTTTGGCAGCCGATACAAT-3',以及下游特异性引物GSP3(内侧引物): 5'-CTCAATAAGGCAGTTTCGGTGGTAT-3';此引物由Takara公司合成。按厂家提供的试剂盒说明书进行MLAA-22基因的5'-Full RACE实验,以扩增其cDNA的5'端未知序列。
3'-Full RACE:根据从cDNA文库中已得到的MLAA-22基因的cDNA序列,使用引物设计专用软件分别设计其上游特异性引物GSP1(外侧引物):5'-ACCTTAACTTGGTGCTACCCTGTC-3',以及上游特异性引物GSP2(内侧引物): 5'-TGGTTGCCCAGGTAATCAAAGA-3';此引物由Takara公司合成。按厂家提供的试剂盒说明书进行MLAA-22基因的3'-Full RACE实验,以扩增其cDNA的3'端未知序列。测序:将5'RACE及3' RACE扩增的PCR产物用DNA凝胶回收试剂盒回收,回收产物直接克隆入pMD-18T载体,转入大肠杆菌DH5α,扩增,分别选取3个阳性克隆,送Takara公司测序。
1.2.3 MLAA-22基因全长cDNA序列的克隆 为验证新得到的MLAA-22基因全长cDNA序列,根据从上步RACE实验中已得到的新序列,使用引物设计专用软件分别设计MLAA-22上游特异性引物:5'-AAGAAAGAATATCAGGAGCA-3,以及下游特异性引物: 5'-ACAGCAGAAAAAATAGGCAC-3';以U937细胞系为研究对象,按厂家提供的试剂盒说明书进行MLAA-22基因的RT-PCR实验,扩增MLAA-22基因全长cDNA序列。测序:将扩增得到的PCR产物用DNA凝胶回收试剂盒回收,回收产物直接克隆入pMD-18T载体,转入大肠杆菌DH5α,扩增,分别选取3个阳性克隆,送Takara公司测序。
1.2.4 生物信息学分析 通过美国国家生物技术信息中心(NCBI)MEDLINE网检索MLAA222基因的相关信息,包括同源比对、染色体的定位、核酸序列比对、结构功能域分析、基序(motif)分析等,对其理化性质、基本功能和抗原性做大致了解。
2 结果
2.1 5'-Full RACE实验结果
5'RACE 扩增产物胶回收产物纯化后进行琼脂糖凝胶电泳,可见一大小约550 bp左右的清晰条带片段(图1)。
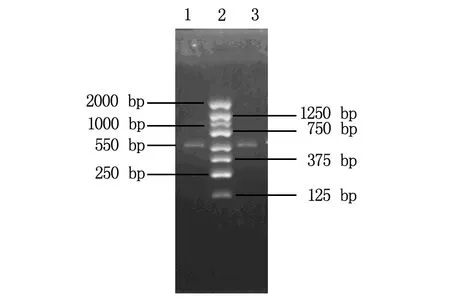
1,3均为5'RACE产物;2为marker。图1 5'RACE产物电泳图
TA克隆后通过PCR鉴定阳性克隆送测序,测序结果结果经过BLAST比对除去载体序列及与原MLAA-22重叠的部分后,在5'端延伸了424 bp。
2.2 3'-Full RACE实验结果
3'RACE扩增产物胶回收产物纯化后进行琼脂糖凝胶电泳,可见一大小约800 bp左右的清晰条带(图2)。
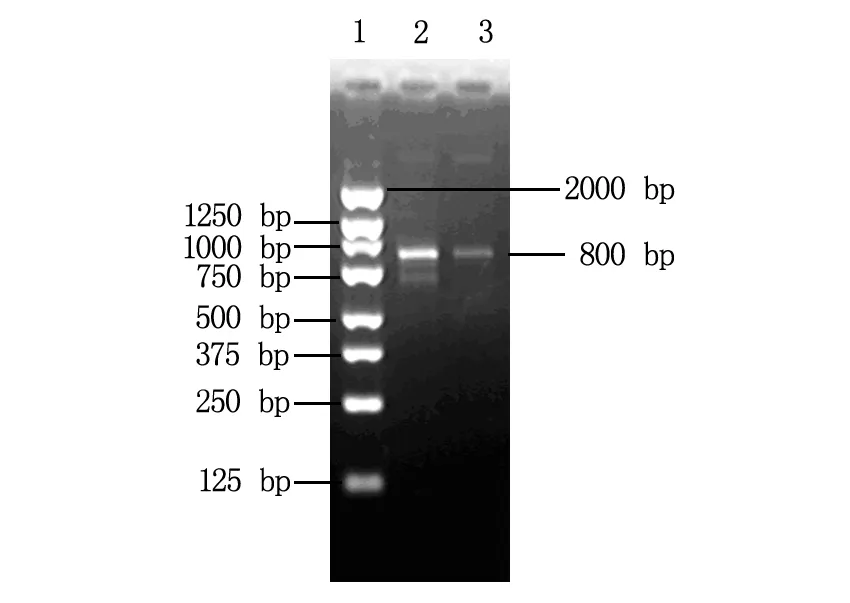
1为marker;2,3均为3'RACE胶回收产物。图2 3'RACE产物电泳图
经TA克隆后通过PCR鉴定阳性克隆送测序,测序结果经过BLAST比对除去载体序列及与原MLAA-22重叠的部分后,在5'端延伸了606 bp。
2.3 MLAA-22基因全长cDNA序列的克隆
经3'及5'RACE扩增后得到MLAA-22 cDNA全长为3070 bp,为验证全长序列的可靠性,对全长序列分3段扩增,包含重叠部分,扩增产物经凝胶电泳后分别可见大小约2 kb、400 bp及600 bp的片段(图3),TA克隆测序后经过拼接除去重叠部分后序列与RACE后得到的序列高度同源,验证了MLAA-22 cDNA的可靠性。全长扩增产物400 bp产物凝胶电泳图(图3b);全长扩增产物600 bp产物凝胶电泳图(图3c)。
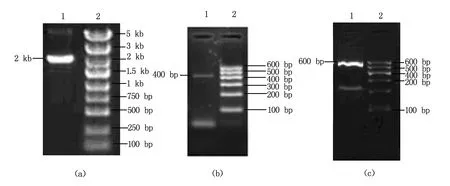
1为扩增产物,2为marker;a为MLAA-22全长扩增产物电泳图;b为全长扩增产物400 bp电泳图;c为全长扩增产物600 bp产物凝胶电泳图。图3 MLAA-22全长扩增电泳图
2.4 MLAA-22的生物信息学分析
2.4.1 基于核苷酸序列的分析结果 编码区序列及所编码的蛋白:新获MLAA-22的全长cDNA序列包含3067 bp核苷酸,用NCBI网站(www.ncbi.nlm.nib.gov)的ORF Finder软件分析,其有完整的ORF框,编码1个含有701个氨基酸残基的蛋白质。采用BLAST与 genome比对结果:经过与最新公布的人类基因组序列比对分析发现,MLAA-22定位于17q11.2基因包含12个外显子和11个内含子。 序列同源性分析:新获MLAA-22的全长cDNA序列包含3067bp,用NCBI的Blast程序比对人基因组数据库后发现MLAA-22定位于17q11.2,基因包含12个外显子和11个内含子。生物信息学预测其有完整的ORF框,编码1个含有701个氨基酸残基的蛋白质。在17q11.2基因座位上还存在人类假定基因KIAA0100及人乳腺癌过表达基因BCOX1(breast cancer overexpressed gene 1,BCOX1)(GenBank:AY943906)。人假定基因KIAA0100 mRNA全长7456 bp,预测的编码蛋白序号为Loc9703,有关KIAA0100基因及蛋白的功能目前尚不明确。
2.4.2 基于氨基酸序列的生物信息学分析结果 MLAA-22的理化性质:氨基酸数目:701;分子量:80529.7 Dolton;理论等电点PI:6.09;分子式:C3532H5658N1010O1079S31;原子总数:11310。
不稳定系数:MLAA-22的不稳定系数是52.18,当1个蛋白质的不稳定系数>40时,提示该蛋白质不稳定,因此提示MLAA-22在体内不稳定。
蛋白酶识别位点预测结果:通过Peptidecutter软件预测了对MLAA-22有剪切作用的酶及其可能的剪切位点,结果发现Tobacco etch virus protease、Thrombin、Iodosobenzoic acid GranzymeB、Hydroxylamine、Factor Xa、Enterokinase、BNPS-Skatole及Caspase2-10对MLAA-22均无剪切作用。
抗原模拟表位预测结果:HLA_Bind和SYFPEITHI程序对MLAA-22 MHC Ⅰ及MHC Ⅱ限制性抗原肽预测结果如下:HLA Peptide Binding Predictions 程序对MLAA-22MHC-I限制性抗原9肽预测结果(表1)。
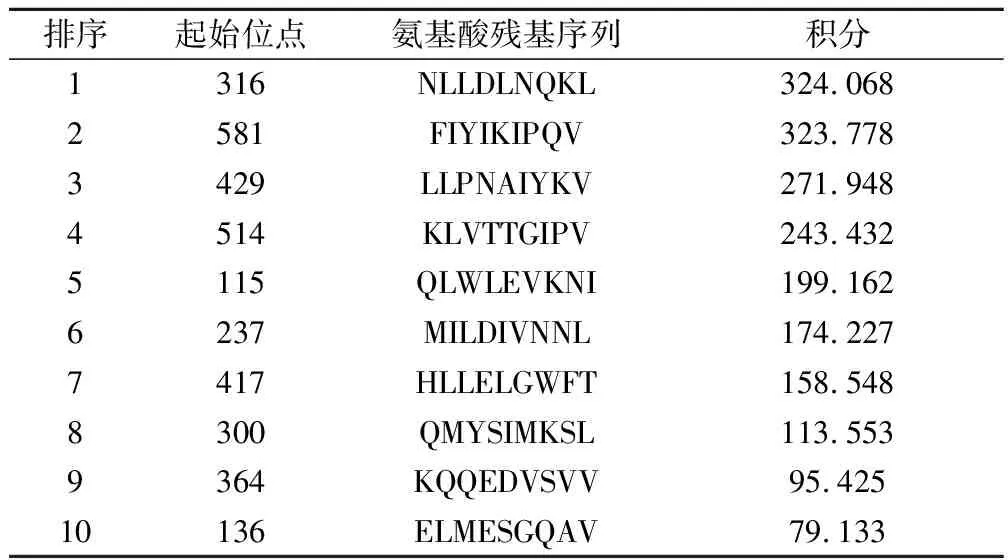
表1 MLAA-22和HLA-A_0201A结合的九肽预测结果
SYFPEITHI程序对MLAA-22 MHC Ⅱ分子限制性抗原15肽预测结果(表2)。

表2 MLAA-22和HLA-DRB1*0301(DR17)结合的15肽预测结果
3 讨论
肿瘤免疫治疗的关键和先决条件就是要寻找肿瘤特异性抗原。MLAA-22是实验组前期采用SEREX方法筛选出的具有代表性的M5肿瘤相关抗原基因之一[1],采用PCR在多种白血病细胞系中检测MLAA-22的表达发现mRNA表达均有不同程度升高,尤以急性单核细胞白血病最为显著[3]。由于从cDNA文库中筛选得到的基因一般都是编码基因的部分片段,前期通过硅片克隆的方法拼接所得MLAA-22cDNA全长约2Kb[2],但由于生物大分子结构和功能的复杂性,许多分析软件的输结果存在较大的偏差,因而对计算机模拟的结果尚需要回到实验室进一步证实,要进行新基因的生物学功能和医学意义的研究,必须首先克隆获得编码基因的cDNA全长序列。 本研究采用基于PCR的cDNA末端快速扩增法RACE技术,在原有MLAA-22 cDNA序列的基础上分别在3'及5'端延长了424bp和609bp,经过拼接去除重叠部分序列,新获得MLAA-22全长3067bp,针对新获得的全长设计引物进行PCR扩增,验证了cDNA全长的可靠性。 随后在此序列基础上对MLAA-22的结构及功能进行了一系列的生物信息学分析,首先采用ORF Finder软件对全长进行分析,发现其有完整的ORF框,编码1个含有701个氨基酸残基的蛋白质。经过NCBI BLAST比对发现MLAA-22定位于17号染色体,在此基因座位上存在人类假定基因KIAA0100及人乳腺癌过表达基因BCOX1(GenBank:AY943906)。人假定基因KIAA0100 mRNA全长7456bp,预测的编码蛋白序号为Loc9703,有关KIAA0100基因及蛋白的功能目前尚不明确。Song等[4]首次采用SAGE(serial analysis of gene expression,SAGE)技术对乳腺癌相关基因进行研究,获得了BCOX1(breast cancer overexpressed gene 1)基因,深入的研究发现此基因在乳腺癌组织中高表达而在正常的乳腺上皮组织中并不表达,且表达水平与疾病的进展密切相关。Liu等[5]检测了491例的乳腺浸润性导管癌患者肿瘤组织及癌旁组织中BCOX1mRNA表达发现59.5%的患者高表达BCOX1,且BCOX1高表达与患者的OS呈负相关,可能是乳腺癌治疗的潜在靶点。近期一项关于前列腺癌的研究[6]也发现下调miR-195的表达可导致BCOX1表达升高以致前列腺癌发生转移,因此BCOX1可能与多种肿瘤发生、发展相关。 通过BLAST发现BCOX1与KIAA0100基因二者高度同源,但同与KIAA0100基因高度同源的BCOX1与MLAA-22却没有任何同源性,进一步分析发现BCOX1的编码区(CDS)与MLAA-22的CDS在基因组序列上相距大于15kb的距离,所以二者序列无同源性也就得到了合理的解释。这一现象也提示我们:KIAA0100基因实际上可能包含多种功能基因,但详情未知。 通过BLAST比对我们发现:MLAA-22全长序列的350-3070 bp与KIAA0100 mRNA完全匹配,1-349 bp与KIAA0100 mRNA不匹配,这一段序列虽不属於ORF,但它属于MLAA-22的5'UTR(untranslated regions,UTR)。选择性剪接(alternative splicing,AS)又称可变剪接,是指从1个mRNA前体通过选择不同的剪接位点进行不同的剪接方式而产生不同的mRNA剪接异构体的过程。它是调节基因表达和产生蛋白质组多样性的重要机制,也是导致人类基因和蛋白质数量较大差异的重要原因。在胚胎干细胞中AS 对细胞多态性也有重要作用[7]。据估计大约有35%~65%的人类基因具有可变剪接特性,主要涉及参与信号传导和表达调节等复杂过程,如受体、信号传导通路(凋亡)及转录因子等基因[8-9]。如CD44表达异常与肿瘤的发生发展以及预后都密切相关,临床资料显示CD44 的剪接变异体(CD44v)在各种肿瘤中被发现,且相同的肿瘤中会有多种CD44v 的协同参与[10]。由此推测MLAA-22可能在5'UTR区发生了选择性剪接,参与了MLAA-22表达的调控,后期需进一步实验验证。
在MLAA-22酶切位点分析结果提示:MLAA-22存在大量的Proteinase K的酶切位点,蛋白激酶催化蛋白质磷酸化从而改变其活性,蛋白激酶是细胞信号通道中起化学修饰作用的成员,参与多种细胞功能诸如
细胞生长、分裂、分化、细胞间相互作用、细胞与细胞外基质相互作用等调控。这从1个角度提示MLAA-22编码的蛋白可能在细胞的生长、增殖和分化中具有一定的作用。 MLAA-22 cDNA全长3067 bp,染色体定位于17q11.2。综合对于MLAA-22的生物信息学预测结果,结合MLAA-22来源于急性单核细胞白血病细胞U937的cDNA文库,且在M5中特异性高表达等现象推测MLAA-22可能和急性单核细胞白血病的发生、发展密切相关,值得进一步深入研究。

