CD3+、CD4+和CD8+ T细胞Vβ亚家族中PD-1免疫表型检测方法的建立*
陈少华, 黄静颖, 谭家雄, 陈友纯, 钟 隽, 卢育洪, 郁 志, 李扬秋,
(暨南大学 1基础医学院血液学研究所, 2附属第一医院血液科, 广东 广州 510632)
程序性细胞死亡蛋白1(progammed cell death protein 1,PD-1; 又称CD279)是CD28家族成员的一种免疫球蛋白家族I型跨膜蛋白,参与了程序性细胞死亡过程[1-2]。正常情况下,PD-1与其配体PD-L1(又称CD274)结合从而抑制活化T细胞的功能,维持外周T细胞对自身抗原的免疫耐受,防止自身免疫性疾病的发生。PD-1主要表达于活化的T细胞表面,近几年研究发现,PD-1在多种实体瘤T细胞中过表达,同时与高表达于肿瘤细胞表面的配体结合,能抑制T细胞的功能从而促进肿瘤免疫逃逸机制。而在血液肿瘤中也发现了PD-1高表达,多数研究认为其主要表达于CD8+T细胞上,导致CD8+T细胞的耗竭和失能[3-5]。由于不同的T细胞谱系行使功能有所不同,为了更好地确定PD-1在T细胞谱系中的分布,我们采用流式细胞技术,建立PD-1在CD3+、CD4+和CD8+T细胞受体(T-cell receptor,TCR)Vβ 24个亚家族中的分布特点的检测方法,为进一步了解白血病和肿瘤病人等免疫抑制状态提供参考资料。
材 料 和 方 法
1 样本资料
本研究收集了10例健康成人志愿者外周血,男性6例,女性4例,中位年龄26岁,样本来自本研究所健康献血者,样本的采取已告知志愿者,并通过医院伦理委员会批准。
2 外周血单个核细胞(periphral blood mononu-clear cells, PBMC)提取
EDTA抗凝管采集受试者外周静脉血4~8 mL,利用人外周血淋巴细胞分离液(Ficoll配制)密度梯度离心分离PBMC,用细胞计数板计数细胞备用。
3 流式细胞术检测
3.1单细胞悬液的制备 准备9只干燥流式管,分别标注为同型管-ISO及A~H。将1×106个PBMC加入每只管中,制成单细胞悬液。
3.2抗体混悬液的配制
3.2.1同型抗体混悬液 1.5 mL 离心管中加入20 μL细胞染色缓冲液后,根据抗体说明书分别加入推荐剂量的CD45、CD3、CD4、CD8抗体和PE-Cy7-isotype control,充分混匀备用。
3.2.2全染抗体混悬液 1.5 mL 离心管中加入20 μL 细胞染色缓冲液后,根据抗体说明书分别加入推荐剂量的CD45-APC、CD3-Alexa Fluor®700、CD4-eFluor® 450、CD8-Percp-Cy5.5和PD-1-PE-Cy7,充分混匀备用。
3.3流式细胞术上机前准备 分别将同型抗体混悬液和全染抗体混悬液分别加入同型管-ISO和A~H流式管,充分混匀;按照IOTest® Beta Mark TCR Vβ Repertoire Kit (Beckmann Coulter; 该试剂盒一共8管,共包含24个TCR Vβ亚家族,每一管均为FITC和PE偶联的复合抗体,标为A~H,每一管复合抗体包含3个TCR Vβ亚家族的抗体)说明书,同型流式管不加任何TCR Vβ偶联的流式抗体,A~H管依次加入推荐剂量的流式抗体,充分混匀,室温避光孵育15~20 min。加入2~3 mL细胞染色缓冲液,重悬细胞,300×g转速下离心5 min后去除上清液。加入300~500 μL 细胞染色缓冲液重悬细胞,待上机。
3.4流式细胞术分析 采用BD FACSVerse流式细胞仪(BD Biosciences)进行上样检测,先使用未经染色的血细胞悬液调整仪器电压后,分别使用FITC、APC-H7、Percp-Cy5.5、BV510、PE-Cy7、Alexa Fluor®647、PE和Pacific Blue单阳管,调整各荧光之间的荧光补偿。至少收集100 000个CD3+细胞进行分析,收集后的原始数据采用FlowJo软件(Becton,Dickinson and Company)进行分析。TCR Vβ亚家族流式检测结果参考IOTest® Beta Mark TCR Vβ Repertoire Kit所提供的正常人TCR Vβ亚家族分布频率数据(Quick Reference Card数据)。
结 果
在健康成人的检测中,CD3+CD4+和CD3+CD8+T细胞亚群中检测的24个TCR Vβ亚家族总和,符合试剂盒所提供的Quick Reference Card数据。10例健康成人在CD3+、CD3+CD4+和CD3+CD8+T细胞中的分布情况见图1,健康成人在CD3+T细胞中主要优势利用Vβ2、Vβ3、Vβ8、Vβ9、Vβ5.1、Vβ13.1和Vβ13.2;而在CD3+CD4+T细胞中的优势利用主要集中在Vβ2、Vβ3、 Vβ8、Vβ9、Vβ5.1和Vβ13.1等亚家族;在CD3+CD8+T细胞中的优势利用则在Vβ1、Vβ2、Vβ3、Vβ9、Vβ13.1和Vβ13.2等亚家族中。
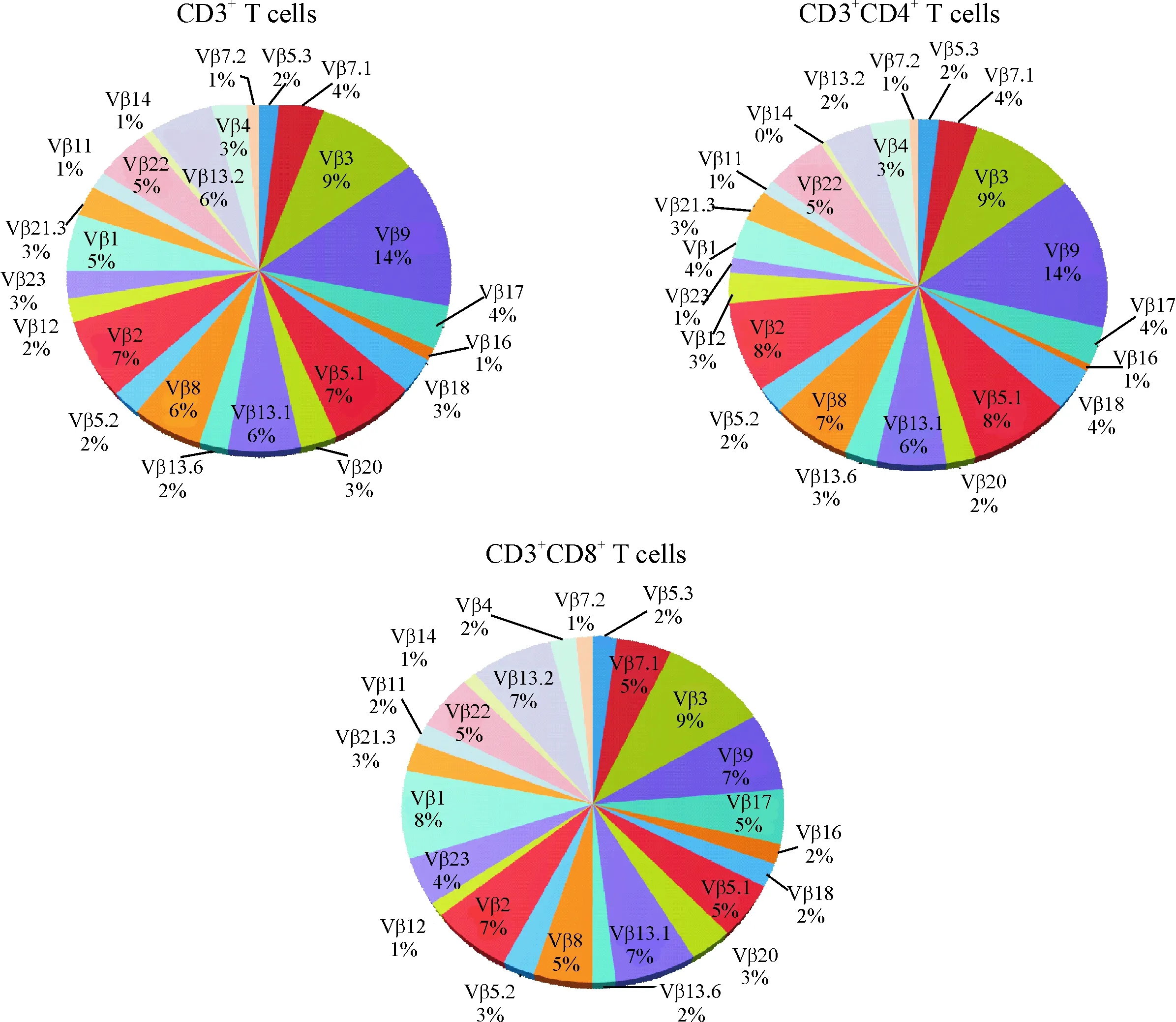
Figure 1.The distribution pattern of 24 TCR Vβ repertoires in T-cell subsets of peripheral blood from healthy individuals.
由于24个Vβ亚家族抗体共有8管,每一管均为FITC和PE偶联的复合抗体(A~H),每一管复合抗体包含3个TCR Vβ亚家族的抗体,如图2所示,通过优化后均可获得界限清晰的细胞群,因此,进一步分析显示,PD1+细胞在健康成人CD3+、CD3+CD4+和CD3+CD8+T细胞的24个TCR Vβ亚家族中均可以检测到,PD-1+细胞在T细胞各亚群中分布频率虽有个体差异,但相对比较均衡,在CD4+T细胞中,PD-1+细胞在Vβ5.2+T细胞中的分布频率较高,而在CD8+T细胞中,PD-1+细胞在Vβ11+和Vβ13.6+T细胞中的分布频率较高,见图3。
讨 论
近年来免疫抑制性受体PD-1的研究越来越受到重视,主要是其在肿瘤靶向治疗中开辟了新方向,为肿瘤靶向免疫治疗带来了新希望[6-7]。目前PD-1 的研究主要集中在实体瘤,而在血液恶性肿瘤中,免疫抑制性受体在T细胞免疫方面的研究较少。PD-1在T细胞亚群中的过表达严重影响病人的T细胞免疫状态,导致T细胞无法行使正常的功能,PD-1可表达于抗肿瘤特异性CD8+T细胞上,与肿瘤细胞上的相应配体结合形成的负性共刺激效应,在体内发挥限制、终止或减弱T细胞的应答作用[3-5],是形成T细胞免疫耐受的重要原因。由于这些负性共刺激分子参与肿瘤免疫应答,使得免疫调控和免疫治疗策略更为复杂。目前多数研究采用流式细胞术检测PD-1在T细胞亚群CD4+和CD8+T细胞中的表达和分布情况,而尚未涉及其在CD3+CD4+和CD3+CD8+T细胞亚群下TCR Vβ各亚家族中的分布,而不同的TCR亚家族T细胞其识别不同的抗原表位,我们的前期研究也发现某些TCR亚家族T细胞的克隆性扩增如Vβ21+T细胞与抗白血病作用密切相关[8-9]。因此本研究结合多年在TCR基因谱系研究的基础上拟建立免疫抑制性受体PD-1在TCR Vβ各亚家族中的检测方法,希望将其应用于了解白血病病人外周血T细胞谱系中PD-1表型细胞分布频率特点的研究。
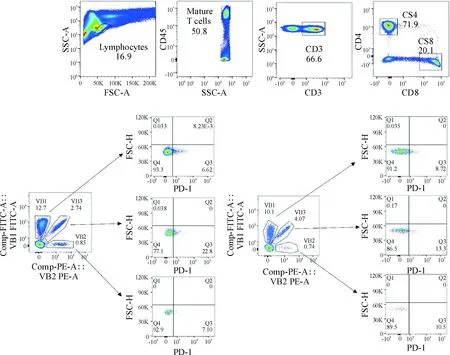
Figure 2.Gating strategy for PD-1+ TCR Vβ1~3+ CD4+ /CD8+ T cells from one case of healthy individual by flow cytometry.

Figure 3.The distribution frequency of PD-1+ cells in CD3+, CD4+ and CD8+ TCR Vβ repertoire T cells in peripheral blood from healthy individuals.
我们首先利用健康成人外周血进行检测,确定TCR Vβ亚家族在T细胞各亚群中的检测是否正确,检测结果显示完全符合试剂盒所提供的Quick Reference Card数据,所有样本均可以检测到24个Vβ亚家族,这与既往我们通过RT-PCR和基因扫描所发现的Vβ亚家族的分布特点相似,而且健康成人在CD3+、CD4+和CD8+T细胞中主要优势利用的Vβ亚家族如Vβ2和Vβ5.1等均为高频表达的亚家族[10],而通过流式检测我们还发现了其它高频表达的亚家族,如Vβ3、Vβ8、Vβ9、Vβ13.1和Vβ13.2亚家族。故此,我们从细胞表型的层面上建立了Vβ亚家族的分析方法,目的在于进一步检测这些细胞亚群表面所表达的其他受体的情况。我们近期研究显示急性髓性白血病(acute myeloid leukemia,AML)病人外周血T细胞中PD-1+T细胞比例明显升高[5],为此,我们通过该研究方法,同时检测PD-1在TCR Vβ各亚家族中的分布频率,检测结果表明所有亚家族均可以检测到PD-1+T细胞,提示该方法的敏感性达到基本要求。同时,我们也初步发现了不同Vβ亚家族中PD-1+T细胞的比例有所差异,如PD-1+细胞在CD3+Vβ11+和Vβ14+T 细胞中的分布频率较高,而在CD4+和CD8+T细胞中,则分别在Vβ5.2+和Vβ11+、Vβ13.6+T细胞中分布频率较高,但总体的分布还是比较均衡。这可能是PD-1在健康成人中的一种特征性表现,但由于样本量较少,还有待扩大样本量进一步深入探讨。同时,我们也初步利用所建立的检测方法应用于AML病人外周血T细胞的检测,结果显示AML病人CD3+CD4+和CD3+CD8+T细胞24个TCR Vβ亚家族的优势利用和健康成人的有所不同(结果未报道)。
在方法建立过程中,我们同时对比了利用全血或PBMC检测各Vβ亚家族的分布和PD-1+T细胞比例,发现检测结果相似,由于TCRVβ亚家族有24个之多,检测需要的细胞数量较大,同时考虑到血液肿瘤病人外周血收集比较困难,病人淋巴细胞数差异较大等原因,我们最后采用了PBMC进行检测,其优点就是细胞数明确,可以确保实验的顺利进行,同时也避免由于全血中的某些成分如血浆或血小板等影响抗体的偶联。
总之,本项工作成功建立了多色荧光流式细胞术检测CD3+、CD4+和CD8+T细胞TCR Vβ亚家族中免疫抑制性受体PD-1分子免疫表型方法,初步探讨其在健康人T细胞亚群TCR Vβ亚家族中的表型分布频率特点,由于本研究仍在继续中,尚有待扩大样本量,同时将该方法运用于血液肿瘤病人的检测,为进一步研究病人T细胞免疫抑制特点提供更全面的认识。

