GT和GATA转录因子对甘蓝型油菜BnA5.FAD2和BnC5.FAD2启动子功能的调控
刘芳,肖钢,官春云
GT和GATA转录因子对甘蓝型油菜和启动子功能的调控
刘芳1,肖钢2,官春云1
(1湖南农业大学农学院/国家油料改良中心湖南分中心,长沙 410128;2湖南省水稻油菜抗病育种重点实验室,长沙 410128)
【目的】脂肪酸去饱和酶2基因()是控制油菜中油酸含量的重要基因,通过研究GATA和GT转录因子与和启动子的互作关系及其转录调控机制,为高油酸油菜育种提供分子理论基础。【方法】通过缺失启动子片段及生物信息学分析,预测和启动子区潜在顺式作用元件;从PlantTFDB转录因子数据库中筛选候选转录因子,通过实时荧光定量PCR(qRT-PCR)检测转录因子的表达规律,并与和表达规律对比,进一步筛选候选转录因子;利用酵母单杂交验证转录因子与启动子序列的互作情况;将转录因子与和启动子序列共转入拟南芥,通过Western blot检测报告基因GFP的蛋白表达情况,分析转录因子对于启动子功能的影响。【结果】单独敲除和启动子中的GT或GATA顺式作用元件后,GFP蛋白丰度均下降,表明GT和GATA顺式作用元件在调节基因转录中起重要作用。酵母单杂交结果显示,GATA家族转录因子(、和)和GT家族转录因子(和)可以与和启动子相互作用。Western blot结果显示,当GATA家族转录因子与含有GATA元件的启动子片段共转化拟南芥时,GFP蛋白含量明显高于无转录因子时,当敲除GATA元件时,GFP蛋白含量无明显变化;当GT家族转录因子与含有GT元件的启动子片段共转化拟南芥时,GFP蛋白含量有明显变化,当敲除GT元件时,GFP蛋白含量无明显变化。【结论】GATA家族的转录因子Bna010243-1、Bna026124-1和Bna026124-2可以与和启动子中GATA元件相互作用,增强基因的表达水平。GT家族的转录因子Bna010915可以与和启动子中的GT元件发生互作,正向调节基因表达;Bna013749通过与和启动子中的GT元件发生互作,负向调节基因表达。
甘蓝型油菜;GATA转录因子;GT转录因子;启动子;启动子
0 引言
【研究意义】油酸是多种脂肪酸的前体,通常存在于内质网中,以油酸-CoA、油酸-PLA、油酸-DAG、油酸-PC和油酸-TAG等形式参与油酸代谢。脂肪酸去饱和酶基因()是负责将油酸转化成亚油酸的关键基因,甘蓝型油菜中位于A5和C5染色体上的对于油菜种子中油酸含量具有重要影响[1]。目前,高油酸育种及其形成机理已然成为各类油料作物的研究热点[2]。通过研究其转录调控机制,为高油酸油菜育种提供分子理论基础。【前人研究进展】目前,植物脂肪酸去饱和酶主要在转录水平被调控[3],而且的转录水平受外界刺激影响。例如,在低温诱导下,棉花转录物水平增加[4];酿酒酵母中油酸调控基因的转录水平会被外源性不饱和脂肪酸抑制,但在缺氧条件下转录水平会增加[5]。真核生物的转录过程十分复杂,需要多种转录因子参与,转录因子多与启动子上的特异序列结合,起始转录或调节转录水平。GATA家族转录因子通过识别并结合GATA元件调节基因的转录水平。GATA家族转录因子广泛存在于动、植物和真菌中,对(T/A)GATA(A/G)序列具有很高的亲和力。1991年首次发现GATA-1,与GATA-2、GATA-3、GATA-4、GATA-5、GATA-6组成GATA家族[6]。GATA元件通常位于启动子、转录起始位点的上游和增强子中[7]。在植物中,发现含有GATA序列的I-box元件存在于rbcs、cab和nia启动子的上游,对光和昼夜节律有响应[8]。GT转录因子通常与GT元件结合,调节基因表达以响应内、外部刺激。目前,仅在植物中发现GT转录因子[9],与之结合的GT元件通常是富含T和A的核心序列[10]。GT转录因子最初在豌豆核中被发现,与GT-1元件结合[11]。研究表明GT元件可以参与光调节[12-13],参与野生大麦水分胁迫的调节[14]。GT元件的拷贝数以及拷贝之间的间隔对启动子的转录功能都有影响[15]。不同的GT转录因子与GT元件结合后,会发挥不同的调节功能[16]。Le Gourrierec等[17]发现GT-1转录因子可以结合并稳定酵母细胞中的TF IIA-TBP-TATA复合物以调节基因表达,认为GT-1转录因子可以与转录起始复合物结合直接参与转录调节。【本研究切入点】目前,高油酸育种已成为研究热点,对于的研究也较普遍,但对于转录水平调控的研究鲜有报道。【拟解决的关键问题】本研究通过敲除部分启动子片段来研究2个启动子和的同源区域,并找到控制基因表达的关键启动子区域。通过PlantCARE网站分析,获得潜在的调控元件,借助PlantTFDB网站筛选可能与之结合的转录因子,继而分别在酵母和拟南芥中验证启动子序列和转录因子的互作关系,为高油酸油菜育种奠定基础。
1 材料与方法
1.1 试验材料
甘蓝型油菜湘油15种在湖南农业大学耘园基地大田,于2017年3月至5月取不同生长时期的种子。拟南芥(,Col-0)由湖南农业大学油料作物研究所提供,种在培养箱内,24℃/16 h光照,22℃/8 h黑暗培养。pEASY-T1载体、大肠杆菌T1感受态购于北京全式金公司。酵母菌种Y187(-Trp/-Leu/-His)由山东农业大学作物生物学国家重点实验室馈赠,酵母单杂交报告载体pHIS2、pGADT7载体、PRI101载体为湖南农业大学油料研究所保存。本研究中所用引物均由南京金斯瑞公司合成。
1.2 BnA5.FAD2和BnC5.FAD2启动子同源区的分析
启动子区分为4个不同的区域,分别命名为A(-1—-213 bp)、B(-214—-225 bp)、C(-226—-314 bp)和D(-315—-685 bp),分别构建载体HM-DCBA:GUS/GFP(-685—-1 bp+内含子)、HM-CBA:GUS/GFP(-314—-1 bp+内含子)、HM-BA:GUS/GFP(-225—-1 bp+内含子)和HM-A(-213—-1 bp +内含子)(图1-a)。启动子区分为4个不同的区域,分别命名为A′(-1—-215 bp)、B′(-216—-227 bp)、C′(-228—-312 bp)和D′(-313—-671 bp),分别构建载体HM-D′C′B′A′:GUS/GFP(-671—-1 bp+内含子)、HM-C′B′A′:GUS/GFP(-312—-1 bp+内含子)、HM-B′A′:GUS/GFP(-227—-1 bp+内含子)和HM-A′(-215—-1 bp+内含子)(图1-b)。分别敲除C、C′区域,构建植物表达载体(图1-c和图1-d)。分别敲除GT元件和GATA元件核心序列,构建植物表达载体(图2-a和图2-b)。载体构建中所用引物见电子附表1。所有构建的载体通过冻融法[18]转入农杆菌菌株GV3101中。然后通过花序浸染法转化野生拟南芥[19]。在含有50 mg·L-1潮霉素B的MS平板上筛选转基因植株,然后移植到土壤中培养。从T2代转基因拟南芥种子中提取总蛋白质,通过Western blot检测GFP蛋白含量,具体操作参考刘睿洋等[20]方法。
1.3 GATA家族和GT家族基因的筛选及克隆
利用PlantTFDB网站分析,从甘蓝型油菜中获得31个GATA转录因子基因,其中19个完整序列,与油菜数据库(http://brassicadb.org/brad/)保持高度同源性的序列共16个。通过实时荧光定量PCR(qRT-PCR)分析表达模式,以cDNA为模板,选择作为内参基因,每个模板3个重复,进行qRT-PCR检测。PCR反应体系为SYBR Premix Ex Taq 9 μl、引物各0.5 μl、模板1 μl,ddH2O补齐20 μl。PCR反应程序为95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环。以甘蓝型油菜基因组为模板,克隆GATA家族的转录因子基因(、、和)和GT家族转录因子(和)。
1.4 酵母单杂交鉴定启动子与转录因子的互作
根据Infusion试剂盒(TaRaKa,Japan)说明书,将和启动子克隆到pHIS2.0载体中的GAL4-DNA结合结构域中,将GATA家族和GT家族转录因子编码区序列与pGADT7载体中的GAL4激活结构域融合。
将pHIS2-A5-promoter和pHIS2-C5-promoter载体分别转化到营养缺陷型酵母菌株Y187,筛选出阳性菌株后将其涂布到SD-Trp固体平板和含不同浓度3-AT(0、10、20、30、40、50、60、70、80、90和100 mmol·L-1)的固体SD-Trp-His培养基上,30℃培养3—5 d,观察其生长情况,筛选最适3-氨基-1,2,4-唑(3-AT)生长浓度。按照电子附表2的组合进行酵母转化,验证GATA和GT家族基因的功能。将含有转化子的酵母菌涂在营养缺陷培养基上(SD-Trp、SD-Trp-Leu-His+适当浓度的3-AT),30℃培养3—5 d。观察酵母生长情况。
1.5 在拟南芥中的分析转录因子与启动子的互作情况
为了鉴定转录因子基因、、、和的功能,将其分别克隆并与pRI101载体连接,筛选标记为卡那霉素,构建载体时将血细胞凝集素(HA)标签与转录因子基因融合,同时转入载体pRI101,便于进一步检测是否转化成功。构建载体命名为pRI101-Bna010243-1∷HA、pRI101-Bna026124-1∷HA、pRI101-Bna026124- 2∷HA、pRI101-Bna010915∷HA和pRI101-Bna013749∷HA。将以上载体分别转化已含有和启动子片段的拟南芥。经50 mg·L-1潮霉素B+70mg·L-1卡那霉素的MS平板筛选转基因拟南芥,然后移植到土壤中继续培养。从T2代转基因拟南芥种子中提取总蛋白质通过Western blot检测HA蛋白含量,用于判断转录因子是否成功转化拟南芥,通过Western blot检测GFP蛋白含量用于判断转录因子对于启动子功能的影响,从而判断转录因子是否与启动子序列互作,具体操作同1.2。
2 结果
2.1 GT和GATA顺式作用元件在调节BnA5.FAD2和BnC5.FAD2转录中的作用
湖南农业大学油料研究所前期克隆了和启动子序列[21-22],二者约680 bp序列(,686 bp;,676 bp)保持91%的同源性,这一同源区域对于基因表达量的贡献巨大。和启动子区分别分为4个区域A(A′)、B(B′)、C(C′)和D(D′),构建植物表达载体,转化拟南芥,采用Western blot技术检测报告基因GFP的蛋白丰度。结果显示,当区域D和D′缺失时,GFP蛋白的丰度增加,表明该区域可能存在一些负向调控元件,抑制基因表达。随着区域C和C′的进一步缺失,GFP蛋白丰度下降,预示该区域中存在一些用于控制基因表达的正调控元件;进一步敲除区域B和B′后,HM-A(A′)的GFP蛋白丰度一定程度的高于HM-BA(B′A′),即GFP蛋白丰度呈现增加的现象,说明B(B′)区存在一些负调控元件调节基因表达(图1-e和图1-f)。可见,启动子C(-226—-314 bp)区域和启动子C′(-228—-312 bp)区域是保持基因高度表达的关键区域。
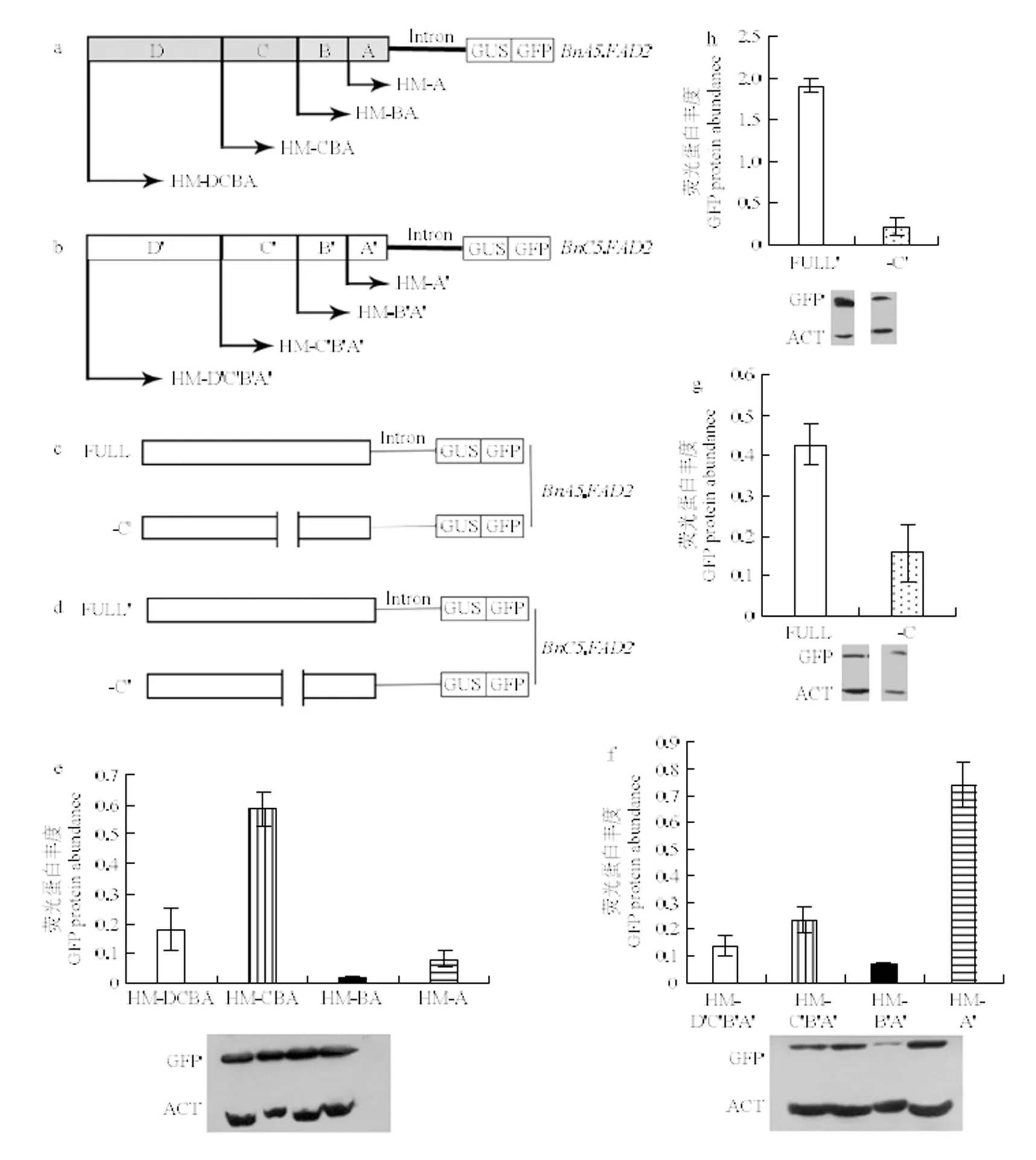
a:BnA5.FAD2启动子不同长度同源区的载体构建模式图;b:BnC5.FAD2启动子不同长度同源区的载体构建模式图;c:敲除BnA5.FAD2启动子的C区域后构建载体模式图;d:敲除BnC5.FAD2启动子C′区域后构建载体模式图;e:含有不同长度BnA5.FAD2启动子片段的转基因拟南芥种子中GFP蛋白丰度检测;f:含有不同长度 BnC5.FAD2启动子片段的转基因拟南芥种子中GFP蛋白丰度检测;g:含有敲除C区域的BnA5.FAD2启动子片段的转基因拟南芥种子中GFP蛋白丰度检测;h:含有敲除C′区域的BnA5.FAD2启动子片段的转基因拟南芥种子中GFP蛋白丰度检测
为了进一步验证C(-226—-314 bp)区域和C′(-228—-312 bp)的功能,分别敲除这两个区域并构建载体-C和-C′(图1-c和图1-d)。结果发现,区域C和C′缺失时,GFP蛋白质丰度均降低(图1-g和图1-h)。表明启动子的-226—-314 bp和启动子的-228—-312 bp是控制甘蓝型油菜种子中和表达的关键区域。
启动子的-226—-314 bp和启动子的-228—-312 bp仅存在一个碱基差异,经PlantCARE软件预测发现这两个区域均存在GT和GATA顺式作用元件,分别为GT家族和GATA家族转录因子的结合位点。分别敲除2个元件并构建载体-GT和-GATA与-GT′和GATA′(图2-a和图2-b),转化拟南芥进行功能分析。结果显示,分别单独敲除BnC5.FAD2启动子的GT和GATA顺式作用元件后,均会造成GFP蛋白丰度显着下降(图2-d),表明启动子的GT和GATA顺式作用元件在调节基因转录中起重要作用。分别单独敲除2启动子的GT和GATA顺式作用元件后,GFP蛋白丰度显著下降(图2-c),表明启动子中GT和GATA顺式作用元件在调节基因转录中起重要作用。
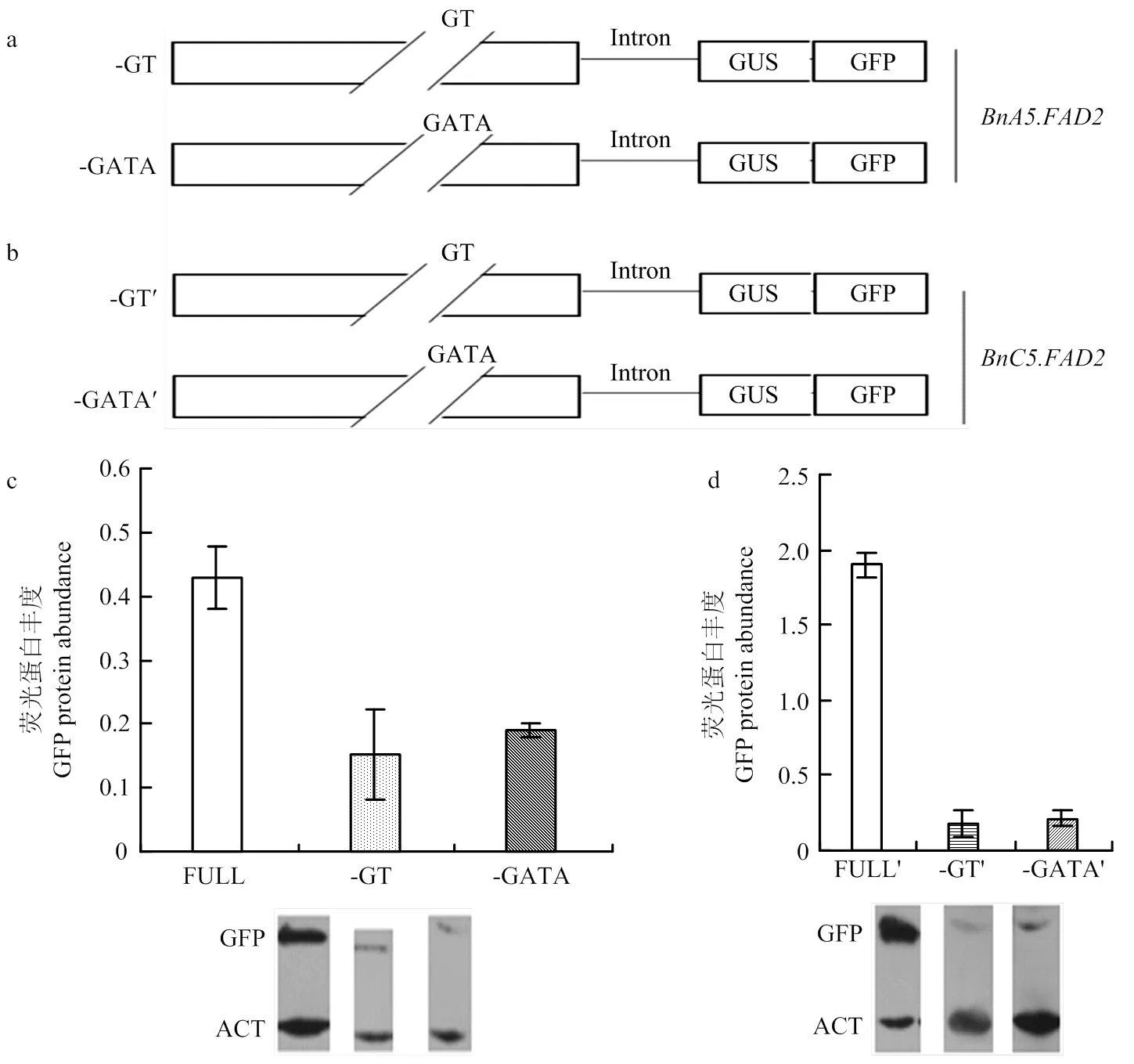
a:敲除BnA5.FAD2启动子GT、GATA元件后构建载体模式图;b:敲除BnC5.FAD2启动子GT、GATA元件后构建载体模式图;c:敲除BnA5.FAD2启动子的GT、GATA元件后转基因拟南芥种子中GFP蛋白丰度检测;d:敲除BnC5.FAD2启动子的GT、GATA元件后转基因拟南芥种子中GFP蛋白丰度检测
2.2 GATA家族和GT家族基因的表达分析和蛋白序列分析
通过qRT-PCR分析转录因子表达规律(图3),发现GATA转录因子家族中的表达规律与一致,而、和的表达规律与一致;GT转录因子家族中的表达规律与一致,的表达规律与一致。
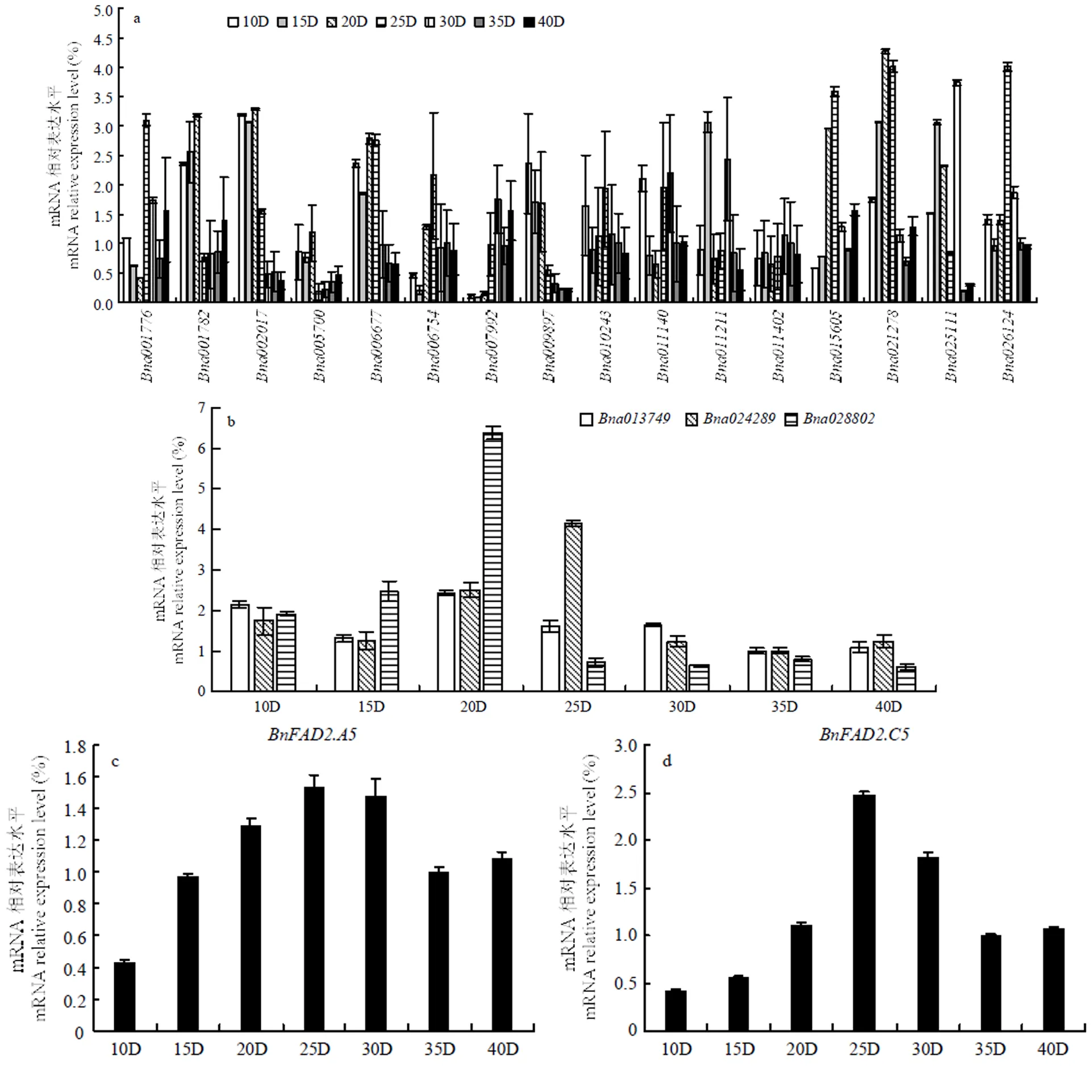
a:油菜种子不同发育时期GATA家族基因表达分析;b:油菜种子不同发育时期GT家族基因表达分析;c:油菜种子不同发育时期BnA5.FAD2表达分析;d:油菜种子不同发育时期BnC5.FAD2表达分析
以甘蓝型油菜湘油15基因组和cDNA基因组序列为模板,克隆GATA家族和GT家族基因,分别为(903 bp,301)、(594 bp,198)、(567 bp,189)、(963 bp,321)、(546 bp,182)、(582 bp,194)、(681 bp,227)和(1 239 bp,413)。GATA家族蛋白均具有保守的单个18个残基的锌指结构(CX2CX18CX2C),与其他作物中GATA蛋白结构相同(图4-a),GT家族中Bna013749蛋白和Bna010915蛋白的3个α-螺旋构成Trihelix结构,而且每个串联重复区具有1个色氨酸残基,符合W-Xn-W-Xn-W的结构特点,Bna010915蛋白第3个α-螺旋中的保守W被F替代(图4-b),与GT-2家族的结构特点相同[23],可能属于GT-2亚家族成员。

a:GATA家族蛋白序列分析;b:GT家族蛋白序列分析
2.3 GATA和GT家族在酵母中的功能分析
为了排除报告基因基底水平表达的影响,需确定适当浓度的3-AT,排除干扰。结果表明,pHIS2-A5- promoter的最佳浓度为50 mmol·L-1,pHIS2-C5-promoter动子的最佳浓度为35 mmol·L-1(图5-a)。将共转化的酵母菌液涂布在SD-Trp-Leu(SD-TL)和SD-Trp- Leu-His(SD-TLH)+3-AT(35 mmol·L-1/50 mmol·L-1)的固体培养基上,并在30℃条件下孵育。观察生长情况3—5 d(图5-b),所有共转化的酵母组合物可以在SD-T-L固体培养基平板上正常生长。在SD-TL-H+ 50 mmol·L-13-AT三缺板上,与pHIS2-A5-promoter共转化酵母的Bna010243-1、Bna026124-1、Bna026124-2、Bna010915、Bna013749可以生长,即表明Bna010243-1、Bna026124-1、Bna026124-2、Bna010915和Bna013749可以与启动子相互作用。在SD-T-L-H+35 mmol·L-13-AT三缺板上,与pHIS2-C5-promoter共转化酵母的Bna010243-1、Bna026124-1、Bna026124-2、Bna010915和Bna013749可以生长,即表明启动子也可与Bna010243-1、Bna026124-1、Bna026124-2、Bna010915和Bna013749相互作用。
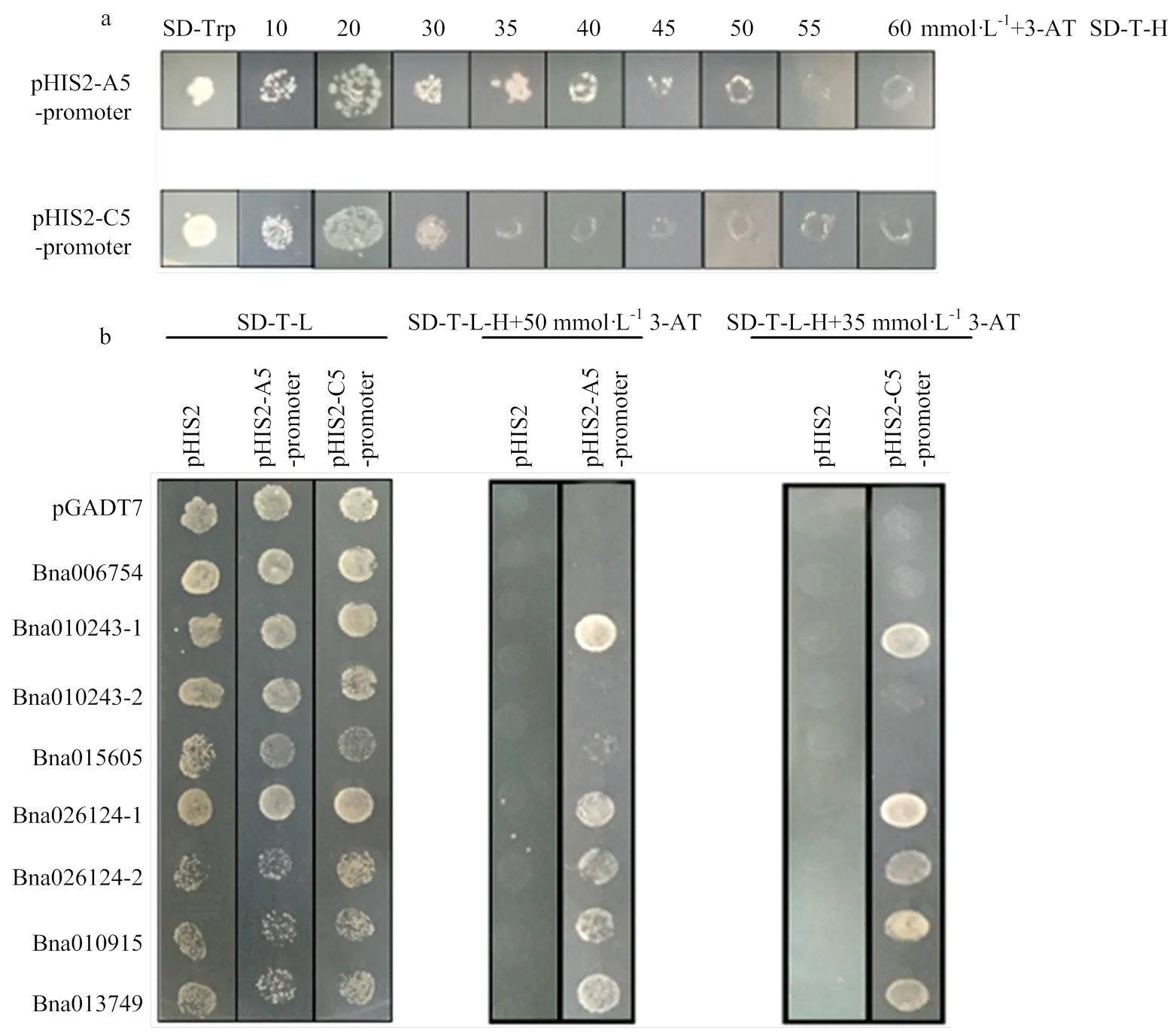
a:选择合适的3-AT浓度;b:转录因子和启动子的互作分析
2.4 GATA和GT家族在拟南芥中与BnA5.FAD和BnC5. FAD2启动子互作分析
将GATA转录因子家族的、和分别构建到pRI101载体中,然后分别转化具有HM-CBA、HM-C′B′A′、-GATA或-GATA′的转基因拟南芥,(图6-i和图6-j);将GT转录因子家族的和分别构建到pRI101载体中,转化具有HM-CBA、HM-C′B′A′、-GT和-GT′的转基因拟南芥(图6-k和图6-l)。经western blot检测证明转录因子均转染拟南芥,并且可以正常表达(图6-m)。检测报告基因GFP蛋白丰度的变化,鉴定转录因子与或启动子互作与否(图6),当拟南芥含有GATA家族转录因子基因之一和HM-CBA或HM-C′B′A′时,GFP蛋白质丰度有不同程度的增加(图6-a和图6-e)。但当GATA顺式作用元件被敲除时,GFP蛋白丰度没有显著变化(图6-b和图6-f)。说明转录因子基因、和可以与或启动子发生相互作用,而且作用位点在GATA元件这一位置,而且互作的结果均是提高基因表达量。当和HM-CBA或HM-C′B′A′共转化拟南芥时,相对于仅含有HM-CBA或HM-C′B′A′的拟南芥,GFP蛋白丰度略有增加(图6-c和图6-g);当基因和HM-CBA或HM-C′B′A′共转化到拟南芥中时,GFP蛋白丰度降低(图6-c和图6-g);当GT顺式元件被敲除时,共转化之后的拟南芥GFP蛋白丰度没有显著变化(图6-d和图6-h)。推测Bna010915可能作为一个正调控因子,Bna013749作为一个负调控因子,二者均可与或启动子区的GT元件相互作用,调节基因的表达水平。
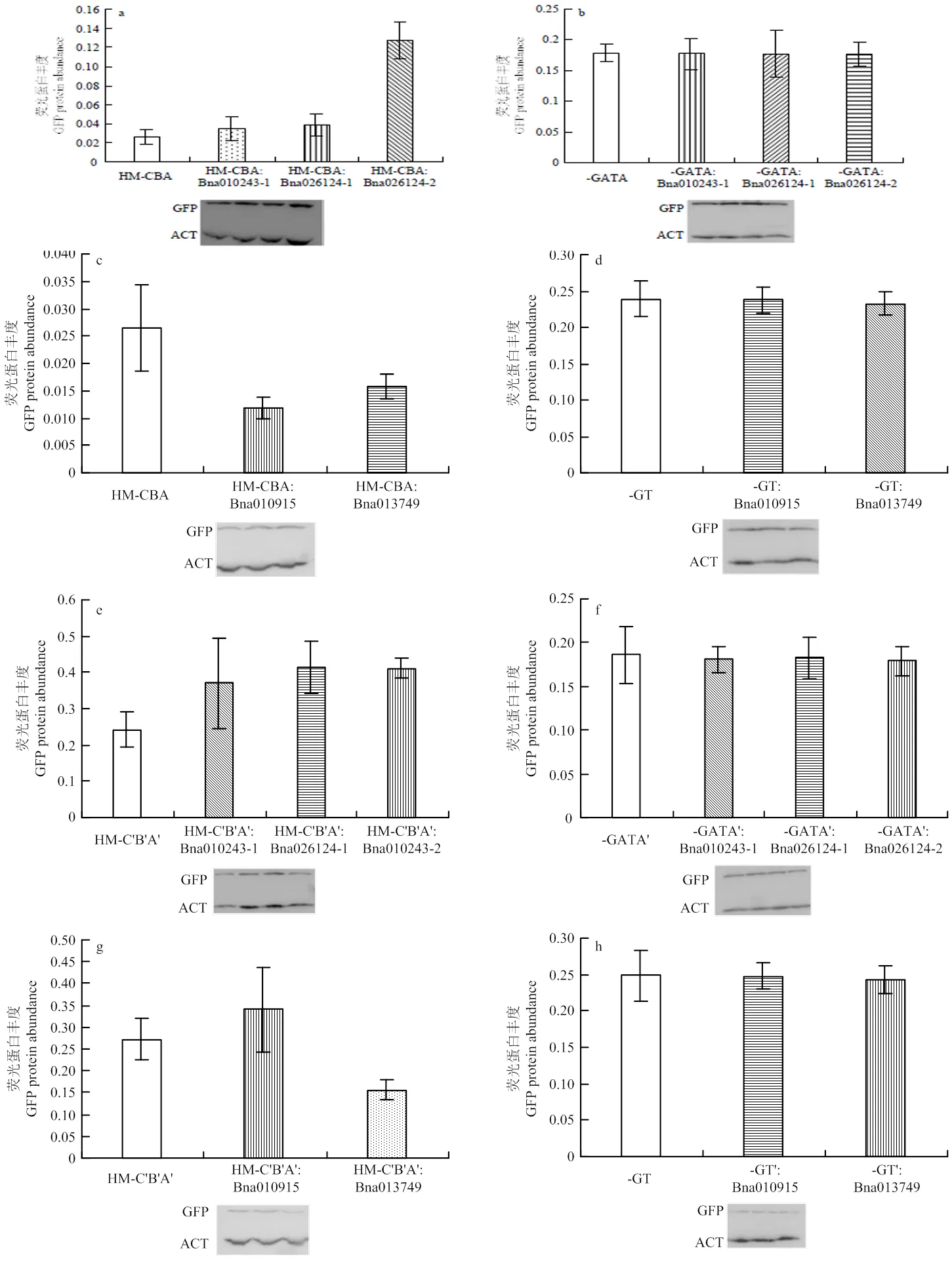
a:启动子BnA5.FAD2与GATA家族转录因子在拟南芥中的互作分析;b:敲除GATA元件后的启动子BnA5.FAD2与GATA家族转录因子在拟南芥中的互作分析;c:启动子BnA5.FAD2与GT家族转录因子在拟南芥中的互作分析;d:敲除GT元件后的启动子BnA5.FAD2与GT家族转录因子在拟南芥中的互作分析;e:启动子BnC5.FAD2与GATA家族转录因子在拟南芥中的互作分析;f:敲除GATA元件后的启动子BnC5.FAD2与GATA家族转录因子在拟南芥中的互作分析;g:启动子BnC5.FAD2与GT家族转录因子在拟南芥中的互作分析;h:敲除GT元件后的启动子BnC5.FAD2与GT家族转录因子在拟南芥中的互作分析;i—l:启动子和转录因子共转化拟南芥的模式图;m:转录因子在拟南芥中表达检测图
a: interaction analysis between promoterand GATA family transcription factors in; b: interaction analysis between promoterlacking GATA cis-element and GATA family transcription factors in; c: interaction analysis between promoterand GT family transcription factors in; d: interaction analysis between promoterlacking GT cis-element and GATA family transcription factors in; e: interaction analysis between promoterand GATA family transcription factors in; f: interaction analysis between promoterlacking GATA cis-element and GATA family transcription factors in; g: interaction analysis between promoterand GT family transcription factors in; h: interaction analysis between promoterlacking GT cis-element and GATA family transcription factors in; i-l: model diagram of co-transformation promoters and transcription factors into; m: Expression detection of transcription factors in
图6 转录因子和启动子在拟南芥中的互作分析
Fig. 6 The interaction analysis of transcription factor and promoters in
3 讨论
3.1 GT转录因子与启动子互作功能分析
转录水平的调控在植物基因调控中起重要作用,这一过程涉及多种顺式作用元件和反式作用因子。启动子上的顺式作用元件与特定的转录因子结合能够调节基因转录的起始,转录效率以及时空特异性[24]。本研究预测到2个潜在顺式元件GATA和GT,与之结合的转录因子为GATA家族和GT家族转录因子。
GT元件首先在豌豆叶中的rbcS-3A启动子中被鉴定为光反应元件[11],但在多数启动子中功能不明确。本研究发现当GT元件或GATA元件分别被单独敲除时,报告基因GFP的表达量出现不同程度的降低,初步说明GT和GATA可能与其相应的转录调控因子结合后调控基因的表达上调。在水稻低表达的成熟组织中,属于GT家族的OsGT-2转录因子可以上调的表达量,将水稻启动子转入烟草原生质体中分析,发现也是表现为上调因子的功能[25]。GT元件结合GT转录因子可以调节基因转录水平以抵抗不利环境[26]。GT家族基因属于Trihelix家族,Trihelix家族是植物所特有的[27],而且trihelix结构域具有高度保守性[28]。本研究发现,GT家族基因和均具有trihelix结构,且符合W-Xn-W-Xn-W结构特点,其中Bna010915蛋白第3个α-螺旋中的保守W被F替代,与GT-2家族的结构特点相同,可能属于GT-2亚家族成员。研究发现ASIL1属于trihelix家族的新的亚科,作为拟南芥种子基因中的负调节因子[29]。本研究发现,对于和启动子也起到负调控的作用,与ASIL1功能相似,推测其可能与ALIL1属于同一亚科。
3.2 GATA转录因子与启动子的互作功能分析
GATA家族转录因子识别GATA元件并与WGATAR(W是T或A;R是G或A)序列结合[30]。该家族的DNA结合结构域通常具有广泛存在于真核生物中的Ⅳ锌指(CX2CX17-20CX2C)的结构[31]。本文中克隆的GATA转录因子基因都具有Ⅳ锌指(CX2CX18CX2C)(图4),和启动子上含有WGATAR序列,推测本研究中克隆的GATA转录因子可能与和启动子上的GATA序列相互作用,参与基因表达的调控,但需要进一步的试验验证。酵母单杂交试验以及转录因子Bna010243-1、Bna026124-1、Bna026124-2与部分启动子序列(HM-CBA或HM-C′B′A′)共转染拟南芥的试验结果表明,、、可以与和启动子中GATA元件相互作用(图6),而且3个转录因子均表现为正向调控的功能。
4 结论
GATA家族的转录因子Bna010243-1、Bna026124- 1、Bna026124-2可以与和启动子中GATA元件相互作用,增强基因的表达水平。GT家族的转录因子Bna010915可以与和基动子中的GT元件发生互作,正向调节基因表达;Bna013749通过与启动子和启动子的GT元件发生互作,负向调节基因表达。
[1] Yang Y Y, Yang S Q, Chen Z H, Guan C Y, Chen S Y, Liu Z S. QTL analysis of 18-C unsaturated fatty acid contents in zero-erucic rapeseed (L.)., 2011, 37(8): 1342-1350.
[2] Nabloussi A, Fernándezmartínez J M, Velasco L. Inheritance of mid and high oleic acid content in Ethiopian mustard., 2006, 46(6): 2361-2367.
[3] Chapman K D, Dyer J M, Mullen R T. Biogenesis and functions of lipid droplets in plants: Thematic Review Series: Lipid Droplet Synthesis and Metabolism: from Yeast to Man., 2012, 53(2): 215-226.
[4] Kargiotidou, A, Deli D, Galanopoulou D, Tsaftaris A, Farmaki T. Low temperature and light regulate delta 12 fatty acid desaturase () at a transcriptional level in cotton ().,2008, 59(8): 2043-2056.
[5] Martin C E, Oh C, Jiang Y. Regulation of long chain unsaturated fatty acid synthesis in yeast., 2007, 1771(3): 271-285.
[6] 吴秀丽, 李扬秋. 造血转录因子GATA-3的研究进展. 国外医学输血及血液学分册. 2001, 24(5): 387-390.Wu X L, Li Y Q. Research progress of hematopoietic transcription factor GATA-3., 2001, 24(5): 387-390. (in Chinese)
[7] 袁岐, 张春利, 赵婷婷, 许向阳. 植物中GATA转录因子的研究进展. 分子植物育种, 2017(5): 1702-1707.Yuan Q, Zhang C L, Zhao T T, Xu X Y. Research of advances GATA transcription factor in plant., 2017(5): 1702-1707. (in Chinese)
[8] Rastogi R, Bate N J,Sivasankar S, Rothstein S J. Footprinting of the spinach nitrite reductase gene promoter reveals the preservation of nitrate regulatory elements between fungi and higher plants.,1997, 34(3): 465-476.
[9] Green P J, Kay S A, Chua N H. Sequence-specific interactions of a pea nuclear factor with light-responsive elements upstream of the rbcS-3A gene., 1987, 6(9): 2543-2549.
[10] McCarty D R, Chory J. Conservation and innovation in plant signaling pathways., 2000, 103(2): 201-209.
[11] Villain P, Clabault G, Mache R, Zhou D X. S1F binding site is related to but different from the light-responsive GT-1 binding site and differentially represses the spinach rps1 promoter in transgenic tobacco.,1994, 269(24): 16626-16630.
[12] Dehesh K, Smith L G, Tepperman J M, Quail P H. Twin autonomous bipartite nuclear localization signals direct nuclear import of GT-2., 1995, 8(1): 25-36.
[13] Dehesh K, Hung H, Tepperman J M, Quail P H. GT-2: a transcription factor with twin autonomous DNA-binding domains of closely related but different target sequence specificity., 1992, 11(11): 4131-4144.
[14] Suprunova T, Krugman T, Distelfeld A, Fahima T, Nevo E, Korol A. Identification of a novel gene (Hsdr4) involved in water-stress tolerance in wild barley., 2007, 64(1/2): 17-34.
[15] Mehrotra R, Kiran K, Chaturvedi C P, Ansari S A, Lodhi N, Sawant S, Tuli R. Effect of copy number and spacing of the ACGT and GT cis elements on transient expression of minimal promoter in plants., 2005, 84(2): 183-187.
[16] Guan Q L, Chen H X, Zhang Y, Li Q L. Progresses on GT elements and GT factors in plants., 2009, 31(2): 123-130.
[17] Le Gourrierec J, Li Y F, Zhou D X. Transcriptional activation by Arabidopsis GT-1 may be through interaction with TFIIA-TBP- TATA complex., 1999, 18(6): 663-668.
[18] An G. Binary ti vectors for plant transformation and promoter analysis., 1987, 153(153C): 292-305.
[19] Clough S J, Bent A F. Floral dip: a simplified method for-mediated transformation of., 1998, 16: 735-743.
[20] 刘睿洋, 刘芳, 张振乾, 官春云. 甘蓝型油菜基因启动子及内含子在表达水平的功能分析. 作物学报, 2016, 42(10): 1471-1478.Liu R y, Liu F, Zhang Z q, Guan C y. Functional analysis ofpromoter and intron at expression level in., 2016, 42(10): 1471-1478. (in Chinese)
[21] Xiao G, Zhang Z Q, Yin C F, Liu R Y, Wu X M, Tan T L, Guan C Y. Characterization of the promoter and 5´UTR intron of oleic acid desaturase (FAD2) gene in., 2014, 545: 45-55.
[22] Liu F, Wang G L, Liu R Y,GUAN C Y. The promoter of fatty acid desaturase on chromosome C5 in, drives high-level expression in seeds., 2016, 10(6): 369-381.
[23] Kaplan-Levy R N, Brewer P B, Quon T, DAVID R S. The trihelix family of transcription factors--light, stress and development., 2012, 17(3): 163-171.
[24] Fan S d, Wang Y. Cloning and activity analysis of promoter of GRAS transcription factor gene HcSCL13 from., 2017, 33: 131-138.
[25] Ni M, Dehesh K, Tepperman J M, Quail P H. GT-2:transcriptional activation activity and definition of novel twin DNA binding domains with reciprocal target sequence selectivity., 1996, 8(6): 1041-1059.
[26] McCarty D R, Chory J. Conservation and innovation in plant signaling pathways., 2000, 103(2): 201-209.
[27] 丁刘军, 普明宇, 卫波, 王献平, 范仁春, 张相岐. 转录因子基因参与乌拉尔图小麦对条锈病的抗性. 遗传, 2016, 38(12): 1090-1101.DING L J, Pu M y, Wei B, Wang X p, Fan R c, Zhang X q. Transcription factor geneis involved in the stripe rust resistance in., 2016, 38(12): 1090-1101. (in Chinese)
[28] Kaplanlevy R N, Brewer P B, Quon T. The trihelix family of transcription factors-light, stress and development., 2012, 17: 163-171.
[29] Gao M J, Li X, Lui H, Gordon M G,Derek D L, Shu W, Dwayne D H. ASIL1 is required for proper timing of seed filling in., 2011, 6(12): 1886-1888.
[30] Lowry J A, Atchley W R. Molecular evolution of the GATA family of transcription factors: Conservation within the DNA-binding domain., 2000, 50(2): 103-115.
[31] 剧建芳. 南极丝瓜藓GATA转录因子PnGATA1的功能研究[D]. 济南: 山东大学, 2014.Ju J f. Functional study of GATA transcription factor PnGATA1 in[D]. Jinan: Shandong University, 2014. (in Chinese)
Regulation of GT and GATA Transcription Factors on Promoter Function ofandGenes in
Liu Fang1, Xiao Gang2, Guan Chunyun1
(1College of Agriculture, Hunan Agricultural University/National oilseed crops improvement center in Hunan, Changsha 410128;2Hunan Provincial Key Laboratory of Rice and Rapeseed Breeding for Disease Resistance, Changsha 410128)
【Objective】 Fatty acid desaturase 2 gene () is an important gene for controlling oleic acid content in rapeseed. And in this paper, the interaction between GATA family andandgene promoters or GT family transcription factors andandgene promoters was studied to make sure the transcription regulation mechanism to provide the theoretical basis for high oleic acid breeding. 【Method】 The potential cis-elements were predicted by deletion of promoter fragments and bioinformatics analysis, and candidate transcription factors were screened from PlantTFDB transcription factor database. Real-time PCR (qRT-PCR) was used to detect the expression pattern of transcription factors to further screen candidate transcription factors by comparison withandgene expression patterns. Transcription factors were co-transformed withandgenepromoters into yeast and verified interaction relationship between promoter and transcription factors by yeast one-hybrid. The transcription factors were transformed intowithandgenepromoter sequence, and the reporter gene GFP was detected by western blot to analyze the effects of transcription factors on promoters. 【Result】 After knocking out the GT or GATA cis-elements fromandgene promoters respectively, the GFP protein abundance decreased, which indicate that GT and GATA cis-elements play important roles in regulating gene transcription. Yeast one-hybrid results showed that the GATA family transcription factors (Bna010243-1, Bna026124-1, Bna026124-2) and the GT family transcription factors (Bna010915 and Bna013749) can interact withandgene promoters. Western blot analysis showed that when the GATA family transcription factor and the promoter fragment containing GATA elements were co-transformed into, the GFP protein content was significantly higher than that of no transcription factor. When the GATA element was knocked out, the GFP protein content did not change significantly. When the GT family transcription factor and the promoter fragment containing the GT element were co-transformed into, the GFP protein content changed significantly. When the GT element was knocked out, the GFP protein content did not change significantly.【Conclusion】 The GATA family transcription factors Bna010243-1, Bna026124-1, Bna026124-2 can interact with the GATA elements in theandgene promoters to enhance gene expression levels. The GT family transcription factor Bna010915 interacts with the GT elements in theandgene promoters to positively regulate gene expression; Bna013749 interacts with the GT elements in theandgene promoters to negatively regulate gene expression.
; GATA transcription factor; GT transcription factor;promoter;promoter
2018-07-13;
2018-09-25
国家重点基础研究发展计划“973”计划(2015CB150200)
刘芳,E-mail:g5n2a5f@163.com。
官春云,E-mail:guancy2011@aliyun.com
10.3864/j.issn.0578-1752.2018.24.002
(责任编辑 李莉)

