小麦转录因子基因TaWRKY33的耐盐性分析
张惠媛,刘永伟,杨军峰,张双喜,于太飞,陈隽,陈明,周永斌,马有志,徐兆师,付金东
小麦转录因子基因的耐盐性分析
张惠媛1,刘永伟2,杨军峰3,张双喜4,于太飞1,陈隽1,陈明1,周永斌1,马有志1,徐兆师1,付金东1
(1中国农业科学院作物科学研究所/国家农作物基因资源与基因改良重大科学工程/农业部麦类生物学与遗传育种重点实验室,北京 100081;2河北省农林科学院遗传生理研究所/河北省植物转基因中心,石家庄 050051;3河北旺丰种业有限公司,河北邢台 054900;4宁夏农林科学院农作物研究所,宁夏永宁 750105)
【目的】WRKY转录因子是植物转录调节因子家族之一,参与调控植物病原菌的防御、生长发育和抗逆应答等多种生理过程。小麦WRKY转录因子基因可以提高转基因拟南芥对干旱和高温的抗性。通过分析的耐盐性,检测TaWRKY33转录因子的转录活性,深入分析转录因子基因的功能,以解析其耐盐调控机制。【方法】以盐胁迫处理的小麦cDNA为模板,利用实时荧光定量PCR检测在盐胁迫条件下的表达模式;将的CDs序列插入带有CaMV35S启动子的pCAMBIA1302表达载体中,构建表达载体pCAMBIA1302-,转入农杆菌,侵染野生型拟南芥获得转基因株系;同时利用pWMB110-双元载体创建了过表达小麦株系。用转的拟南芥和小麦进行耐盐性鉴定。构建诱饵载体pGBKT7-,通过单转法将诱饵载体pGBKT7-重组质粒和文库质粒逐步转化到酵母AH109感受态细胞。通过SD/-Trp/-Leu/-His/-Ade和X-α-gal显蓝反应筛选得到阳性克隆,进行测序和BLAST分析。制备小麦原生质体,通过瞬时表达试验共转化报告子和效应子质粒,计算相对荧光值分析转录因子的转录活性。【结果】实时荧光定量PCR结果显示,受盐胁迫的诱导表达。双荧光素酶瞬时表达试验表明TaWRKY33在小麦细胞中可以激活相应荧光素酶的活性。从功能分析,在正常生长条件下转基因拟南芥和野生型拟南芥没有明显差异;在盐处理条件下,转基因拟南芥的根长大于野生型拟南芥的根长;过表达拟南芥的鲜重大于野生型,呈显著性差异。重要的是,在盐处理下,鲜重、相对电导率和Na+含量表明,过表达的小麦较其受体对照有更好的耐盐性。对TaWRKY33候选互作蛋白分析表明,这些候选互作蛋白主要参与植物体的信号转导或免疫过程,表明在植物的逆境信号转导、基因转录调控过程中发挥着重要作用。【结论】小麦受盐胁迫的诱导表达,具有潜在的转录激活活性,提高了转基因拟南芥和小麦的耐盐性;TaWRKY33可能需要其他蛋白共同作用提高小麦耐盐性。
小麦;WRKY转录因子;酵母双杂;蛋白互作;耐盐性
0 引言
【研究意义】作物在生命周期内会不可避免的遭受干旱和高盐等非生物逆境胁迫,影响作物正常的生长,由此造成减产,品质降低,严重影响作物的经济产量。植物在进化过程中形成了一个复杂的信号转导网络[1-2],因此,研究植物对逆境信号的感知、传递以及适应性响应的分子机制,对于阐明植物适应逆境机理,提高作物抗性具有重要意义。【前人研究进展】转录因子(transcription factors,TFs)是信号传递和基因表达调控过程的重要环节。根据基序保守性将植物体众多转录因子[3]分成包括WRKY在内的若干个家族[1-2]。WRKY转录因子在植物中分布广泛,通过信号网络参与多个植物生命过程的调节。WRKY转录因子的N端含有WRKY结构域,在少数WRKY蛋白中其被WRRY、WSKY、WKRY、WVKY或WKKY代替[4]。WRKY家族可以被进一步分为3个亚族GroupⅠ、GroupⅡ和GroupⅢ;依据系统发育数据分析,高等植物WRKY家族GroupⅡ被精确地分为Ⅱa+Ⅱb、Ⅱc和Ⅱd+Ⅱe[5-6]。据报道,WRKY转录因子家族广泛参与植物的生物胁迫响应[7]。近几年,WRKY转录因子通过ABA介导对植物逆境的应答,在受到非生物胁迫信号时,能够调控下游抗逆相关功能基因的表达,增强植株的抗逆性[8-10]。过表达提高了水稻对盐和干旱的抗性[11]。拟南芥调节渗透胁迫应答和气孔运动[12]。过表达和RNA干扰试验表明大豆通过抑制其下游抗逆负调因子的表达,从而提高转基因大豆发状根对盐和干旱的抗性[13]。因此,深入研究WRKY转录因子基因的作用机制对提高作物抗性有着重要的现实意义。一般蛋白质行使功能时,需要与其他蛋白质或者其他分子相互作用才能完成。因而,在蛋白质互作水平上研究蛋白质作用机制对理解蛋白质功能具有重要的意义。研究发现,蛋白激酶级联反应OsMKK4-OsMPK3/OsMPK6调控了水稻WRKY转录因子OsWRKY53的激活活性,从而提高植物抗性[14]。目前,关于小麦WRKY转录因子与其他蛋白之间互作的研究还很少。因此,在小麦中寻找与WRKY转录因子互作的蛋白,对于进一步了解小麦WRKY转录因子的作用机制具有重要意义。【本研究切入点】近年来,对WRKY转录因子的研究除抗病之外还集中在发芽、衰老和响应非生物胁迫几方面。然而,大多数还是集中在模式植物,小麦耐盐WRKY蛋白还鲜有报道。【拟解决的关键问题】He等[15]从小麦中克隆获得一个抗逆相关WRKY转录因子基因,在ABA和干旱应答信号网络中发挥重要作用。本研究拟通过实时荧光定量PCR鉴定在盐胁迫下的表达表达模式,通过转基因小麦和转基因拟南芥研究其对盐的响应;利用酵母双杂交技术以pGBKT7-作为诱饵筛选小麦cDNA文库,得到可能与其互作的候选蛋白,为研究小麦WRKY转录因子的耐盐性提供线索。
1 材料与方法
1.1 植物材料及生长环境
小白麦(L.)获赠于中国农业科学院作物科学研究所景蕊莲研究员。播种及生长条件参考文献[15],通过对温室中2周龄的小麦植株进行盐(150 mmol·L-1NaCl)处理,并分别于0、0.5、1、2、6、12和24 h取样,液氮迅速冷冻,-80℃保存备用。
1.2 小麦原生质体制备及双荧光素酶表达系统
提前配置纤维素酶解液,原生质体制备参考Abel等[16]。选取1周龄小白麦幼嫩的叶片,切成0.5—1 mm,浸入纤维素酶解液中,黑暗条件下,真空泵抽30 min;然后黑暗条件下室温50 r/min酶解约3 h;用W5(154 mmol·L-1NaC1、125 mmol·L-1CaC12、5 mmol·L-1KC1和5 mmol·L-1glucose,pH5.6)溶液润湿的60—100目筛子过滤含有原生质体的酶解液,1 030 r/min离心1 min,收集原生质体;再用适量的预冷的W5温和重悬,冰上静置30 min后1 030 r/min离心1 min,用适量的MMG重悬原生质体,使之终浓度为2×105个/ml。
双荧光素酶系统质粒由中国农业科学院生物所林浩研究员转赠。将报告因子质粒和效应因子质粒共转入110 μl的原生质体,质粒总量为15—20 μg,然后加入1.1×体积的PEG4000溶液,轻柔混合,室温诱导转化30 min。最后用400 μl的W5溶液混合终止反应,1 030 r/min离心1 min,取上清,加入1 ml W5溶液,离心1 min,取上清,加入200 μl W5溶液,23℃黑暗孵育16 h。遵照双荧光素酶检测试剂盒Dual- Luciferase® Reporter Assay System(Promega,E1910)分别检测萤火虫荧光素酶(firefly luciferase)和海肾荧光素酶(renilla luciferase)。瞬时表达试验重复3次。
1.3 载体的构建
将经coRⅠ酶切的酵母双杂诱饵载体pGBKT7(Clontech,美国)和进行连接,并转化大肠杆菌TOP10,筛选正确的阳性克隆。
拟南芥过表达载体的构建:将与经Ⅰ酶切的pCAMBIA1302载体连接,形成pCAMBIA1302重组子,并转染到GV3101根癌农杆菌中。
小麦双元表达载体的构建:将插入到由泛素启动子驱动的pAHC25载体中,作为植物中的筛选标记基因。将构建好的pWMB110转染到EHA105农杆菌中。
1.4 酵母感受态细胞的制备及自激活的验证
按照试剂盒说明书(MATCHMAK2 ER pLexA two-Hybrid User Manual,yeast Protocols Handbook)制备酵母感受态诱饵载体的自激活验证参考文献[17]。
1.5 酵母双杂系统筛选核库及阳性克隆的分析
挑取SD/-Trp单缺平板的单克隆于800 µL的-Trp单缺液体培养基中,30℃,230 r/min振荡培养8 h,用PCR技术进行菌液检测。PCR产物经1%琼脂糖凝胶电泳,将带有pGBKT7-重组质粒的正确酵母菌液制备酵母感受态细胞见于太飞等[17]。核库筛选过程见参考文献[17]。
用1 ml YPDA液体培养基培养阳性酵母单克隆,用于PCR检测。将插入片段大小在1 000 bp左右的酵母单克隆的质粒转化到Trans10(TransGen,北京)感受态,菌液测序结果通过DNAMAN软件进行多重序列比对后在NCBI网站进行BLAST同源性分析。
1.6 荧光定量qRT-PCR分析
用试剂盒(TransGen Biotech,北京)提取不同时间盐处理的小麦样品RNA,反转录合成第一链cDNA。设计引物(F:5′-GCGAGATGC TCAGGGAGGTG-3′,反向引物序列R:5′-ACGGCTGGTTGTTGTAGTGGC-3′)进行表达模式分析,反应体系及扩增程序参考文献[15]。以小麦为内参,每个反应3次重复。按照2-ΔΔCT法分析目的基因的相对表达量及其标准差。
1.7 相对电导率
分别取自然条件下生长和0.6%盐处理条件下两叶期野生型冬小麦和过表达冬小麦叶片0.1 g,浸入20 ml蒸馏水中,抽真空30 min后室温静置2 h,测得起始电导率值S1。然后将试管沸水煮30 min,待冷却至室温测得最终电导率值S2。相对电导率计算公式为REC = S1×100/S2。
2 结果
2.1 TaWRKY33结构及编码氨基酸的保守域分析
前期研究中,从小麦中获得一个干旱响应的WRKY转录因子基因[15],通过进一步解析的结构及编码氨基酸的特点。发现含有2个外显子和1个内含子(图1-A),内含子含有典型的GT-AG序列。经Ensembl Plants基因组数据库BLAST分析,位于小麦6B染色体上。
WRKY转录因子家族序列十分保守,通过在线BLAST分析TaWRKY33蛋白序列,得到CDD中与其WRKY基序(WRKY motif)相似度较高的不同物种的WRKY基因。
通过构建系统发育树,发现小麦TaWRKY33转录因子与TaWRKY4、TaWRKY8相似度很高,与OsWRKY28和OsWRKY71均属于GroupⅡ-a亚组,拟南芥gi15239913、水稻gi115477104、鹰爪豆gi18158619和高粱gi242040565处于同一进化分支,为旁系同源基因,可能由同一祖先进化而来;而与拟南芥gi297846008和另外2个基因虽保守域相同但相似性较低。
2.2 TaWRKY33启动子序列的分析
对干旱、ABA胁迫均有响应[15]。为进一步解析挖掘在逆境响应方面的功能,首先分析了启动子的顺式元件。通过对起始密码子ATG上游1 281 bp序列的分析显示,的启动子区含有多种与逆境应答相关的元件,例如元件HSE(热响应元件)、ABRE(ABA应答元件)、BOXI与Sp1(光应答元件)、MBS(非生物胁迫诱导的MYB结合元件)和TC-rich repeats(与防御和逆境响应相关的元件)等(图2),说明启动子可能对干旱、ABA以外的胁迫有响应。另外还包含与发育相关的顺式元件(图2)。

A:TaWRKY33的基因结构;B:不同物种中WRKY基因的系统发育分析。OS:水稻;Ta:小麦;Rr:鹰爪豆;Sb:高粱;As:燕麦;At:拟南芥;Hv:大麦

图2 TaWRKY33启动子顺式元件分析
2.2 TaWRKY33受盐胁迫的诱导表达
为进一步研究对盐胁迫的响应,用qRT-PCR分析NaCl处理下的表达模式。结果表明,在盐胁迫处理下被缓慢诱导表达(图3)。转录水平在150 mmol·L-1NaCl盐处理后0.5 h时开始上升,在2 h时相对转录水平达到最大值。此后表达量迅速下降,处理后12 h相对表达水平逐渐恢复到本底水平。

图3 TaWRKY33在150 mmol·L-1 NaCl盐处理条件下的表达模式分析
2.3 TaWRKY33提高了转基因拟南芥在盐胁迫下根的伸长
为进一步研究的耐盐性,通过对过表达拟南芥植株进行研究。发现过表达拟南芥和野生型拟南芥在正常条件下生长状态良好,表型无明显差异,表明在正常生长条件下不会影响植物的生长和发育。
通过进一步观察并统计在NaCl处理条件下过表达拟南芥和野生型拟南芥根伸长情况,在正常培养条件下,与野生型拟南芥相比,过表达拟南芥根长无明显差异(图4)。在含有75 mmol·L-1NaCl培养基上,与野生型拟南芥相比,过表达拟南芥的根长较长,达到显著水平;而在含100 mmol·L-1NaCl的培养基上,过表达拟南芥总根与野生型拟南芥的总根长均受到明显的抑制,过表达拟南芥的根长比野生型拟南芥的根长略有优势,说明过表达影响了转基因拟南芥的发芽率(图4-E—图4-F)和根的生长,但在幼苗期对植株的耐盐性只在低盐浓度下有明显效果(图4-A—图4-D)。

A:转基因拟南芥和对照在正常条件下表型;B:转基因拟南芥和对照在75 mmol·L-1NaCl处理条件下表型;C:总根长检测;D:鲜重测量;E:转基因拟南芥和对照在正常100 mmol·L-1NaCl条件下发芽率;F:发芽率统计,误差线表示3次独立试验间的标准差,*表示<0.05,**表示<0.01。下同
A: The phenotype identification of transgenicand control under normal condition; B: The phenotype identification of transgenicand control under 75 mmol·L-1NaCl treatment; C: The detection of total root length; D: The detection offresh weight; E: The germination rate of transgenicand control under normal and 100 mmol·L-1NaCl treatment; F: The detection of germination rate, Error bars indicate SD among three independent replicates. Asterisk (*) denotes significant difference at<0.05. (**) indicated extremely significant difference<0.01 (Student’s test). The same as below
图4 盐胁迫条件下拟南芥的总根长和发芽率
Fig. 4 Total root length ofunder salt stress
2.4 WRKY33蛋白作为核转录激活因子
WRKY类转录因子分为3个亚组。TaWRKY33蛋白属于第二亚组,含有一个保守的WRKY结构域和一个C2H2锌指结构。小麦原生质体瞬时表达证明WRKY33定位在细胞核[15]。为进一步探究其在细胞内的转录活性,利用瞬时双荧光酶系统检测TaWRKY33转录因子在小麦原生质体中的转录活性。融合表达5×GAL4结合位点的Firefly luciferase(LUC)基因作为报告因子,由35S启动子驱动表达的Renilla luciferase(REN)基因作为内参。与此同时,TaWRKY33蛋白融合GAL4结合结构域组成效应子。与对照相比,TaWRKY33明显激活了相关荧光素酶的活性(图5),说明TaWRKY33在植物细胞中具有潜在的转录激活活性。
2.5 诱饵载体的构建及自激活检测
为解析的抗性机理,利用酵母双杂筛选其可能的候选互作蛋白。将编码序列构建到pGBKT7诱饵载体,用PCR技术进行菌液检测,琼脂糖电泳得到与目的片段大小相符的单一条带约1 100 bp(图6),经测序和序列比对,提取正确的重组质粒pGBKT7-TaWRKY33。
为检测的自激活活性,将pGBKT7- TaWRKY33重组质粒转入酵母感受态中,然后涂布于SD/-Trp、SD/-Trp/-Ade和SD/-Trp/-His的固体培养基上,倒置培养2—4 d(图6),只在SD/-Trp培养基长出酵母菌落,而SD/-Trp/-Ade和SD/-Trp/-His平板上没有菌落长出,表明pGBKT7-TaWRKY33成功转入酵母感受态细胞,且TaWRKY33无自激活活性。
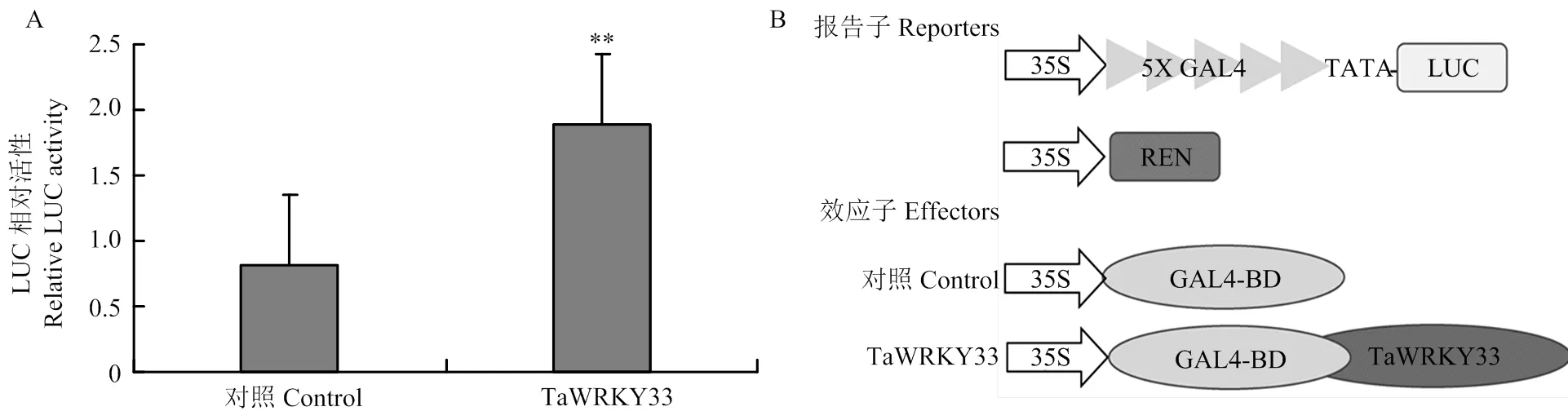
A:小麦原生质体双荧光素酶瞬时表达试验;B:双荧光素酶系统Reporters和Effectors结构图

A:TaWRKY33的扩增;B:TaWRKY33的自激活验证 A: Amplification of TaWRKY33; B: Auto-activity assays of TaWRKY33
2.6 TaWRKY33互作蛋白的筛选
WRKY转录因子多与其他转录因子、激酶相互作用,共同参与植物的抗逆过程。为了进一步解析的抗性机理,利用酵母双杂系统筛选其可能的候选蛋白。利用pGBKT7-诱饵载体筛选小麦cDNA文库,将转化后的酵母细胞涂布于营养缺陷型SD/-Trp/-Leu/-His/-Ade固体平板上,在30℃培养箱中倒置培养4 d左右,挑取直径大于2 mm的单克隆,分别用YPDA培养基活化并点涂于SD/-Trp/- Leu/-His/-Ade/X-α-gal平板上,筛选蓝色阳性克隆(图7-B)。

A:筛库得到的克隆;B:SD/-Ade/-His/-Leu/-Trp/X-α-gal平板上鉴定的阳性克隆
2.7 互作蛋白的序列比对分析
将酵母阳性克隆进行菌液PCR检测,结果显示,筛出的互作基因的片段大部分集中在1 000 bp左右(图8)。提取扩增条带大小在750 bp以上的单克隆酵母质粒,进而转化TOP10大肠杆菌并测序,经BLAST比对(表1),发现筛选出的互作候选蛋白包括介导细胞内代谢物质交换的蛋白、植物抗逆应答及蛋白修复功能相关蛋白和其他 一些编码功能未知蛋白,这些基因可能参与植物能量代谢、胁迫响应、防御、生长发育等一些生理过程。
2.8 转TaWRKY33小麦的耐盐性鉴定
通过对1周龄的T3转小麦和对照科农199(KN199)进行盐胁迫处理,结果显示,在正常生长条件下,转基因小麦的生长趋势与对照相比没有显著差异(图9-A),然而,在盐处理条件下,对照组小麦的萎蔫程度要显著高于转基因小麦(图9-B)。通过对T3转基因小麦和对照KN199进行qRT-PCR分析,结果显示,在转小麦的2个株系中,的表达模式显著高于对照KN199。表明能够在转基因小麦中稳定表达(图9-C)。此时,对盐处理一周的小麦进行钠离子含量、鲜重以及相对电导率进行测定,在正常生长条件下,上述指标在转基因小麦与对照KN199之间无显著差异,而在盐处理条件下,转基因小麦拥有低的相对钠离子含量/电导率以及相对高的鲜重(图9-D—图9-F)。

M:DL2000 Marker;1—8:酵母克隆
3 讨论
3.1 WRKY与多种蛋白互作行使功能
WRKY转录因子通过与含有W-box顺式元件以及MAPK、MAPKK、14-3-3蛋白、钙调素、组蛋白去乙酰化酶、抗性蛋白和其他WRKY转录因子相互作用发挥功能,在调节植物许多生命过程的信号网络中都很重要[17]。早期研究表明,WRKY转录因子主要在调节植物应答病原体侵染和特定发育过程中发挥作用[17]。但是,随着研究的不断深入,发现一些WRKY转录因子同样参与植物对非生物胁迫的应答[18-21]。目前,从干旱处理的小麦转录重测序中找到48个干旱响应的WRKY基因[15]。早先研究发现,拟南芥转录因子和增加了拟南芥的耐盐性[22-24];此外,近年研究表明小麦和通过提高下游相关基因的表达量提高了转基因拟南芥的盐和干旱抗性[34]。在水稻中,的过表达提高了其对高温和干旱的抗性[25]。

A:转基因小麦和对照KN199在正常条件下的表型分析;B:转基因小麦和对照KN199在盐处理条件下的表型分析;C:TaWRKY33在转基因小麦和对照KN199受体中的表达模式分析;D:钠离子相对含量的测定;E:鲜重的测定;F:相对电导率的测定
3.2 候选蛋白的生物功能
为了进一步解析的抗逆机制,本研究筛选了其可能的互作蛋白(表1),包括电控阴离子通道蛋白(VDAC)。VDAC是一类广泛存在于真菌、植物和动物线粒体外膜的蛋白。在水稻、烟草、百脉根、马铃薯、拟南芥和小麦中都有发现[29]。植物VDAC除了在生长发育发面发挥作用,在生物和非生物应答方面也具有功能[29]。因此,TaWRKY33转录因子可能通过与VDAC互作,在植物抗逆调节中发挥着至关重要的作用。另外,有研究表明,乙醇酸氧化酶和ATP合成酶是植物光呼吸反应中重要的2种酶。植物可以通过光呼吸反应调节来增强植物对干旱的抵抗能力[27]。泛素结合酶E2能调控泛素化过程进而调节下游不同靶蛋白。在小麦中已有报导E2连接酶(TaU4)是抗斑枯病的负调因子[30]。另外,当植物受到干旱和高温等非生物胁迫时,E2连接酶的表达可以增强植物的抗逆能力,能对一些损伤或错误折叠的蛋白进行修复[30-33]。本研究利用酵母双杂筛选出的候选蛋白多数参与了植物生长、发育,防御生物胁迫及抵抗非生物胁迫等生物过程。这些也说明了TaWRKY33转录因子可能通过与不同蛋白相互作用,在植物抗逆调节中发挥功能。

表1 候选基因的BLAST分析结果及其推测的功能
3.3 遗传学分析TaWRKY33的耐盐性
越来越多研究表明,过表达逆境应答转录因子对提高作物非生物胁迫抗性是一种可行性策略[26-27]。ABA在植物非生物胁迫应答中发挥重要的作用[15],一系列转录因子和它们的靶基因都参与介导ABA的信号转导,调节许多分子细胞过程。是ABI1/2和下游的正向调节因子,作为植物ABA信号转导途径的重要组;受干燥、低温、高盐和外源性ABA诱导。然而,和在转基因拟南芥中的表达水平明显提高[15]。发现可能在ABA和干旱抗逆应答的信号网络中发挥重要作用[15]。为进一步研究是否参与了耐盐响应,分析了盐胁迫下的表达模式,数据显示盐胁迫激活了的转录表达;而且在盐处理下,的转基因过表达株系的总根长明显高于野生型拟南芥(图4)。据Mahajan等[28]报道,很多提高干旱抗性的转录因子对盐胁迫也有正调作用。近期研究显示,小麦是一个早期盐诱导表达基因,同时具有抗旱特性。过表达的小麦,可能激活了下游逆境应答基因的表达,表现出一定的耐盐性。因此,一些WRKY转录因子基因可能同时参与了植物对干旱和盐胁迫的调控。这些结果为在抗逆研究中提供了新方向。
4 结论
小麦受盐胁迫的诱导表达,的过表达提高了转基因拟南芥在种子萌发期和苗期对低盐的耐性。TaWRKY33转录因子可能通过与其他蛋白相互作用参与转基因拟南芥耐盐调节过程。
[1] Xu Z S, Chen M, Li L C, Ma Y Z. Functions of the erf transcription factor family in plants., 2008, 86(9): 969-977.
[2] Xu Z S, Chen M, Li L C, Ma Y Z. Functions and application of the ap2/erf transcription factor family in crop improvement., 2011, 53(7): 570-585.
[3] Riechmann J L, Heard J, Martin G, Reuber L, Jiang C Z, Keddie J, Adam L, Pineda O, Ratcliffe O J, Samaha R R, Creelman R, Pilgrim M, Broun P, Zhang J Z, Ghandehari D, Sherman B K L, Yu G.transcription factors: genome-wide comparative analysis among eukaryotes., 2000, 290(5499): 2105.
[4] Xie Z, Zhang Z L, Zou X, Huang J, Ruas P, Thompson D, Shen Q J. Annotations and functional analyses of the rice wrky gene superfamily reveal positive and negative regulators of abscisic acid signaling in aleurone cells., 2005, 137(1): 176-189.
[5] Rushton P J, Bokowiec M T, Han S, Zhang H, Brannock J F, Chen X, Laudeman T W, Timko M P. Tobacco transcription factors: Novel insights into transcriptional regulation in the solanaceae., 2008, 147(1): 280-295.
[6] Zhang Y, Wang L. The wrky transcription factor superfamily: Its origin in eukaryotes and expansion in plants., 2005, 5(1): 1.
[7] Dong J, Chen C, Chen Z. Expression profiles of the arabidopsis wrky gene superfamily during plant defense response., 2003, 51(1): 21-37.
[8] Seki M, Umezawa T, Urano K, Shinozaki K. Regulatory metabolic networks in drought stress responses., 2007, 10(3): 296-302.
[9] Ma T, Li M, Zhao A, Xu X, Liu G, Cheng L. Lcwrky5: An unknown function gene from sheepgrass improves drought tolerance in transgenic., 2014, 33(9): 1507-1518.
[10] Lee B h, Henderson D A, Zhu J K. Thecold-responsive transcriptome and its regulation by ice1., 2005, 17(11): 3155-3175.
[11] Qiu Y, Yu D. Over-expression of the stress-induced oswrky45 enhances disease resistance and drought tolerance in., 2009, 65(1): 35-47.
[12] Ding Z J, Yan J Y, Xu X Y, Yu D Q, Li G X, Zhang S Q, Zheng S J. Transcription factor wrky46 regulates osmotic stress responses and stomatal movement independently in., 2014, 79(1): 13-27.
[13] Wang F, Chen H W, Li Q T, Wei W, Li W, Zhang W K, Ma B, Bi Y D, Lai Y C, Liu X L, Man W Q, Zhang J S, Chen S Y. Gmwrky27 interacts with gmmyb174 to reduce expression of gmnac29 for stress tolerance in soybean plants., 2015, 83(2): 224-236.
[14] Chujo T, Miyamoto K, Ogawa S, Masuda Y, Shimizu T, Kishi-Kaboshi M, Takahashi A, Nishizawa Y, Minami E, Nojiri H, Yamane H, Okada K. Overexpression of phosphomimic mutated oswrky53 leads to enhanced blast resistance in rice., 2014, 9(6): e98737.
[15] He G H, Xu J Y, Wang Y X, Liu J M, Li P S, Chen M, Ma Y Z, Xu Z S.Drought-responsive WRKY transcription factor genesandfrom wheat confer drought and/or heat resistance in,2016, 16(1): 116.
[16] Abel S, Theologis A. Transient transformation ofleaf protoplasts: a versatile experimental system to study gene expression., 2010, 5(3): 421-427.
[17] 于太飞, 徐兆师, 李盼松, 陈明, 李连城, 张俊华, 马有志. 小麦蛋白激酶TaMAPK2互作蛋白的筛选与验证. 中国农业科学, 2014, 47(13): 2494-2503.YU T F, XU Z S, LI P S, CHEN M, LI L C, ZHANG J H, MA Y Z. Screening and identification of proteins interacting with TaMAPK2 in wheat. Scientia Agricultura Sinica, 2014, 47(13): 2494-2503. (in Chinese)
[18] 茹京娜, 于太飞, 陈隽, 陈明, 周永斌, 马有志, 徐兆师, 闵东红. 小麦锌指转录因子TaDi19A对低温的响应及其互作蛋白的筛选. 中国农业科学, 2017, 50(13): 2411-2422.RU J N, Yu T F, Chen J, Chen M, ZHOU Y B, Ma Y Z, Xu Z S, MIN D H. Response of wheat zinc-finger transcription factor TaDi19A to cold and its screening of interacting proteins., 2017, 50(13): 2411-2422. (in Chinese)
[19] Rushton P J, Somssich I E, Ringler P, Shen Q J. WRKY transcription factors., 2010, 15(5): 247-258.
[20] Rushton D L, Tripathi P, Rabara R C, Lin J, Ringler P, Boken A K, Langum T J, Smidt L, Boomsma D D, Emme N J, Chen X, Finer J J, Shen Q J, Rushton P J. WRKY transcription factors: Key components in abscisic acid signalling., 2012, 10(1): 2-11.
[21] Li H, Xu Y, Xiao Y, Zhu Z, Xie X, Zhao H, Wang Y. Expression and functional analysis of two genes encoding transcription factors, vpwrky1 and vpwrky2, isolated from chinese wild., 2010, 232(6): 1325-1337.
[22] Zhou Q Y, Tian A G, Zou H F, Xie Z M, Lei G, Huang J, Wang C M, Wang H W, Zhang J S, Chen S Y. Soybean wrky-type transcription factor genes, gmwrky13, gmwrky21, and gmwrky54, confer differential tolerance to abiotic stresses in transgenicplants., 2008, 6(5): 486-503.
[23] Li C, Lv J, Zhao X, Ai X, Zhu X, Wang M, Zhao S, Xia G. Tachp: A wheat zinc finger protein gene down-regulated by abscisic acid and salinity stress plays a positive role in stress tolerance., 2010, 154(1): 211-221.
[24] Li S, Fu Q, Huang W, Yu D. Functional analysis of antranscription factor wrky25 in heat stress., 2009, 28(4): 683-693.
[25] Li S, Fu Q, Chen L, Huang W, Yu D.wrky25, wrky26, and wrky33 coordinate induction of plant thermotolerance., 2011, 233(6): 1237-1252.
[26] Jiang Y, Deyholos M K. Functional characterization ofNaCl-inducible wrky25 and wrky33 transcription factors in abiotic stresses., 2009, 69(1/2): 91-105.
[27] Wu X, Shiroto Y, Kishitani S, Ito Y, Toriyama K. Enhanced heat and drought tolerance in transgenic rice seedlings overexpressing oswrky11 under the control of hsp101 promoter., 2009, 28(1): 21-30.
[28] Bahrini I, Sugisawa M, Kikuchi R, Ogawa T, Kawahigashi H, Ban T, Handa H. Characterization of a wheat transcription factor, tawrky45, and its effect on fusarium head blight resistance in transgenic wheat plants., 2011, 61(2): 121-129.
[29] Turan S, Cornish K, Kumar S. Salinity tolerance in plants: Breeding and genetic engineering., 2012, 6(9): 1337-1348.
[30] Mahajan S, Tuteja N. Cold, salinity and drought stresses: An overview., 2005, 444(2): 139-158.
[31] Takahashi Y, Tateda C. The functions of voltage-dependent anion channels in plants., 2013, 18(8): 917-924.
[32] Millyard L, Lee J, Zhang C, Yates G, Sadanandom A. The ubiquitin conjugating enzyme, tau4 regulates wheat defence against the phytopathogen., 2016, 6: 35683.
[33] Streb P, Shang W, Feierabend J, Bligny R. Divergent strategies of photoprotection in high-mountain plants., 2008, 207: 313-324.
[34] Feussner K, Feussner I, Leopold I, Wasternack C. Isolation of a cDNA coding for an ubiquitin-conjugating enzyme UBC1 of tomato-the first stress-induced UBC of higher plants., 1997, 409(2): 211-215.
[35] Peng R H, Yao Q H, Xiong A S, Fan H Q, Peng Y L. Ubiquitin- conjugating enzyme (E2) confers rice UV protection through phenylalanine ammonia-lyase gene promoter unit., 2003, 45(11): 1351-1358.
[36] Niu CF, Wei W E I, Zhou QY, Tian AG, Hao YJ, Zhang WK, Ma B, Lin Q, Zhang ZB, Zhang JS, Chen SY. Wheat wrky genes tawrky2 and tawrky19 regulate abiotic stress tolerance in transgenicplants., 2012, 35(6): 1156.
Identification and Analysis of Salt Tolerance of Wheat Transcription Factor TaWRKY33 protein
ZHANG HuiYuan1, LIU YongWei2, YANG JunFeng3, ZHANG ShuangXi4, YU TaiFei1,CHEN Jun1, CHEN Ming1, ZHOU YongBin1, MA YouZhi1, XU ZhaoShi1, Fu JinDong1
(1Institute of Crop Science, Chinese Academy of Agricultural Sciences/National Key Facility for Crop Gene Resources and Genetic Improvement/Key Laboratory of Biology and Genetic Improvement of Triticeae Crops, Ministry of Agriculture, Beijing 100081;2Institute of Genetics and Physiology, Hebei Academy of Agriculture and Forestry Sciences/Plant Genetic Engineering Center of Hebei Province, Shijiazhuang 050051;3Hebei Wangfeng Seed Industry Co., Ltd. Xingtai 054900, Hebei;4Institute of Crop Science, Ningxia Academy of Agriculture and Forestry Sciences, Yongning 750105, Ningxia)
【Objective】WRKY transcription factors are one of the largest families of transcriptional regulators in plants which functions in the regulation of various physiological programs, including pathogen defense, growth, development and abiotic stresses. Wheat transcription factorenhanced drought and heat tolerance in transgenic. To further investigate its function and stress response mechanism, this article studied its salt tolerance and screened wheat cDNA library to obtain its putative interacting proteins by yeast two-hybrid system. Meanwhile, dual luciferase system was used to detect transcriptional activity of TaWRKY33 transcription factors.【Method】was tested under salt stress using quantitative real-time PCR (qRT-PCR) based on SYBR Green I technology. The coding sequence ofwas cloned into pBI121 driven by CaMV35S promoter. The construct was transformed mediated byintoplants (Col-0) to obtain transgenic lines. Meanwhile, pWMB110-binary vector was used to create over expressed wheat lines. Homozygous T3seeds oftransgenic lines and T2wheat overexpression lines were used for salt tolerance analysis. The wheat cDNA was used as the template for amplifying thecoding sequence, and the bait plasmid pGBKT7- TaWRKY33 was constructed. We transformed the recombinant plasmid and cDNA library into yeast cell AH109. We screened positive clones via SD/-Trp/-Leu/-His/-Ade and SD/Raf/Gal/X-α-gal plate. Predicted clones were sequenced and analyzed by BLAST. The protoplasts of wheat were prepared, and the reporters and effector plasmids were transformed by transient expression experiments, and the relative fluorescence values were calculated to illustrate transcription activity of transcription factors. 【Result】 qRT-PCR analysis showed thatwas induced by salt. The transient expression experiment of double luciferase showed that TaWRKY33 could activate the luciferase activity in wheat cells. From the perspective of functional analysis, formed longer roots compared with wild type plants, the fresh weight of overexpressingwas significantly different from that of wild type. Importantly, from the perspective of fresh weight, relative electrical conductivity and Na+content in salt treatment showed that wheat with overexpression ofhad better salt tolerance than control. Through preliminary analysis, the candidate proteins screened by yeast two-hybrid system showed influence on signal transduction and immune process, which demonstrates thatplays an important role in stress signal transduction and gene transcription regulation in plants.【Conclusion】 Salt-inducibleimproved salt tolerance in transgenicand wheat and it has potential transcriptional activation activity in cells; TaWRKY33 might function via interacting with a diverse array of protein partners.
; WRKY transcription factor; yeast two-hybrid system; protein interaction; salt tolerance
2018-06-27;
2018-09-12
转基因生物新品种培育重大专项(2018ZX0800909B)、宁夏自然科学基金(NZ17126)、河北省现代农业科技创新工程项目(494-0402- JBN-C7GQ)
张惠媛,E-mail:zhuiyuan31@126.com。刘永伟,E-mail:liuywmail@126.com。张惠媛和刘永伟为同等贡献作者。
徐兆师,E-mail:xuzhaoshi@caas.cn。通信作者付金东,E-mail:fujindong@caas.cn
10.3864/j.issn.0578-1752.2018.24.001
(责任编辑 李莉)

