脑卒中后抑郁患者的炎性因子和脑源性神经营养因子水平变化及相关性分析
李玉雄,郭子运,张雄新
脑卒中具有高发病率、高病死率和高致残率的特点,已成为全世界成年人第二死因与第一致残原因,除了常见的各种神经功能缺损之外,不少患者还伴有明显的抑郁症状,如冷漠、丧失兴趣、睡眠障碍、情绪低落等,即脑卒中后抑郁(post stroke depression, PSD)[1]。作为脑卒中常见的并发症,PSD又属于继发性抑郁症,一般老年人发病较多,但近年来其发病率不断上升且逐渐青年化,不仅会影响脑卒中康复过程中的生活质量和神经功能,还会增加再发卒中的风险[2]。目前,关于PSD的发生机制尚未完全明确,相关学者认为脑卒中患者神经递质的异常分泌、神经营养状态的损伤及神经细胞的过度凋亡均可能导致PSD发生[3]。脑源性神经营养因子(brain derived neurotrophic factor, BDNF)属于神经营养因子,与患者神经营养状态密切相关,被认为是脑卒中后神经元再生的关键因子,且已被临床学者证实与PSD相关[4-5]。本文进一步观察PSD患者BDNF和炎性因子水平变化情况,并分析二者的相关性。
1 资料与方法
1.1一般资料 选取2015年2月—2017年6月在我院神经内科确诊及住院治疗的98例脑卒中患者为研究对象,根据是否发生PSD将其分为PSD组35例和无PSD组63例。PSD组男21例,女14例;年龄45~77(53.59±6.86)岁;受教育年限6~16(12.22±3.10)年;其中有心脏病6例、高血压病史7例、糖尿病病史9例,有吸烟史7例、饮酒史10例。无PSD组男38例,女25例;年龄48~76(55.28±7.55)岁;受教育年限4~16(12.45±2.79)年;其中有心脏病10例、高血压病史13例、糖尿病病史16例,有吸烟史21例、饮酒史19例。两组上述基线临床资料比较差异无统计学意义(P>0.05),具有可比性。
1.2诊断标准 脑卒中以《中国急性缺血性脑卒中诊治指南2014》中相关诊断标准为依据[6],临床主要表现为不同程度的头痛和(或)头晕、意识障碍、言语欠清晰、视物模糊、口角歪斜、肢体无力、局部瘫痪等,均经头颅CT或MRI证实。PSD结合《CCMD-3中国精神障碍分类与诊断标准》中“抑郁症的诊断标准”进行诊断[7],且汉密尔顿抑郁量表(Hamilton depression scale, HAMD)[8]总分>20分,抑郁自评量表(self rating depression scale, SDS)总分>50分。
1.3纳入与排除标准 ①纳入标准:年龄19~80岁;入院时美国国立卫生研究院卒中量表(national institutes of health stroke scale, NIHSS)[9]评分4~12分;神志清楚或治疗后意识清楚,能完成相关量表评估和配合临床检查;近期未服用抗抑郁药物;临床资料及随访资料完整;对本研究的目的和意义知情,且自愿参与研究;本研究经医院伦理委员会批准同意。②排除标准:临床诊断为心源性卒中;动静脉畸形、动脉瘤、颅内肿瘤、烟雾病、血管炎等非动脉粥样硬化所致的脑卒中;存在严重心、肺、肝、肾及血液系统疾病或功能障碍;因严重视力、听力、意识及理解障碍无法完成相关检查;脑卒中之前已明确或可疑的抑郁症患者;观察期间死亡、再次卒中或出血性转化;拒绝参与及中途退出。
1.4相关量表评估 采用NIHSS评分评估两组神经功能缺损程度,评分越高神经功能缺损越严重;采用HAMD、SDS评分评估两组抑郁程度,HAMD评分≥17分为抑郁,>24分为重度抑郁;SDS评分50~59分为轻度抑郁,60~69分为中度抑郁,70分以上为重度抑郁。
1.5指标检测 采集两组空腹12 h后肘静脉血10 ml,室温下3000 r/min离心5 min,取上层血清标本。采用酶联免疫吸附试验法检测BDNF与相关炎性因子水平,包括高敏C反应蛋白(high-sensitivity C reactive protein, hs-CRP)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1(interleukin-1, IL-1)、IL-2、IL-6。所有检测均严格按照试剂盒说明书操作。
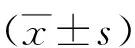
2 结果
2.1两组NIHSS、HAMD和SDS评分比较 PSD组NIHSS、HAMD和SDS评分均显著高于无PSD组(P<0.05)。见表1。

表1 两组脑卒中患者的NIHSS、HAMD和SDS评分比较分)
2.2两组血清BDNF与炎性因子水平比较 PSD组血清BDNF水平显著低于无PSD组,hs-CRP、TNF-α、IL-1、IL-2和IL-6水平显著高于无PSD组(P<0.05)。见表2。
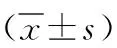
表2 两组脑卒中患者的血清BDNF与炎性因子水平比较
2.3不同抑郁程度PSD患者血清BDNF与炎性因子水平比较 轻度、中度、重度抑郁PSD患者血清BDNF水平依次降低,hs-CRP、TNF-α、IL-1、IL-2、IL-6水平依次升高,比较差异均有统计学意义(P<0.05)。见表3。
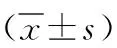
表3 不同抑郁程度PSD患者血清BDNF与炎性因子水平比较
2.4抑郁程度与血清BDNF及炎性因子的相关性 PSD患者抑郁程度与血清BDNF呈高度负相关(r=-0.83,P<0.05),与血清hs-CRP、TNF-α、IL-1和IL-2呈中度正相关(r=0.55、0.56、0.52和0.51,P均<0.05),与IL-6呈高度正相关(r=0.81,P<0.05)。
2.5血清BDNF与相关量表评分及炎性因子的相关性 PSD患者血清BDNF水平与NIHSS、HAMD和SDS评分呈中度负相关(r=-0.51、-0.51、-0.53,P均<0.05),与血清hs-CRP、TNF-α、IL-1和IL-2呈高度负相关(r=-0.85、-0.82、-0.80、-0.87,P均<0.05)。
3 讨论
PSD的发生涉及心理-社会-生物因素3个方面,目前其具体病因和发病机制尚不明确。人体神经-内分泌-免疫系统之间相互发生联系和作用,共同对体内环境稳定状态进行有效调节和维持;同时,大脑与免疫系统构成一种双向调控的联络网,其中炎性因子大量激活可导致人体在生理、行为、情感和认知等方面出现显著性改变[10]。有学者通过研究抑郁症的发病机制发现,hs-CRP、TNF-α、IL-6等与非器质性抑郁症之间存在密切的相关性,炎性因子能有效调节机体免疫状态,还可广泛调节中枢神经系统,对神经递质分泌、合成及生理代谢产生重要影响,并且推断血清相关炎性因子在抑郁症、缺血性脑疾病等发病机制中扮演重要角色[11-12]。还有研究证实,非器质性抑郁症患者血清IL-1、IL-2、IL-6、hs-CRP、TNF-α等细胞因子表达水平明显升高,认为PSD患者与上述炎性因子表达水平失衡存在密切的相关性,在PSD的发病机制中发挥着重要的作用[13]。牛海玲等[14]研究发现,发病第28天时PSD组血清IL-1、IL-2、IL-6、TNF-α表达水平明显高于无抑郁症脑卒中患者,且重度抑郁症患者体内免疫系统均被激活,进而产生炎性反应,而轻、中度抑郁症患者体内免疫系统可能被抑制。
本研究结果显示,与无PSD组比较,PSD组血清BDNF水平显著降低,hs-CRP、TNF-α、IL-1、IL-2、IL-6水平显著升高,且轻度、中度、重度抑郁患者血清BDNF水平依次降低,hs-CRP、TNF-α、IL-1、IL-2、IL-6水平依次升高,提示上述炎性因子可能参与PSD的发生发展。BDNF是神经营养因子家族中的主要成员,广泛分布于脑组织与外周血,其中在海马齿状回和皮层的含量最高,具有神经细胞营养、修复和再生调控等生理功能[15]。傅晓艳等[16]的研究证实,在PSD大鼠海马内BDNF的过表达可改善对PSD的抑郁样行为,发挥神经保护作用。李婛等[17]研究结果显示,血清BDNF水平是PSD的独立保护因素,并指出BDNF可降低谷氨酸兴奋对神经元的不良反应,可营养支持5-羟色胺神经元、多巴胺神经元及增强突触的动力,是脑卒中后神经元再生的关键分子。赵轲等[18]的研究结果则显示,非PSD患者的BDNF水平著高于PSD组,HAMD、NIHSS评分显著低于PSD组,认为早期检测血清BDNF可作为预测PSD的生物学指标,与本研究上述观点相符。
此外,本研究相关性分析结果显示,PSD患者抑郁程度与血清BDNF呈高度负相关,与血清hs-CRP、TNF-α、IL-1和IL-2呈中度正相关,与IL-6呈高度正相关,且PSD患者血清BDNF水平与NIHSS、HAMD和SDS评分呈中度负相关,与血清hs-CRP、TNF-α、IL-1和IL-2呈高度负相关。进一步证实了炎性因子及BDNF在PSD发病机制中的重要地位,且二者具有显著相关性,可相互影响。与李晓鹤[19]的观点一致。为此,建议临床应该针对PSD患者给予积极治疗,重点调节其血清炎性因子及BDNF水平以减轻神经功能损伤及抑郁程度。

