透明质酸在胃癌和不同胃病中的表达以及Hp对其表达影响的研究
胃癌(gastric cancer,GC)是现阶段消化系统最常见的恶性肿瘤,胃癌在全球恶性肿瘤发病率中居于第4位,在全球恶性肿瘤致死率中居于第2位,严重威胁人们的健康生活乃至生命安全[1-2]。现阶段,中国每年胃癌新发患者可达44万人,但由于胃癌早期无明显症状,患者往往会无法引起重视,早期胃癌检出率仅仅为早期胃癌发病率的1/10,患者错过早期优质治疗时间,严重危害患者预后[3-4]。研究显示萎缩性胃炎则有可能逐渐发展癌,但具体的分子致病机制尚不明确[5]。透明质酸(hyaluronic acid,HA)是细胞外基质的主要组成成分,通过与细胞表面受体的结合来起到细胞与细胞以及细胞与细胞外基质的黏附、信息交流、运动等诸多功能,是癌细胞增殖、分化、浸润、转移的重要参与者[6-7]。现阶段有研究认为透明质酸与肝癌、肠癌、肺癌等恶性肿瘤的复发和转移有着密切关系,但有关胃癌的研究还比较少见[8]。本次研究采用酶联免疫吸附法测定胃癌患者以及癌前疾病患者的血HA值,探讨HA在胃癌及癌前疾病中的表达,并进一步分析了Hp感染对其表达的影响,现将研究结果报道如下。
1 资料与方法
1.1 一般资料
选取2015年2月—2018年2月在我院接受治疗的92例胃癌和不同胃病的患者作为研究对象。其中,男性患者53例,女性患者39例,年龄31~81岁,平均年龄为(56.31±7.26)岁;Hp检验阳性患者46例,Hp检验阴性患者46例。按照患者胃病发展情况,将其分为浅表性胃炎(superficial gastritis,SG)组、萎缩性胃炎(atrophic gastritis,AG)组和胃癌(gastric cancer,GC)组。GC患者32例,其中,男性患者17例,女性患者15例,Hp检验阳性患者16例,Hp检验阴性患者16例;SG患者38例,其中,男性患者23例,女性患者15例;Hp检验阳性患者21例,Hp检验阴性患者17例;AG患者22例,其中,男性患者13例,女性患者9例;Hp检验阳性患者9例,Hp检验阴性患者13例。纳入标准:(1)本次研究中所有患者均经过内镜检查或病理活检确认病情,其中胃癌患者诊断均符合WHO胃癌诊断标准;(2)患者及家属均对本次研究知情且同意参与本次研究。排除标准:患者存在其他恶性肿瘤或血液性疾病。本次研究经过医院伦理会审核通过。
1.2 检测指标与方法
采用ELISA法检测血清透明质酸含量,具体方法如下:清晨抽取患者空腹外周血4 ml,室内静置2小时后,采用3 000 r/min速度离心12 min,分离上清液后置于-70℃环境下保存待检,采用美国cell signal公司生产的ELISA试剂盒进行测定,操作按照试剂盒说明进行,采用酶标仪MK3测量。
通过检测患者血清H.pylori-IgG抗体滴度判断患者Hp感染是否阳性,具体方法如下:清晨抽取患者空腹外周血,采用芬兰BIOHIT公司生产的Helicobacter pylori ELESA 试剂盒检测,EIU显示≥34即诊断为H.pylori感染阳性。
1.3 统计学方法
采用SPSS 19.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,两个样本均数比较采用t检验,多于两组样本均数的比较,采用方差分析(ANOVA);计数资料以(n,%)表示,采用χ2检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 透明质酸在不同胃部疾病患者中的表达比较
GC组患者血HA值高于SG组和AG组患者,差异具有统计学意义(P<0.05)。其中,AG组患者血HA值高于SG组患者,差异具有统计学意义(P<0.05)。见表1。
表1 透明质酸在不同胃部疾病患者中的表达比较(±s,ng/ml)

表1 透明质酸在不同胃部疾病患者中的表达比较(±s,ng/ml)
注:GC组血HA值vs.AG组血HA值,t=2.202,P=0.032;AG组血HA值vs.SG组血HA值,t=3.313,P=0.002;GC组血HA值vs.SG组血HA值,t=6.094,P<0.001。
GC组 32 14.72±4.43 AG组 22 12.11±4.18 SG组 38 8.32±4.38 F值 - 19.120 P值 - <0.001
2.2 透明质酸在不同Hp感染下不同胃部疾病患者中的表达比较
三组的Hp感染阴性患者血HA值比较,差异无统计学意义(P>0.05);Hp感染阳性的患者血HA值随疾病加重不断升高,GC组患者的血HA值高于其他两组,差异均具有统计学意义(P<0.05)。同组患者在不同Hp感染下HA水平比较,差异无统计学意义(P>0.05)。见表2。
3 讨论
患者胃部疾病往往从浅表性胃炎开始,当疾病恶化逐渐成为萎缩性胃炎等癌前疾病后则会逐渐发展成癌[9-10]。近年来,大量关于胃癌的研究发现,透明质酸是癌症细胞增殖、分化、迁移、粘附甚至肿瘤血管形成的重要参与成分,在肿瘤的增长和迁移中起着重要作用[11-12]。透明质酸是细胞与癌旁间质细胞相互作用组成的肿瘤微环境的重要组成部分,而肿瘤微环境则是胃癌发生的重要原因之一,因此HA在胃癌治疗中的作用不容忽视[13-14]。现阶段医学界关于HA与胃癌的研究往往集中在HA表达与胃癌预后的关系以及HA在各种胃癌手术以及术后并发症中的作用,已知HA在癌中表达增强的原因主要有3个方面:(1)合成增加;(2)代谢增强;(3)肿瘤细胞发生的上皮一间质转化。这些表达增强的HA可以刺激肿瘤细胞的非停泊性生长及增殖,也可与肿瘤细胞膜上的HA受体结合后,形成保护性外壳,降低免疫细胞对肿瘤细胞的黏附和攻击;也可使受体蛋白质相关的酪氨酸激酶磷酸化,产生一系列细胞内信号,使细胞骨架发生移动,引发肿瘤细胞伪足样伸展运动,从而增强肿瘤细胞的运动性和趋化性。但是目前关于HA与早期胃癌以及癌前疾病中表达情况的研究比较少见[15]。Hp感染是胃癌的主要致病因素之一,但是关于Hp感染对胃癌及癌前疾病患者HA表达影响的研究仍十分少见。
表2 透明质酸在不同Hp感染下不同胃部疾病者中的表达比较(±s,ng/ml)
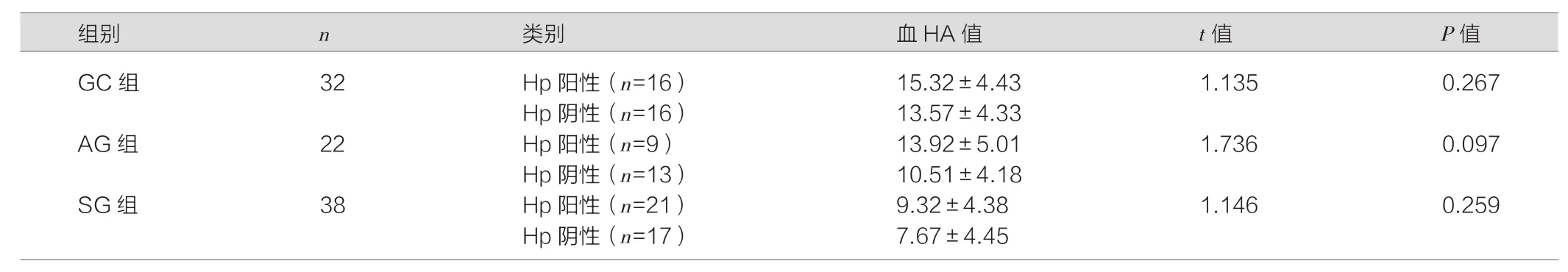
表2 透明质酸在不同Hp感染下不同胃部疾病者中的表达比较(±s,ng/ml)
注:三组的Hp感染阴性患者血HA值比较,F=0.270,P=0.788;三组的Hp感染阳性患者血HA值比较,F=11.999,P<0.001。
GC组 32 Hp阳性(n=16) 15.32±4.43 1.135 0.267 Hp阴性(n=16) 13.57±4.33 AG组 22 Hp阳性(n=9) 13.92±5.01 1.736 0.097 Hp阴性(n=13) 10.51±4.18 SG组 38 Hp阳性(n=21) 9.32±4.38 1.146 0.259 Hp阴性(n=17) 7.67±4.45
过往研究认为HA的表达与胃癌的侵袭转移以及胃癌预后有关,HA的高表达往往预示着不良预后,但具体作用机制尚不明确,本次研究中患者血HA值随患者疾病发展逐渐升高,癌症患者血HA值高于浅表性胃炎和萎缩性胃炎患者,差异具有统计学意义(P<0.05)。其中萎缩性胃炎患者血HA值高于浅表性胃炎患者,差异具有统计学意义(P<0.05)。分析原因可能是随着病情恶化,癌细胞发生上皮-间质转化,HA一方面刺激癌细胞增殖,另一方面与细胞表面受体结合形成保护层,进而降低免疫细胞的攻击,癌细胞增殖后进一步刺激HA表达。我们已知HA具有很多有利的生理功能如空间填充、水化组织、抗血管生成、抑制凋亡、抑制免疫反应和炎症反应等。上述结果提示在感染了Hp的非GC患者中HA主要起到抑制炎症反应的作用,随着病情的恶化,HA表达越高,因此HA也可以反映病情的恶化程度。进一步研究发现三组Hp感染阴性的患者血HA值比较,差异无统计学意义(P>0.05),Hp感染阳性的患者血HA值随疾病加重不断升高,GC组患者的血HA值高于其他两组,差异具有统计学意义(P<0.05)。原因可能是幽门螺旋杆菌通过影响多种受体间接影响HA的表达,这也提示我们,在Hp感染的环境下,HA可以更好地反映疾病的进展情况。
综上所述,透明质酸可以有效反映患者胃部疾病的严重程度,Hp感染可以影响患者透明质酸表达,且在Hp感染环境下HA可以更好地反映胃部疾病的进展情况。

