屈光参差性弱视儿童脑网络功能连接的fMRI研究
王浩然,张 希,王天月,李 倩,李青吉,郭明霞
(1.天津医科大学医学影像学院,天津 300203,2.天津市泰达医院设备科,天津 300457,3.天津市肿瘤医院放射科,天津 300060,4.天津市爱尔眼科医院综合科,天津 300384)
弱视作为一种常见的视觉疾病,是儿童低视力的主要原因,主要是由于视觉发育的早期阶段双眼接受异常的视觉经验所致[1]。近年来,越来越多的研究采用静息状态功能磁共振成像 (resting-state functional magnetic resonance imaging,rs-fMRI)技术来探索弱视患者的大脑皮层结构和功能的异常。研究发现,弱视患者存在多脑区功能、白质结构及灰质形态的损伤[2],而且损伤不仅存在于视觉皮层、背侧及腹侧视觉通路,还存在于视觉注意、视觉认知相关的高级脑区;损伤不仅表现为多个独立脑区的变化,还表现为这些脑区间功能连接的变化[3]。然而,这些关于弱视的研究都是弱视患者脑区之间功能变化的研究。大脑活动实际上是脑网络的活动。视觉认知功能的变化可能与网络功能连接的变化密切相关。多变量模式分析(Multivariate Pattern Analysis,MVPA)方法是对传统单变量分析的一种有效补充,它可以通过使用机器学习算法训练分类器来更全面地解码fMRI数据中的变量[4]。本研究结合MVPA方法,单变量分析方法,以及静息态功能连接(resting state functional connectivity,rsFC)分析方法对屈光参差性弱视儿童(AAC)和正常视力儿童(NSC)进行分类和组间比较,探索屈光参差性弱视儿童长期异常视觉经验对其静息态下脑网络内和网络间功能连接的影响,为进一步了解弱视对脑功能的影响提供实验依据。
1 对象和方法
1.1 研究对象 对14例屈光参差性弱视儿童[11例男性,3例女性;年龄:(9.67 ± 2.9)岁,5~15 岁]和9例与之年龄、性别相匹配的正常视力儿童[男6例,女 3 例;年龄(11.37±2.9)岁,5~15 岁]进行 fMRI检查。所有被试均接受了一系列的眼科检查,包括视力测试、眼内压和屈光测试、眼能动力和眼底检查等。弱视眼矫正视力≤0.6,对侧非弱视眼的裸眼或最佳矫正视力≥0.9的患者被确诊为单眼屈光参差性弱视。所有对照组儿童的双眼裸眼视力或最佳矫正视力均≥1.0。并且,所有被试均无中枢神经系统器质性病变、精神病史或者MRI禁忌症。
1.2 数据采集与预处理 所有被试的静息态fMRI数据均采用GE 1.5T磁共振扫描仪(SignaHDx1.5 Tesla MR Scanner)扫描获得。在扫描期间,所有被试都被要求要保持睁眼状态,身体放松,避免凝视和进行具体的思维活动。扫描参数如下:TR=2 000 ms,TE=60ms,FA=90°,matrix=64×64,FOV=220×220mm2,层厚5 mm,层间隔1 mm,共22层,共采集184个时间点的数据。本研究抛弃前4个时间点,选取后续的180个时间点数据用作分析。用DPARSF软件对fMRI数据进行预处理:层面时间校正、头动校正、空间标准化和重采样、去线性及带通滤波(0.01~0.08 Hz)。排除头动平动超过3 mm、转动超过3°的被试数据。计算每个被试的图像帧位移量(FD),排除平均FD大于0.5的被试数据。并通过多重线性回归去除噪声的干扰,包括:6个头动参数、平均脑脊液信号以及平均白质信号。最后,使用半高全宽(full width at half maxima,FWHM)为8 mm的高斯内核对fMRI图像数据进行空间平滑。
1.3 基于体素的脑网络内和网络间rsFC分析 本研究参考前人文献中背侧注意网络(DAN)、默认网络(DMN)、额定控制网络(FPCN)、腹侧注意网络(VAN)和视觉网络(VN)的关键节点 MNI坐标(表1)[5]。以坐标位置为球心,8 mm为半径建立种子点,共定义了大脑双侧60个种子点。使用每个种子点的平均时间序列,计算其与全脑每个体素时间序列之间的Pearson相关系数,得到每个被试基于每个种子点的rsFC全脑空间分布图。经过Fisher-z变换之后,60个种子点分别得到60组全脑功能连接z值图。而后分别进行60次独立的探照灯法MVPA分析。

表1 网络关键节点坐标Tab 1 Coordinates of keynetwork seeds
探照灯法MVPA的步骤如下:
①以每个体素为中心及半径4 mm范围内的体素作为分类特征,AAC组的分类标签为1,NSC组的分类标签为0;
②留一交叉验证(LOOCV):依次将每个被试的数据轮流作为测试集,通过预测该被试的分类标签得到分类正确率,N个被试得到N个正确率;
③为了避免支持向量机(SVM)分类器在不平衡数据集上进行训练和测试时产生偏差,取AAC组和NSC组正确率的算术平均值得到最终的平衡正确率,并将该正确率归为其对应的中心体素的值;
④对每个体素重复步骤①-③得到所有体素正确率组成的最终分辨图;
⑤使用最终分辨图来检测对AAC组脑网络关键节点的rsFC分类正确率(CA)较高的脑区;
⑥置换检验:i个(i=1 000)排列顺序均不同的随机标签,对每一个随机标签重复步骤①-④,得到i个最高CA的集合,建立随机标签最高CA结果的零分布;
⑦Family-wise error(FWE)多重比较校正后的P值是由正确标签所得到的最终CA小于或等于由随机标签所得到的最高CA零分布的概率,P≤0.05时,CA结果显著;
⑧得到CA较高且显著的结果脑区。
网络节点与对应结果脑区之间的rsFC便是能够显著区分AAC组和NSC组的rsFC。采用SPSS18.0(Statistical Package for the Social Science version 18.0,Chicago,IL,USA)对网络节点与对应结果脑区之间的rsFC进行单样本t检验及双样本t检验得到组间差异。根据结果脑区的峰值点坐标参考前人的脑网络划分确定其所属的本征脑网络[5],包括 DMN、DAN、FPCN、VAN、VN、感觉运动网络(SMN)、边缘系统(Limbic system)和皮质下脑区(Subcortex)。根据网络关键节点和结果脑区的网络位置,确定它们之间能够显著区分AAC组和NSC组的rsFC所属的网络连接。再根据各网络连接内所包含的功能连接的个数,得到所有功能连接的网络分布情况。
1.4 基于感兴趣区的脑网络内和网络间rsFC分析 将探照灯法MVPA得到的结果脑区作为感兴趣区(ROI),用Pearson相关系数求每个被试n个ROI两两之间的功能连接,得到n×n的对称矩阵。经过z变换后,取其下三角矩阵,得到一个n(n-1)/2维的特征向量作为分类特征。鉴于样本数量远小于特征向量的数量,我们使用基于权重的特征选取SVM策略来检测AAC组和NSC组之间具有辨别力的特征向量。同样采用LOOCV来估计分类器性能,在每一次的交叉验证期间,SVM分类器根据每个特征向量的分类权重对其进行排序,找到具有较高权重的特征向量,并递归循环逐渐增加特征向量集的尺寸,找到拥有最高CA的特征向量集,并得到相应的CA以及该特征集所包含的各个特征向量的分类权重。随后,使用2 000个随机标签对得到的最终CA进行置换检验,得到随机标签CA结果的零分布。P≤0.05时,CA结果显著。
在每次LOOCV中,选取的特征会有所不同,其中每次都被选到的特征是弱视儿童发生异常的一致特征。使用SPSS18.0对一致特征进行单样本t检验及双样本t检验来检测其在AAC组和NSC组之间的组间差异。并根据各ROI的网络位置,确定所有一致特征所属的网络连接,通过对每个网络连接里所包含的一致特征的权重相加得到所有一致特征的网络分布情况。
2 结果
2.1 AAC组基于体素的脑网络内和网络间rsFC变化 探照灯法MVPA能够成功对AAC组和NSC组的脑网络关键节点与全脑体素之间的rsFC进行分类,并得到CA显著较高的结果脑区(CA>85%,P<0.05,置换检验,1 000 次,FWE 校正)。各网络的关键节点所得到的结果脑区如图1 a-e所示。各网络的关键节点与对应结果脑区之间的rsFC分别在AAC组和NSC组中的具体平均值及组间差异情况如图1 f-j所示。网络关键节点与结果脑区之间能够显著区分AAC组和NSC组的rsFC主要分布在DMN网络和DAN网络内部,以及DMN网络分别与FPCN网络、DAN网络和VAN网络之间(图2)。单变量分析的结果显示,其中,AAC组的DMN网络和DAN网络内部,以及DMN网络分别与FPCN网络和DAN网络之间的rsFC均减弱。
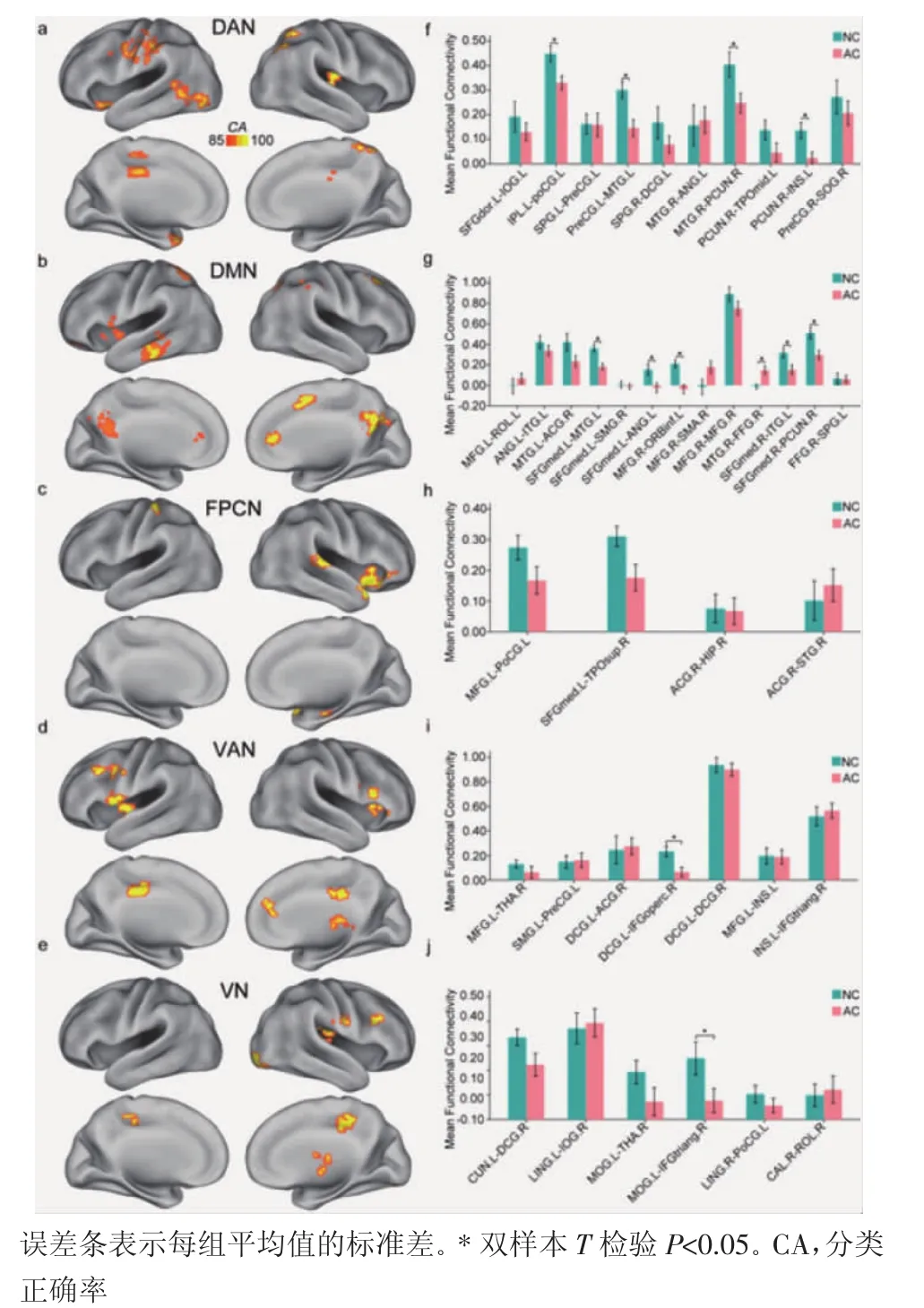
图1 探照灯法MVPA得到的DAN网络 (图a)、DMN网络 (图b)、FPCN网络(图c)、VAN网络(图d)和VN网络(图e)关键节点的对应结果脑区;各网络的关键节点与其对应结果脑区之间功能连接在AAC组和NSC组中均值的条形图Fig 1 The brain regions of seeds form DAN(a),DMN(b),FPCN(c),VAN(d)and VN(e)obtained by searchlight MVPA;Bar plot showing the average values of the functional connectivity between seeds of each network and the brain regions for the AAC and NSC groups

图2 网络关键节点与结果脑区之间功能连接的网络分布Fig 2 The network distribution of functional connectivity between network seeds and the brain regions
2.2 AAC组基于ROI的脑网络内和网络间rsFC变化 基于权重的特征选取MVPA能够显著区分AAC组和NSC组之间基于ROI的rsFC,分类正确率为86.95%(P<0.001,置换检验,2 000次)。经过交叉验证之后,共有131个在AAC组发生异常的一致特征(图3)。并且,一致特征主要分布在DMN内部,DMN网络分别与FPCN网络、DAN网络和SMN网络之间,以及VAN网络与皮质下脑区之间(图4)。单变量分析的结果显示,其中,AAC组的DMN网络内部,DMN网络分别与FPCN网络、DAN网络以及SMN网络之间,以及VAN与皮质下区域之间的rsFC均减弱。其中,DMN网络内部以及DMN网络分别与FPCN网络和DAN网络之间的rsFC变化结果与探照灯MVPA方法得到的结果一致。

图3 131个一致特征的示意图Fig 3 Illustration of 131 consensus features
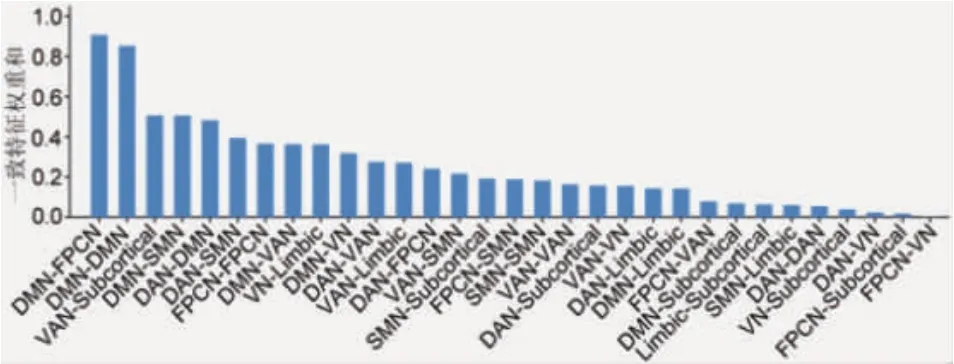
图4 131个一致特征的的网络分布情况Fig 4 The network distribution of 131 consensus features
3 讨论
本研究的结果表明,多变量模式分析方法可以对弱视儿童和正常视力儿童的脑网络内和网络间的功能连接进行分类,并且弱视儿童的rsFC在DMN网络内部以及DMN网络分别与FPCN网络和DAN网络之间均减弱。DMN网络是一个高级认知网络,在大脑执行各种注意力需求或目标导向任务时处于负激活状态,而在大脑处于静息状态时呈激活状态。研究表明,当被试处于无约束的被动状态时,整个DMN网络系统与内部导向认知即自发认知的功能相关联,特别是当被试回忆过去发生过的事情和规划未来目标时[6-7]。前内侧前额叶皮质和后扣带回作为DMN网络的关键节点在整个DMN网络系统中功能连接分布水平较高,从而在集成DMN网络的功能上发挥着关键作用[6-8]。并且,前人的研究发现,屈光参差性弱视患者的内侧前额叶皮质和后扣带回的局部一致性和功能连接密度均显著减弱[9-10]。因此,我们的研究结果与前人的研究结果一致。相比于DMN网络与内部导向认知相关,DAN网络在支持外部导向认知上发挥着重要作用[11]。由于不同的网络具有不同的特定功能,需要外部指导注意力的任务通常会通过激活DAN网络的活动同时抑制DMN网络的活动来确保有足够的注意力处理外部信息,反之亦然[12]。而DMN网络和DAN网络之间的rsFC减弱则意味着两者之间的功能连接有效性减弱。FPCN网络包含了一系列被认定为支持认知控制的脑区,它可以作为一个灵活的网络中枢,根据具体的任务来改变与其它神经网络之间的功能连接[13]。Spreng等发现,在自传计划任务期间FPCN网络的活动与DMN网络相耦合,而与DAN网络脱耦合;在视觉空间规划任务期间,FPCN网络的活动与DAN网络相耦合,而与DMN网络脱耦合[14]。并且在随后的研究中提出FPCN网络在目标导向认知中扮演着一个重要的“守门人”角色,其通过灵活的与DMN网络或者DAN网络相耦合来分别支持内部指导性认知和外部指导性认知的过程[15]。因此,DMN网络、DAN网络和FPCN网络三者之间的相互作用形成了一个负责调节外部和内部导向认知之间动态平衡和相关转换的重要系统。而在弱视儿童组中观察到的DMN网络内部,DMN网络与FPCN网络和DAN网络之间的rsFCs减弱可能表明弱视儿童在调节外部和内部导向认知之间的动态平衡和相互转换以满足任务需求的能力减弱。
综上,基于脑网络功能连接的多变量模式分析可以将弱视儿童识别出来。同时,本研究还发现了弱视儿童的脑网络内和网络间功能连接的变化。然而,该研究也存在一些局限性:第一,样本数目偏小;第二,fMRI数据图像的空间分辨率相对较低。

