木犀草素对甲状腺乳头状癌TPC-1细胞侵袭迁移的影响及其机制
钟 烨,王 超,徐 博,刘春辉,陈建立,王晓涛,田 炜,张国志*
(1.华北理工大学附属医院,河北 唐山 063000;2.开封市中心医院,河南 开封 475000;3. 华北理工大学医学实验研究中心,河北 唐山 063000)
甲状腺癌病理类型主要分为乳头状癌、滤泡状癌、未分化癌、髓样癌,其中甲状腺乳头状癌(thyroid papillary carcinoma,PTC)约占甲状腺肿瘤的60%,近年来发病率呈现逐年增加的趋势,多发于女性和儿童[1-2]。 PTC主要采用放射性I131和手术切除两种治疗方法,大部分的PTC虽然预后良好,十年生存率达到90%以上,但是部分患者复发率高、预后差,早期远处淋巴结的转移增加了手术治疗的风险性及其预后的复发率[3]。因此研究出一种副作用低、且有效地抑制PTC淋巴结转移的药物成为该领域研究的热点。木犀草素(luteolin,LUT)是一种天然存在的多酚黄酮,以糖苷形式存在于各种水果和蔬菜中,近年来在有关LUT在肿瘤领域的研究逐渐受到重视[4]。一些富含LUT的植物所衍生的饮食,可能通过一定的药理学活性发挥抗炎、抗癌、抗过敏等作用,从而在减少一些疾病中发挥重要作用[5]。研究表明,LUT在肝癌、结肠癌、卵巢癌等多种肿瘤中,具有抑制细胞的增殖、侵袭和转移能力[6-10]。但是LUT在PTC中的作用机制尚不清楚,本研究将不同浓度的LUT与人甲状腺乳头状癌TPC-1细胞共同培养后,探讨LUT对TPC-1细胞侵袭、迁移能力的影响及其可能的机制,从而为甲状腺乳头状癌新药的开发提供新思路。
1 材料和方法
1.1 实验材料
人甲状腺乳头状癌细胞TPC-1由天津医科大学基础医学院馈赠,胎牛血清(FBS)、DMEM培养基(Gibco公司),RNA提取相关试剂盒(日本TaKaRa公司),聚合酶链反应试剂盒、qRT-PCR引物(美国Invitrogen公司),逆转录试剂盒(北京GenStar公司),兔抗人MMP2、MMP9多克隆抗体(英国Abcam公司)、兔抗人AKT、p-AKT多克隆抗体(美国CST公司),HR标记的山羊抗兔二抗、MTT细胞增殖及细胞毒性检测试剂盒及相关western试剂盒(上海碧云天公司),Transwell小室(美国Corning 公司),Matrigel(北京索莱宝科技有限公司),二甲基亚砜(DMSO)、木犀草素(美国Sigma公司),用DMSO溶解木犀草素(浓度为100 μmol/L),实验中其余药物浓度的配制均采用培养基稀释。qRT-PCR仪器(中国香港Gene Company Iimited公司),高分辨率倒置显微镜(日本Olympus公司)。
1.2 实验方法
1.2.1 细胞培养
处于对数生长期的人甲状腺乳头状癌TPC-1细胞的培养使用含10%胎牛血清的DMEM培养基,置于饱和湿度37℃、5% CO2孵箱中常规培养。
1.2.2 MTT检测细胞的增殖活性
首先将处于对数生长期的TPC-1细胞常规传代培养,然后消化制备成密度为每毫升3×104的单细胞悬液,吹打均匀后取出每孔100 μL(密度每毫升3×104)细胞均匀接种于96孔板中,在每个96孔板周边加上等量的磷酸缓冲盐溶液(PBS), 放入细胞孵育箱中常规培养,待细胞贴壁后用不含有FBS的培养基同步化。12 h后弃掉培养基,用PBS冲洗3遍,将细胞分为3组,空白对照组中加入DMSO(终浓度小于0.1%),其余各组加入不同浓度的木犀草素(终浓度分别20 μmol/L, 40 μmol/L),每组设置9个复孔,结果取9个复孔的平均值。分别培养24 h、48 h、72 h后,加入MTT(浓度为5 mg/mL)溶液10 μL,置于37℃细胞恒温箱中4 h。弃掉培养基,每孔加入100 μL的DMSO,继续放入37℃恒温培养箱的摇床上震荡反应约10 min。用酶标仪在波长490 nm测量每孔的吸光度(即OD值),OD值越大,各孔细胞的存活数越多。OD值表示细胞的增殖活性。
1.2.3 Transwell小室法检测细胞的迁移能力
将空白对照组(加入等量的DMSO)及不同浓度木犀草素(终浓度为20 μmol/L, 40 μmol/L)培养的TPC-1的细胞,消化后制备成单细胞悬液(密度每毫升4×105)。分别取出200 μL/组细胞悬液均匀接种于Transwell小室的上室膜表面,然后取600 μL不含双抗的10% FBS的DMEM培养基加入下室内。置于细胞孵箱中常规培养,24 h后清除未穿透上室膜表面的细胞,PBS冲洗3遍,将穿过小室膜而黏附于下室面的细胞使用4%多聚甲醛固定30 min以上,苏木素染色。使用100倍的倒置显微镜观察,随机选取每组5个视野,计算穿膜细胞数平均值。平行实验重复3次。
1.2.4 Transwell小室法检测细胞的侵袭能力
首先制备人工重组基底膜Transwell小室,将不含血清DMEM与Matrigel稀释按1∶3的比例稀释,混匀后取稀释液40 uL均匀涂抹于小室的上室表面,放置37℃恒温孵育箱过夜,次日紫外线灯下照射30 min。将空白对照组(加入DMSO)及不同浓度木犀草素(20 μmol/L, 40 μmol/L)培养的TPC-1细胞,消化后制备成密度为每毫升5×105的单细胞悬液。其余的步骤按照transwell小室检测细胞的迁移实验依次进行。平行实验重复3次。
1.2.5 Western blotting法检测蛋白的相对表达水平
LUT处理各组细胞48 h后,将蛋白裂解液与蛋白酶抑制剂按100∶1混匀后提取TPC-1细胞中总蛋白,BCA法定量蛋白,煮沸5 min变性,于-80℃保存备用,每个泳道按照蛋白量40 μg上样,12%SDS-PAGE电泳并进行转膜(90 V,90 min)。转膜后,脱脂奶粉封闭1 h,分别加入一抗(1∶1000),GAPDH(1∶2000)。4℃过夜后,0.1%TBST洗膜3次(每次10 min),加入二抗(1∶1000)后室温孵育1 h,洗膜3次后,用AI600(美国GE公司)成像,ECL荧光显色。采用Image J软件分析条带的灰度值。各组蛋白表达量=(蛋白灰度值/内参灰度值)×100%。
1.2.6 qRT-PCR检测mRNA的相对表达水平
按TRIpure 说明书提取各组细胞总RNA,逆转录后进行PCR扩增。MMP2的上下游基因分别为:5′-3′CCAGCTGGCCTAGTGATGATG和5′-3′CCGCATGGTCTCGATGGTAT。MMP9的上下游基因分别为:5′-3′CGCAGACATCGTCATCCAGT和5′-3′GGATTGGCCTTGGAAGATGA。内参GAPDH上下游引物序列分别是:5′-3′CCTGGAAGATGGTGA TGGGATT和5′-3′GGTGAAGGTCGGAGTCAACGG。PCR扩增的条件: 预变性95℃ 20 s,变性95℃ 5 s, 60℃ 30 s,延伸72℃ 40 s,共40个循环。以GAPDH为内参,各组的CT值均经过GAPDH校正后,采用2-ΔΔCT法分别计算MMP2、MMP9 mRNA相对表达量。每组设置3个复孔,平行重复实验3次。
1.3 统计方法

2 结果
2.1 不同浓度的LUT对细胞增殖活性的影响
用不同浓度的LUT分别处理细胞24 h、48 h、72 h后,MTT结果显示LUT的浓度越高,作用于细胞的时间越长,细胞的OD值越低(即细胞的增殖活性越低),木犀草素对TPC-1细胞的抑制作用呈现一定的时间—剂量的依赖性,与空白对照组相比,木犀草素在浓度为20 μmol/L和40 μmol/L时明显抑制TPC-1细胞的增殖活性,差异有显著性(P< 0.05)(如表1、图1)。
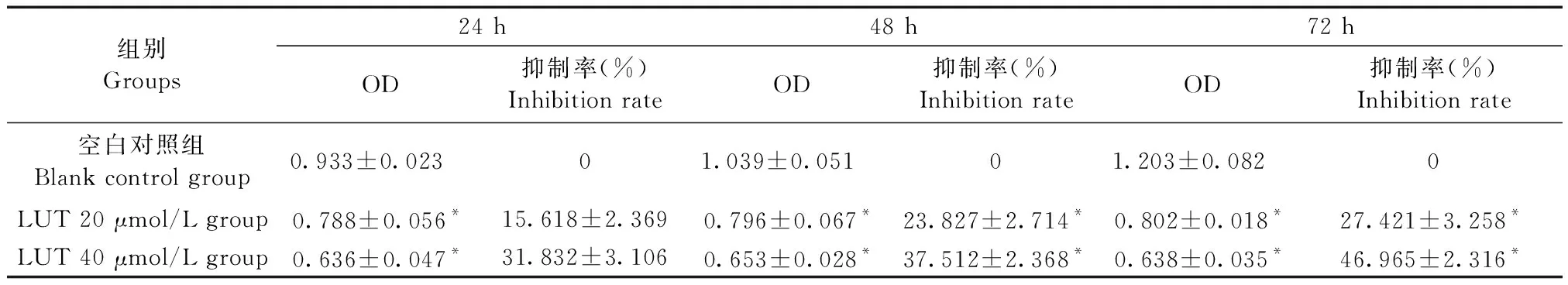
表1 不同时间段各组细胞的OD值Table 1 OD values of cells in the groups at various time points
注:与空白对照组相比,*P<0.05。
Note.Compared with blank control group,*P<0.05.

图1 不同浓度的木犀草素对TPC-1细胞的抑制作用(时间—抑制率)Figure 1 Inhibition of TPC-1 cells by various concentrations of luteolin (time-inhibition rate)
2.2 不同浓度的LUT对细胞侵袭、迁移能力的影响
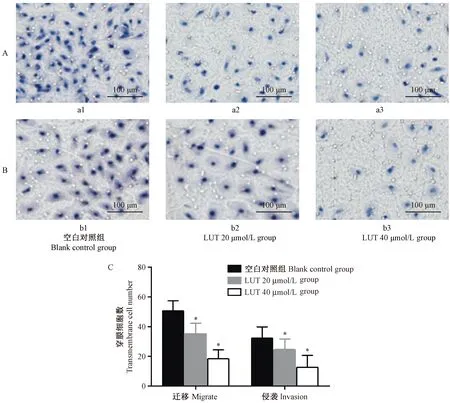
注:A:细胞迁移能力的变化(×100);B:细胞侵袭能力的变化(×100);a1和b1为空白对照组,a2和b2为LUT 20 μmol/L group,a3和b3为LUT 40 μmol/L group;C图是各组细胞穿透的细胞数;与空白对照组相比,*P<0.05。图2 transwell小室检测各组穿透的细胞数Note. A: Change of cell migration ability(×100); B: Changes of cell invasion ability(×100); a1 and b1 are blank control group, a2 and b2 are LUT 20 μmol/L group, a3 and b3 are LUT 40 μmol/L group; C: the number of cells penetrated of each group; compared with the blank control group, *P < 0.05.Figure 2 Transwell chamber to detect the number of cells penetrated of each group
细胞体外迁移实验结果示:与空白对照组穿膜的细胞数(50.66±6.73)相比,LUT 20 μmol/L(35.33±7.05)显著降低,P<0.05;LUT 40 μmol/L (18.35±6.02) 显著降低,P<0.05。此外细胞侵袭实验结果示:与空白对照组穿透细胞数(32.33±7.50)相比,LUT 20 μmol/L(24.66±7.02)显著降低,P<0.05;LUT 40 μmol/L(12.67±8.03)显著降低,P<0.05,LUT可以明显抑制TPC-1细胞迁移和侵袭能力。(图2)
2.3 LUT对各组细胞中AKT、P-AKT、MMP2、MMP9蛋白表达的影响
LUT作用于细胞48 h后提取细胞总的蛋白,各组中AKT蛋白的相对表达量无明显差异(P>0.05);但与空白对照组相比,LUT浓度为20 μmol/L和40 μmol/L细胞中P-AKT、MMP2、MMP9蛋白的相对表达量均明显降低(均P<0.05)(图3)。
2.4 LUT对各组细胞MMP2、MMP9 mRNA表达的影响
不同浓度的木犀草素干预各组细胞后,qRT-PCR结果显示(如图4),木犀草素浓度为20 μmol/L和40 μmol/L组的MMP2、MMP9 mRAN相对表达量均明显低于空白对照组,差异具有统计学意义(均P<0.05)。
3 讨论
木犀草素(3′,4′,5,7-四羟基黄酮)是许多类型
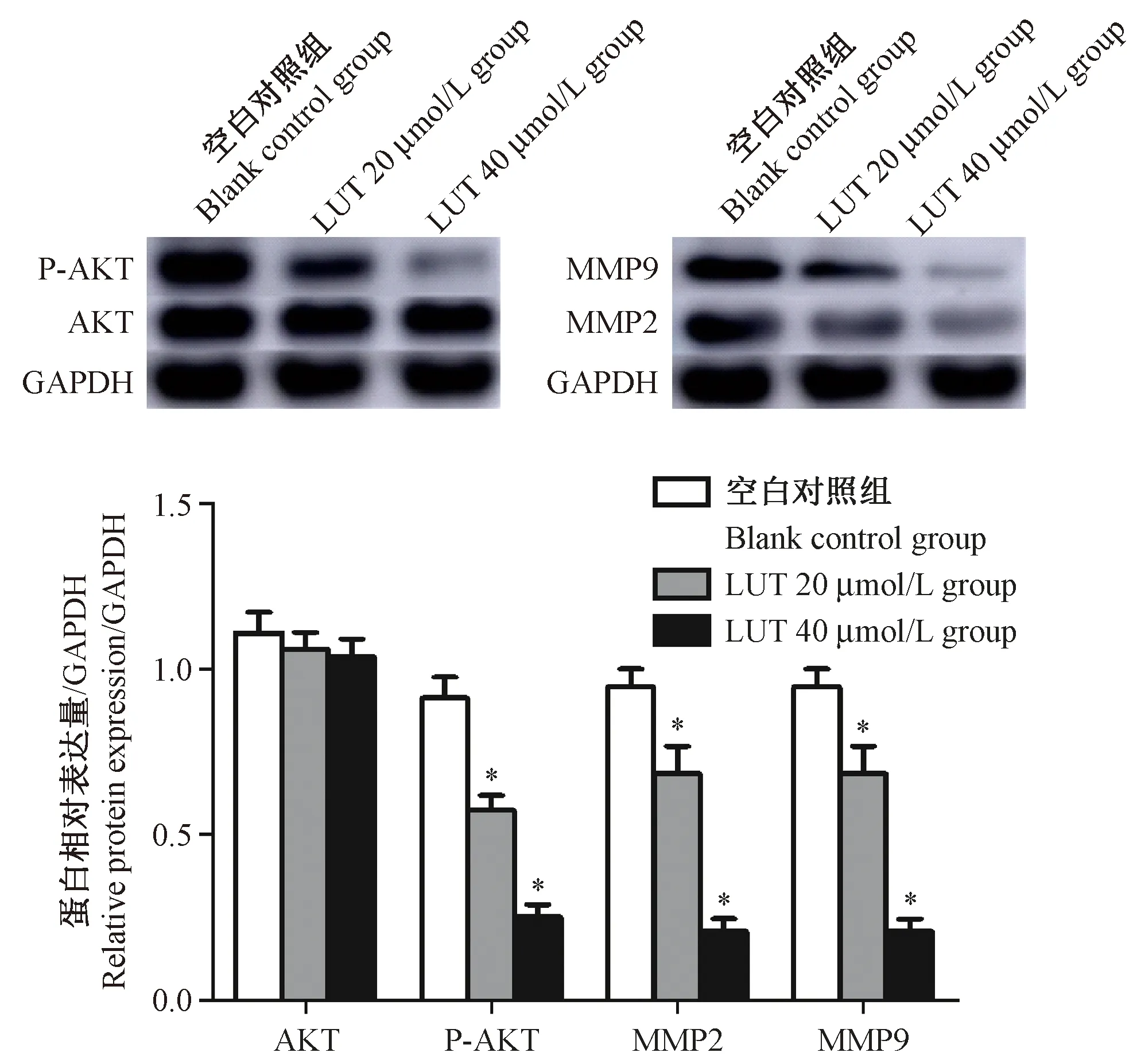
注:与空白对照组相比,*P<0.05。图3 LUT对各组细胞中AKT、p-AKT、 MMP2、MMP9蛋白水平的影响(n=3)Note. Compared with the blank control group, *P<0.05.Figure 3 Luteolin influences the protein expression of AKT, p-AKT, MMP-2, and MMP-9
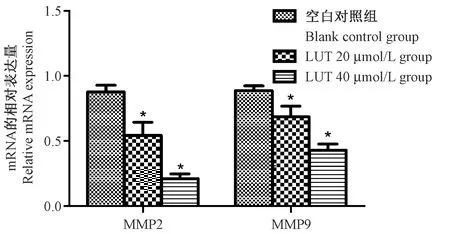
注:与空白对照组相比,*P<0.05。图4 LUT对各组细胞中MMP2、MMP9 mRAN水平的影响(n=3)Note. Compared with the blank control group, *P<0.05.Figure 4 Luteolin influences the mRNA expression of MMP-2 and MMP-9
植物中常见的类黄酮,以不同形式广泛地阻止肿瘤细胞的增殖和迁移,在胃癌、肝癌、宫颈癌等肿瘤中可通过阻滞细胞周期和诱导细胞凋亡等多种方式发挥着抑制肿瘤生长的作用,是一种有效的抗癌剂[11-14]。本研究通过MTT法观察LUT对TPC-1细胞增殖活性的影响,结果表明与空白对照组相比,木犀草素浓度为20 μmol/L和40 μmol/L时均可以有效地抑制TPC-1细胞的增殖活性(P<0.05),这与不同浓度的木犀草素抑制人胃癌细胞增殖活性作用的结果相一致[12]。
研究表明,侵袭及转移在PTC中的发病机制中占有重要的作用[15]。在肿瘤细胞中,基质金属蛋白酶(MMPs)分泌的MMP包括明胶酶A(MMP2)和明胶酶B(MMP9),通过降解细胞外基质屏障(ECM)不仅参与肿瘤细胞的侵袭转移,而且涉及血管生长、炎症、癌症的进展等[16]。研究发现,在PTC中基质金属蛋白酶2、9(MMP2、MMP9)呈现高表达,参与调控肿瘤细胞的浸润及侵袭转移[17-18]。研究证实在甲状腺乳头状癌中磷脂酰肌醇-3激酶PI3K/AKT信号通路可调节MMPs活性,从而参与肿瘤细胞侵袭和转移等作用[19-20]。
在胶质母细胞瘤中,LUT通过影响PI3K/AKT信号通路的活性达到抑制肿瘤细胞的侵袭迁移能力[21]。在乳腺癌中,木犀草素具有较强的抑制血管生成的作用,通过下调AEG-1和MMP-2的表达抑制乳腺癌细胞的侵袭活性[22]。在卵巢癌中,木犀草素可以有效地抑制卵巢癌细胞的侵袭迁移能力,其机制可能与MMP2和MMP9的表达水平的降低有关[23]。在前期研究表明不同浓度的木犀草素可以抑制TPC-1细胞的增殖活性,在此基础上本研究通过采用木犀草素与人甲状腺乳头状癌TPC-1细胞共培养,体外侵袭迁移实验结果显示与空白对照组相比,木犀草素在浓度为20 μmol/L和40 μmol/L时细胞的侵袭及迁移能力明显受到抑制,差异有显著性(P<0.05)。进一步探讨LUT对抑制人甲状腺乳头状癌TPC-1细胞侵袭迁移相关机制,Western blotting结果显示与空白对照组相比,木犀草素浓度为20 μmol/L和40 μmol/L组中的肿瘤相关蛋白MMP2、MMP9及PI3K/AKT信号通路相关蛋白P-AKT的表达水平明显降低,qRT-PCR结果进一步表明MMP2、MMP9的mRAN也明显减少,差异有显著性(均P<0.05)。该结果与不同浓度的木犀草素有效地抑制肝癌、乳腺癌、前列腺癌、胶质母细胞瘤等肿瘤细胞侵袭迁移能力的研究结果相一致[8, 21,24-25]。
总之,本研究表明LUT可以有效地抑制甲状腺乳头癌TPC-1细胞的侵袭迁移能力,这一作用可能与PI3K/AKT信号通路的活性改变有关,这为LUT在PTC的治疗中提供了一定的理论依据,有望作为一种新型抗甲状腺乳头状癌的药物在临床中应用。

