食道癌贲门癌患者血浆D-二聚体水平变化与生存期相关分析
徐 晖 聂春兰 陈婷婷 严 波
南京市溧水区人民医院肿瘤内科,南京 211200
我国食道癌、贲门癌发病率居世界首位,患者死亡率占全部恶性肿瘤的23.15%,仅次于胃癌[1]。外科手术联合术后放化疗是临床治疗食道癌、贲门癌的首选方式。恶性肿瘤生存期预测对于术后综合治疗方案的指定有特殊价值[2]。D-二聚体(D-D)是交联纤维蛋白经纤溶酶作用后的终末产物,可反映体内血浆凝血因子活化和纤维蛋白溶解系统功能,大量研究显示,恶性肿瘤存在凝血和纤维蛋白溶解系统异常,这往往伴随着D-D水平的变化[3],同时,亦有研究证实了D-D水平变化与非小细胞肺癌患者生存期的密切关联[4]。在过往研究结论的基础上,本研究选择食道癌、贲门癌病例,对患者血浆D-D水平变化与生存期的相关性进行分析。
1 资料与方法
1.1 一般资料
152例患者于我院完成手术等综合治疗。入院时间2014年1月至2017年1月。其中食道癌111例,贲门癌41例。
患者治疗前1~3 d空抽取腹静脉血5 mL,使用免疫比浊法对血浆D-D水平进行检测,试剂盒购自美国Instrumentation Laboratory Company公司,血浆D-D≥0.551 mg/L为阳性[5]。
1.2 分析方法
比较不同病理组织类型、病理分期患者血浆D-D水平,于患者出院后,采用电话随访、门诊复查等方式,对患者开展随访,记录其无进展生存期(自初治至复发或进展时间)及总生存期(自初治至死亡或随访截止日期),使用Kaplan-Meier法评估血浆D-D阳性、阴性患者无进展生存期及总生存期,使用Cox比例风险回归模型,计算血浆D-D水平变化对食道癌、贲门癌患者生存期的影响。
2 结果
2.1 不同病理特征食道癌、贲门癌患者血浆D-D水平比较
不同病理组织类型患者血浆D-D水平比较,差异无统计学意义(P>0.05),随着患者病理分期的上升,其血浆D-D水平逐渐升高,差异有统计学意义(P<0.05)。见表1。
2.2 随访结果
随访期间3例患者失访,其余149例患者均获得有效随访,随访时间8个月~3年,中位随访时间14个月。按照患者治疗前血浆D-D水平,将其分别纳入D-D阳性组、D-D阴性组。D-D阳性组无进展生存期、总生存期分别为(7.65±2.38)个月、(11.47±2.09)个月,低于D-D阴性组的(10.16±2.33)个月、(16.94±3.57)个月,差异有统计学意义(P<0.05)。见图1。
表1 不同病理特征食道癌、贲门癌患者血浆D-D水平比较(s)

表1 不同病理特征食道癌、贲门癌患者血浆D-D水平比较(s)
注:与0期比较,aP<0.05;与Ⅰ期比较,bP<0.05;与Ⅱ期比较,cP<0.05;与Ⅲ期比较,dP<0.05
?
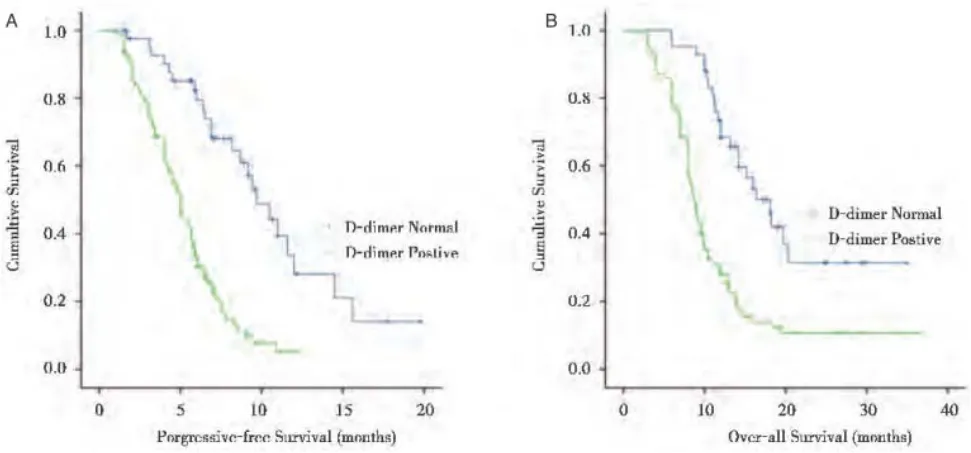
图1 D-D阳性组及阴性组无进展生存期(A)和总生存期(B)的Kaplan-Meier曲线
2.3 影响因素分析
Cox比例风险回归显示,血浆D-D阳性是影响食道癌、贲门癌患者无进展生存期(HR=3.17,95%CI 1.91~4.36)、总生存期(HR=4.91,95%CI 1.58~6.44)的独立危险因素(P<0.05)。
3 讨论
随着恶性肿瘤筛查的普及,越来越多的患者可在疾病早中期明确诊断,仍存在外科根治性手术的机会[6]。一味强调术后放化疗存在过度治疗风险,还可能因不良反应影响患者生活质量[7-8]。本研究选取了D-D做为观察患者生存期的指标,既往有研究显示,恶性肿瘤患者普遍存在高凝状态,其原因与肿瘤细胞较高的纤维蛋白活性有关,同时,肿瘤细胞也可分泌大量纤维蛋白原激活物,促进局部纤维蛋白溶解,从而造成体内高凝、纤溶亢进[9-10]。作为一种纤维蛋白经纤溶酶水解后的特异降解产物,D-D能够准确反映机体继发纤溶活性增强状态,故恶性肿瘤患者血浆D-D水平往往明显升高[11]。与此同时,随着患者病理分期的进展,其血浆D-D水平逐渐上升,其机制可能包括[12-13]:1)病理分级的上升伴随着各类促凝物质表达的增加;2)纤溶系统所需蛋白表达上述;3)炎性细胞因子大量分泌;4)血液内血小板大量激活所致高凝状态。
进一步进行生存分析及影响因素分析,可以发现,血浆D-D阳性者无进展生存期、总生存期更短,且血浆D-D的升高伴随着患者生存期的缩短,其原因一方面与肿瘤细胞释放的二磷酸腺苷(ADP)有关,ADP可引发血小板凝集,而肿瘤侵犯血管所致内皮细胞损伤、内皮下胶原裸露,也可造成细胞因子大量释放、Ⅻ因子激活,从而启动内外凝血过程,故血浆D-D水平的上升意味着肿瘤侵犯能力的增强[14-15]。另一方面,恶性肿瘤细胞的高水平纤维蛋白溶酶激酶特征可诱发局部纤维蛋白溶解,造成体内纤溶活性亢进,而血浆D-D水平能够通过反映体内纤溶活性间接显示恶性肿瘤细胞对凝血活性和继发纤溶状态的影响,故较高的血浆D-D浓度意味着体内更高的肿瘤负荷,患者预后及生存质量也相应下降[16]。文献报道,D-D与结肠癌、乳腺癌、卵巢癌、肺癌等恶性肿瘤的转移能力有关[17],因此,对于治疗前血浆D-D水平较高者而言,应高度重视肿瘤转移风险,合理开展放化疗等综合干预措施,并在治疗后定期监测其血浆D-D水平以了解恶性肿瘤增殖、转移能力的变化。此外,亦有学者指出,食管癌、贲门癌患者术后1周内血浆D-D水平呈上升态势,其原因与术后卧床、下肢活动减少所致血液高凝状态加剧有关,此时患者肺栓塞、下肢深静脉血栓等并发症发生风险也随之升高[18],因此,除考虑到肿瘤恶性程度增加所致血浆D-D水平上升外,也应综合患者凝血功能状态开展综合评估,以期为患者术后生存期的判断提供更为全面、准确的参考,使患者更多地自治疗中获益。
综上所述,食道癌、贲门癌患者血浆D-D水平升高,其升高水平与患者病理分级变化具有一致性,且血浆D-D水平能够为患者无进展生存期、总生存期的判断提供客观参考,应高度重视患者血浆D-D水平的动态监测。

