小儿急性淋巴细胞白血病大剂量甲氨蝶呤化疗血药浓度监测与不良反应观察
洪 杏 盛 超
1.徐州市儿童医院药剂科,江苏徐州 221006;2.徐州市中心医院康复科,江苏徐州 221009
急性淋巴细胞白血病(ALL)约占小儿白血病的75%以上,多数患儿对化疗药物敏感,多药联合化疗方案治愈率高[1-2]。但由于体内血脑屏障、血睾屏障等白血病细胞天然药物性庇护所的存在,患儿化疗后复发率仍处于较高水平,因此,临床多采用大剂量甲氨蝶呤(MTX)化疗联合四氢叶酸钙(CF)解救方案[3]。然而,MTX的细胞毒性可导致多种不良反应发生,而CF在解救正常细胞的同时也可影响MTX对肿瘤细胞的毒性作用[4]。因此,本文就ALL患儿大剂量MTX化疗期间血药浓度变化及其与不良反应的关系进行了前瞻性分析,为临床实践中CF解救时机的选择提供参考。
1 资料与方法
1.1 一般资料
226例ALL患儿均经形态学、免疫学、细胞遗传学检查明确ALL诊断与分型[5],免疫分型:B系ALL 144例,T系ALL 82例。于2011年2月—2018年2月就诊经诱导缓解、巩固治疗各1疗程后达完全缓解,拟于我院接受大剂量MTX治疗;排除血、尿常规或肝、肾功能异常者以及存在感染证据者。
1.2 治疗方案
患儿均于诱导、巩固治疗达到完全缓解后休息1~3周,视血常规恢复情况,明确中性粒细胞计数>1.5×109/L、白细胞计数>3×109/L、肝肾功能未见异常且未见感染证据,给予大剂量MTX治疗[6]。大剂量MTX治疗总量为每次3 g/m2,其总量的1/6作为突击量,于30 min内匀速静脉滴注,余量于23.5 h内滴注完毕。开辟另一静脉通道,给予3~5 mL/kg 5%碳酸氢钠匀速静脉滴注,滴注时间自MTX给药当日至MTX血清浓度≤0.25 μmol/L;MTX给药当日开始充分水化治疗,每日输注液体量2000~3000 mL/m2,持续4 d。MTX给药后12 h给予CF解救,首次剂量为30 mg/m2,后续剂量为15 mg/m2,每隔6 h肌肉注射1次,CF解救治疗持续9次,解救治疗期间根据患儿MTX血药浓度变化调整解救方案[7]:若MTX血药浓度过高(72 h>0.1 μmol/L或68 h>1 μmol/L或44 h>10 μmol/L)则追加CF,当MTX血药浓度≤0.25 μmol/L时,停止解救治疗。
1.3 分析方法
分别于MTX给药后30 min、12 h、24 h、44 h、72 h,采集患儿静脉血2 mL,使用TDx快速血药浓度测定仪(美国Abbott公司)检测其MTX血药浓度变化。用药期间定期监测其血尿常规、肝肾功能变化,结合胸片、心电图等检查,观察患儿不良反应发生情况。此外,根据MTX 48 h血药浓度(c48 h)分级方法,比较MTX给药后48 h不同血药浓度分级患儿不良反应发生情况,分析c48 h与不良反应的相关性;c48 h分级标准[8]:一级:c48 h≤0.1 μmol/L;二级:0.1 μmol/L<c48 h≤0.15 μmol/L;三级:0.15 μmol/L<c48 h≤0.25 μmol/L;四级:0.25 μmol/L<c48 h≤0.5 μmol/L;五级:0.5 μmol/L<c48 h≤2.0 μmol/L;六级:c48 h>2.0 μmol/L。
2 结果
2.1 MTX血药浓度变化
在所有血药浓度监测时间点内,MTX给药后0.5 h时血药浓度最高,12 ~24 h MTX消除速率最高,此后持续下降,患儿MTX给药后72 h血药浓度即降至(0.05±0.01)μmol/L。见表1。
表1 226例ALL患儿MTX给药后不同时间血药浓度变化分析(μmol/L,)
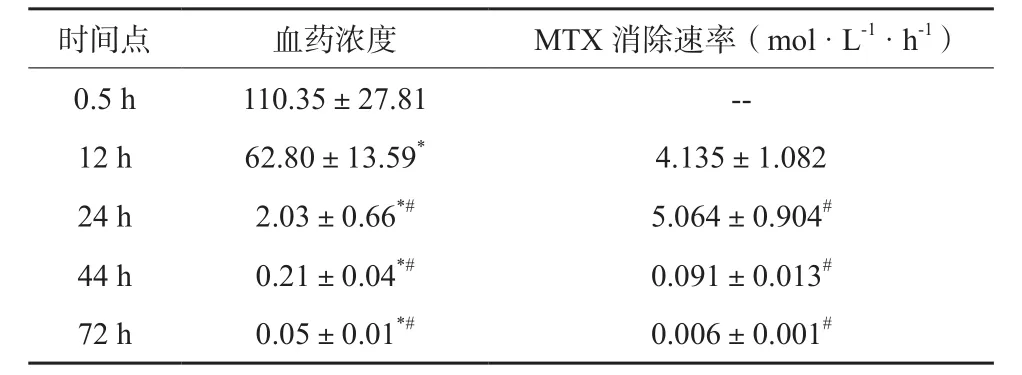
表1 226例ALL患儿MTX给药后不同时间血药浓度变化分析(μmol/L,)
注:与MTX给药后0.5 h比较,*P<0.05;与MTX给药后12 h比较,#P<0.05
?
2.2 不良反应发生情况
226例患儿共发生不良反应174例次,其中肝功能异常、消化道反应发生率最高,分别为30.09%、21.68%%,其次为粘膜损害13.72%、骨髓抑制8.85%、肾功能异常2.65%。不同甲氨蝶呤血药浓度分级患儿不良反应发生情况比较,c48 h分级一级者不良反应发生率最低,五~六级者不良反应发生率最高,数据见表2。Spearman相关性分析示,c48 h分级与不良反应发生率呈正相关(r=0.617,P<0.05)。
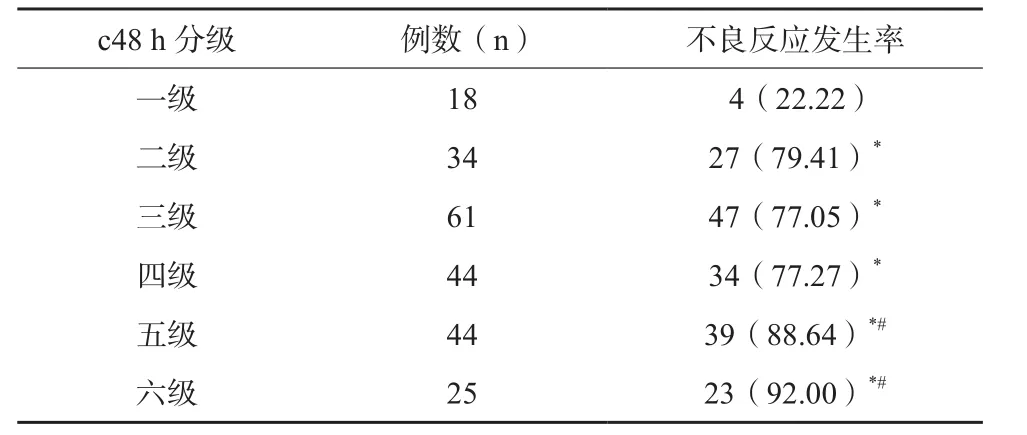
表2 不同c48 h分级患儿不良反应发生情况分析(n/%)
3 讨论
小儿ALL的治疗能否成功,与髓外白血病的庇护性治疗密切相关[9]。大剂量MTX持续静脉滴注联合CF解救是当前临床髓外白血病的首选防治方案,MTX可在叶酰聚谷氨酸合成酶的作用下,形成聚谷氨酸-甲氨蝶呤(MTXPG),MTX及MTXPG均可通过竞争性抑制二氢叶酸还原酶活力,达到影响核酸和蛋白质合成的目的,从而抑制肿瘤细胞增殖[10]。然而,MTX抑制细胞增殖的药理学作用并不具有特异性,也可影响体内更新较快的细胞,故患儿有着较高的不良反应发生风险[11]。外源性CF可通过MTX阻断部位,诱导核酸和蛋白质合成的恢复,但其在解救正常细胞的同时,也可造成MTX对肿瘤细胞的毒性作用减弱,因此,如何选择合理的CF解救时机、解救频次,以达到治疗效果与安全性的平衡,一直是困扰临床工作者的重大难题[12]。
此次研究基于过往标准,将MTX血药浓度≤0.25 μmol/L作为CF解救治疗的停止时机[13],结果显示,226例ALL患儿仍发生不良反应174例次,且肝功能异常、消化道反应发生率分别达到30.09%、21.68%,说明传统停止CF解救治疗标准仍存在优化空间。为探寻更为理想的CF解救时机选择标准,本研究首先就ALL患儿大剂量MTX治疗后血药浓度变化进行了监测,结果显示,MTX清除速率与MTX血药浓度的变化并未呈现一致性,MTX消除具有三相性,第一相为药物分布,第二相为肾清除,第三相与药理性第三空间清除有关,给药12 ~48 h时,MTX缓慢进入胸水、腹水等浆膜腔积液,而胸、腹水中药物和血药浓度到达平衡的时间较慢,可能是造成此时MTX清除率有所下降的主要原因[14-15]。此外,80%以上的MTX经药物排泄,患者液体入量不足可导致尿量过少、MTX肾清除率下降[16],因此,可适当加强水化、碱化,以期在不增加CF解救频次的基础上降低不良反应发生风险。
通过不同c48 h分级患儿不良反应发生率的比较,可以发现,MTX 48 h血药浓度降至0.1 μmol/L及以下时,患儿不良反应发生率较低,与过往报道具有一致性[17],而给药后48 h MTX血药浓度仍超过0.5 μmol/L者,其不良反应发生率高达89.86%(62/69)。因此,MTX 48 h血药浓度越低,患儿不良反应发生风险则越低,可考虑将MTX 48 h血药浓度≤0.1 μmol/L作为CF停止解救的参考时机。研究发现,不同年龄、身高患儿在相同MTX血药浓度时不良反应发生率存在差异[18],除根据患儿MTX血药浓度决定CF解救方案外,亦应全面评估其年龄、身高等其他因素,从而为临床实践提供更为精准、可靠的指导。
鉴于MTX 48 h血药浓度与不良反应发生率的高度相关性,重视MTX血药浓度监测并以MTX血药浓度≤0.1 μmol/L作为CF解救治疗的停止时机,有望达到治疗效果与化疗安全性的平衡。

