PM 2.5对过敏性哮喘小鼠气道炎症反应及内质网应激的影响
张 雷, 冉 琴, 王 星, 李国平
哮喘是一种以可逆性气道阻塞和气道高反应(airway hyperresponsivenes,AHR)为特点的慢性炎症性疾病。全球有3.34亿人深受其害,哮喘患病率每年以1%的速度增加[1],在儿童和青少年中尤为显著。空气动力直径<2.5 μm的颗粒物,也称为人肺可吸入颗粒物,对呼吸系统的危害极其严重,是造成烟雾污染并引起呼吸道疾病的主要污染物[2-3]。调查显示,北京的最高日平均PM 2.5浓度是500 μg/m3,高于世界卫生组织建议值的20倍[4]。PM 2.5的化学组成因地区及污染源的不同而差异较大,目前所知的主要组分包括:微生物成分如脂多糖(lipopolysaccharide,LPS)、有机碳多环芳烃、微量元素、金属离子、无机盐等[5]。由于PM 2.5粒径小、在空气中滞留时间长,易避开气管细胞纤毛等过滤机制进入下呼吸道,故在哮喘病的发生和发展中起到重要作用。Zhou等研究发现,PM 2.5的暴露能诱导人气道上皮细胞(human bronchial epithelial cells,HBE)发生氧化应激、DNA链断裂及凋亡[6]。Zhang等研究发现,PM 2.5通过诱导激活内质网应激(endoplasmic reticulum stress,ERS)和自噬,对斑马鱼的发育有严重毒害作用[7]。So等在哮喘模型中发现激活核因子(nuclear factor,NF)-κB信号通路能诱导ERS的发生,导致展开和(或)错误折叠蛋白质在ER的累积,干扰蛋白质合成和分泌,诱导活性氧生成,并增加炎症的发生[8]。ERS与哮喘炎症反应、氧化应激、黏液高分泌都有密切关系[9]。现有的研究显示,PM 2.5能够诱导ERS,促进炎症反应,对支气管上皮细胞造成损害。本研究拟采用OVA建立小鼠过敏性哮喘模型,模拟人类吸入PM 2.5的方式,探讨空气污染颗粒PM 2.5对哮喘小鼠ERS、炎症及AH的影响。
1 材料与方法
1.1材料
1.1.1动物 SPF级6~8周龄雌性C57BL/6J小鼠24只,体质量(20±2) g[重庆腾鑫科技公司,许可证号:SCXK(渝)2017-0001]。分笼饲养于恒温(23 ℃)恒湿(相对湿度50%~70%)的清洁级西南医科大学实验动物房中,12 h光照循环。
1.1.2试剂 卵清蛋白(ovalbumin,OVA,批号:326A0519,北京索莱宝科技有限公司);氢氧化铝[Al(OH)3,批号:20120901,成都科龙化学品有限公司];乙酰甲胆碱(methacholine,Mch,批号:108K1232,美国Sigma-Aldrich公司);RNA simple Total RNA Kit总RNA提取试剂盒、RT SuperMix试剂盒和SYBR Green Realtime PCR Master Mix试剂盒均购自北京天根生化科技有限公司;IL-17和TNF-α引物由上海捷瑞生物工程有限公司合成;Mouse IL-17 Elisa 试剂盒(HTLV171101,北京安迪华泰科技有限公司);BCA蛋白浓度测定试剂盒(P0010,上海碧云天生物技术有限公司);β-actin鼠单克隆抗体(sc-130656,美国Santa Cruz公司);GRP78鼠多克隆抗体(批号:ab21685,美国Abcam公司);CHOP鼠多克隆抗体(批号:ab11419,美国Abcam公司);IRE1兔多克隆抗体(批号:ab37073,美国Abcam公司);磷酸化IRE1兔多克隆抗体(批号:ab48187,美国Abcam公司)。
1.1.3仪器 实时荧光定量PCR仪(LightCycler480 Ⅱ,瑞士Roche公司);无创肺功能检测系统(MaxⅠ 1420,美国 Buxco公司);凝胶成像系统(美国BIO-RAD公司),电泳仪电转移装置(PS600,美国Hoefer公司);光学显微镜(DM4000B,美国Leica);全波长酶标仪(MD Spetramax Plus384,美国Molecular Devices公司)。
1.2方法
1.2.1PM 2.5的收集和制备 2017年8-12月于人口密集、附近无工业污染的北京市区采集大气PM 2.5样品,粒径≤2.5 μm,样品收集于石英纤维滤膜上,采样前和采样后恒温干燥24 h。将载有样品的滤膜剪成3 cm×4 cm大小,浸泡于MilliQ水中,超声震荡洗脱3次,每次30 min。以6层医用纱布对洗脱液进行过滤2次,滤液经真空冷冻干燥后收集于密闭玻璃容器中-80 ℃冻存。使用前用PBS配成10 mg/mL浓度颗粒物悬液,临用前超声振荡处理10 min,125 ℃高温灭菌。
1.2.2哮喘小鼠模型的建立及处理 将24只小鼠按随机数字表法分为阴性对照组(PBS组)、哮喘对照组(OVA组)、PM 2.5处理组(PM 2.5组)及哮喘小鼠吸入PM 2.5处理组(OVA+PM 2.5组),每组6只。第0,7及14天,OVA组和OVA+PM 2.5组于腹腔注射0.2 mL致敏液[含25 μg OVA、1 mg Al(OH)3溶于0.2 mL PBS]致敏,PBS组和PM 2.5组腹腔注射PBS作为对照;第15~21天,OVA组和OVA+PM 2.5组小鼠用20 mg/kg戊巴比妥钠浅麻醉后,予1 μg/μL OVA溶液50 μL滴鼻激发,OVA+PM 2.5组激发前经鼻滴入100 μg/mL浓度的PM 2.5混悬液30 μL,PM 2.5组滴入等量PM 2.5混悬液,PBS组滴PBS作为对照,每日1次。末次激发待小鼠苏醒后,各组小鼠检测AHR。24 h后经腹腔注射 50 mg/kg戊巴比妥钠麻醉,右肺上叶用10%甲醛溶液固定后做病理切片。余肺迅速过液氮后保存于-70 ℃冰箱备用。
1.2.3小鼠无创肺功能检测 用Mch依次按0,6.25,12.5,25,50 mg/mL浓度雾化,经过小鼠无创肺功能系统,雾化时间1 min,反应时间3 min,对小鼠进行AHR测定。取每个浓度下反应时间增强呼气间歇(enchanced pause, Penh)均值作为评价AHR的指标。Penh与经典肺功能检测具有高度相关性[10],Penh=PEF/PIF(PEF为呼气流速峰值,PIF为吸气流速峰值)。Penh被证明与Mch刺激下的小鼠肺阻力和非动态顺应性相关,可有效检测哮喘小鼠AHR[11]。
1.2.4肺组织苏木精-伊红(H-E)和过碘酸雪夫(periodic acid-schiff,PAS)染色 10%甲醛溶液浸泡固定组织24 h后,经酒精脱水,石蜡包埋,常规H-E染色和PAS染色。200倍光学显微镜下观察肺气道、肺泡壁厚度和炎细胞浸润等病理变化及杯状细胞分布和黏液分泌情况,并计数杯状细胞占气道上皮细胞的百分比和肺组织炎症评分,炎症评分标准:0分表示气道及血管周围无炎细胞;1分表示气道和血管周围一层炎细胞;2分表示气道和血管周围2层炎细胞,4分表示气道和血管周围4层炎细胞;5分表示气道和血管周围5层及以上炎细胞。
1.2.5肺泡灌洗及细胞分类计数 小鼠麻醉后,颈部分离出气管,暴露胸腔,结扎左肺,用1 mL的注射器抽取0.5 mL冷PBS经气管缓慢注入左肺,反复抽吸3次后回收BAL(回收率>80%)。将BALF 离心(4 ℃,1 500 r/min,8 min),弃上清液,重悬沉淀进行细胞计数,H-E染色后镜下计数BALF中性粒细胞密度和嗜酸性粒细胞(eosinophils,EOS)。
1.2.6ELISA法检测BALF中IL-17的含量 留取BALF,参照试剂盒说明书检测和计算BALF中IL-17的含量。
1.2.7总RNA提取与mRNA检测 荧光定量聚合酶联反应检测肺组织IL-17和TNF-α的mRNA表达。液氮中研磨肺组织,用RNA simple Total RNA Kit总RNA提取试剂盒提取总RNA,RTSuperMix试剂盒进行RNA逆转录,合成cDNA。根据目的基因及扩增条件进行扩增(表1):
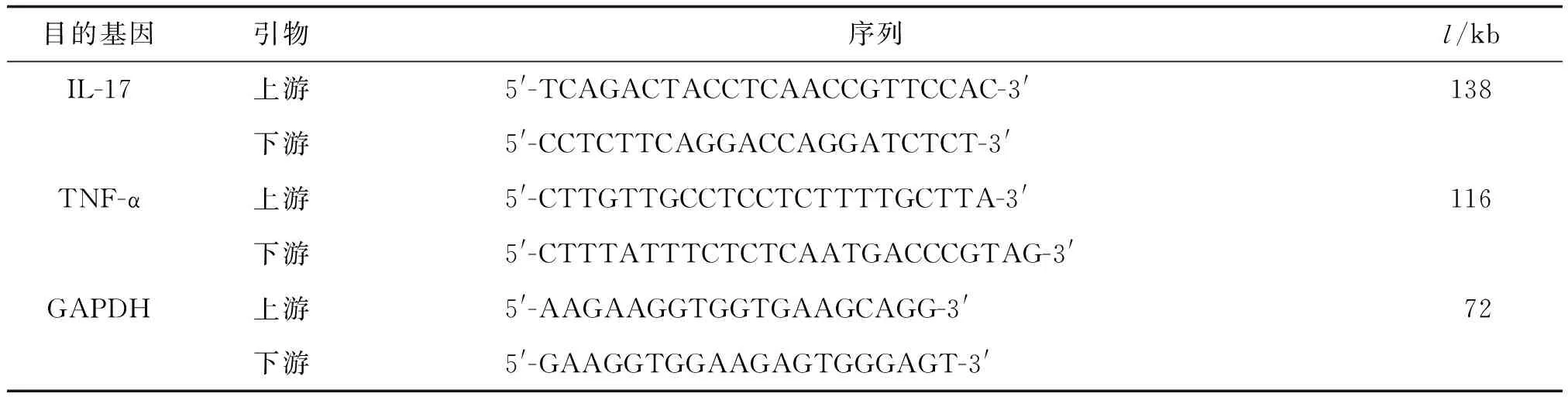
表1 引物序列
以GAPDH为管家基因,参照SYBR Green Realtime PCR Master Mix试剂盒说明进行PCR扩增。PCR反应体系共20 μL,反应条件:95 ℃预变性5 min→95 ℃变性10 s→57 ℃退火30 s→扩增45个循环→72 ℃延伸10 min。收集SYBR Green荧光信号,获取各组Ct值:
ΔCt=Ct目的基因- Ct管家基因
ΔΔCt=ΔCt实验组-ΔCt对照组
采用2-ΔΔCt法计算各目的基因mRNA相对表达量。
1.2.8Western-blot检测蛋白表达量 液氮中充分研磨肺组织,加入裂解液,混匀,冰上裂解30 min,4 ℃离心15 min,12 000 r/min。取上清,BCA法蛋白质定量,每孔30 μg蛋白样品进行聚丙烯酰胺凝胶电泳并转印至PVDF膜,经封闭,加入抗体GRP78,CHOP,IRE,p-IRE,β-αctin和GAPDH(1∶2 000),4 ℃孵育过夜,TBST洗膜,二抗室温孵育2 h,TBST洗膜,显影。Bio-Rad系统测定蛋白条带灰度。

2 结 果
2.1H-E染色和PAS染色观察 OVA组支气管壁及周围见中等数量的炎性细胞浸润,管壁轻微增厚,管腔内可见炎性细胞渗出,可见杯状细胞增生及糖原分泌;PM 2.5+OVA组支气管壁及周围炎性细胞浸润较OVA组明显增多,管腔内有大量炎性细胞渗出,管壁重度增厚(图1A),大量纤维化及杯状细胞增生(图2A)。PBS组和PM 2.5组见极少量炎症细胞浸润,支气管壁未见增厚,偶见少量杯状细胞。与OVA组比较,OVA+PM 2.5组肺组织炎症评分升高(P<0.001,图1B),杯状细胞占气道上皮细胞百分比显著增加(P<0.05,图2B)。
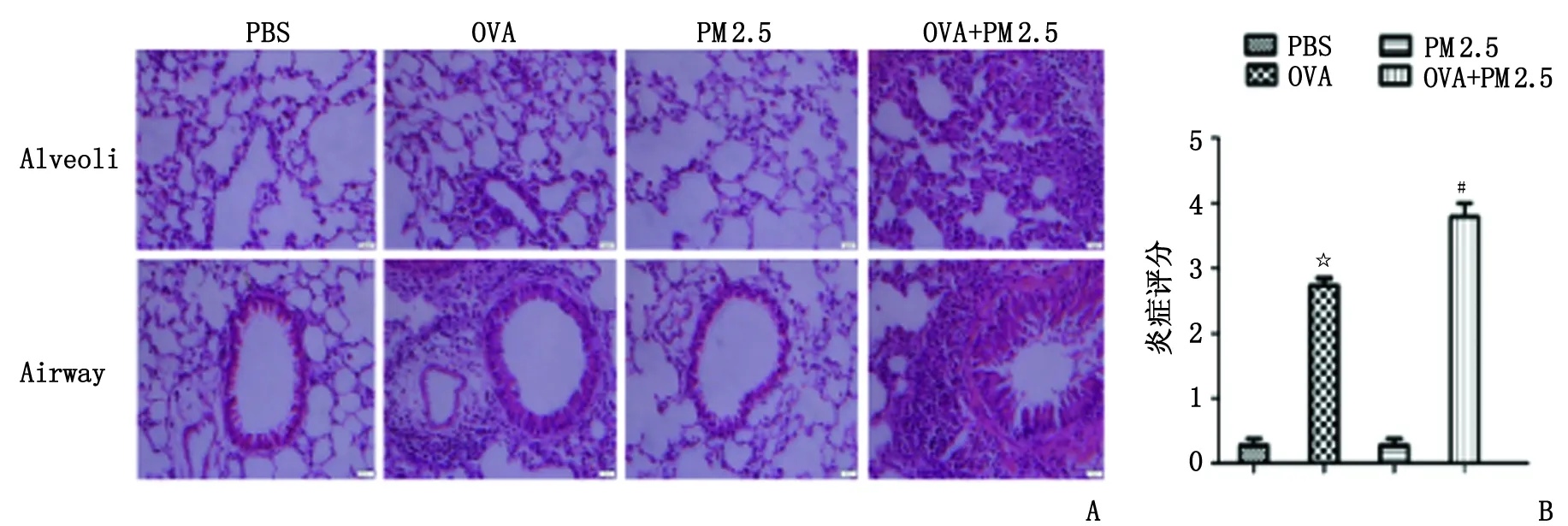
A:肺组织苏木精-伊红染色, B:肺组织炎症评分柱状图. PBS:磷酸盐缓冲液; OVA:卵清蛋白; PM 2.5:空气污染细颗粒物. PBS组:阴性对照组;OVA组:哮喘对照组;PM 2.5组:单纯吸入PM 2.5对照组;OVA+PM 2.5组:哮喘小鼠吸入PM 2.5处理组. 与PBS组比较,☆:P<0.001;与OVA组比较,#:P<0.001.图1 小鼠肺组织H-E染色观察及炎症评分( ×200)Fig 1 H-E staining observation and inflammatory score of lung tissue in mice( ×200)
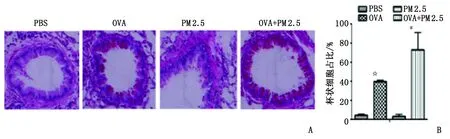
A:气道过碘酸雪夫染色; B:杯状细胞占气道上皮细胞百分比柱状图. PBS:磷酸盐缓冲液; OVA:卵清蛋白; PM 2.5:空气污染细颗粒物. PBS组:阴性对照组; OVA组:哮喘模型组; PM 2.5组:单纯吸入PM 2.5组; OVA+PM 2.5组:哮喘小鼠吸入PM 2.5处理组. 与PBS组比较,☆:P<0.05;与OVA组比较,#:P<0.05.图2 小鼠气道PAS染色观察及杯状细胞百分比( ×200)Fig 2 PAS staining observation and Globlet cells of the mice airway( ×200)
2.2小鼠肺功能的Penh值 OVA组和OVA+PM 2.5组的Penh值在Mch=12.5 mg/mL时逐渐升高,与PBS组和PM 2.5组差距逐渐增大(图3A)。在Mch=50 mg/mL浓度下,OVA组的Penh值较PBS组显著增高(P<0.05);OVA+PM 2.5组的Penh值较OVA组和PM 2.5组增高,差别具有统计学意义(P<0.05)(图3B);PBS组与PM 2.5组间差别无统计学意义(P>0.05)。
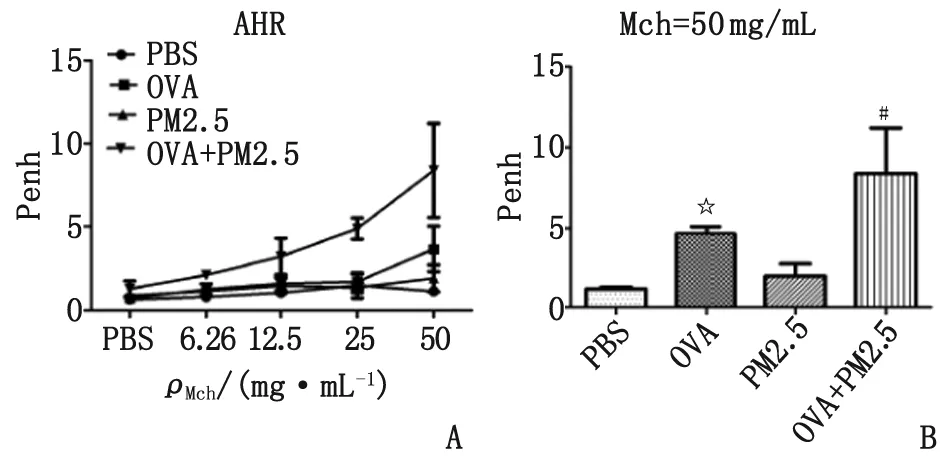
A:各组气道高反应趋势图; B:Mch=50 mg/mL时AHR柱状图. Penh:增强呼气间歇值; AHR:气道高反应; Mch:乙酰甲胆碱; PBS:磷酸盐缓冲液; OVA:卵清蛋白; PM 2.5:空气污染细颗粒物. PBS组:阴性对照组; OVA组:哮喘模型组; PM 2.5组:单纯吸入PM 2.5组; OVA+PM 2.5组:哮喘小鼠吸入PM 2.5处理组. 与PBS组比较,☆:P<0.05;与OVA组比较,#:P<0.05.图3 吸入PM 2.5对哮喘小鼠肺功能Penh值的影响Fig 3 Effects of inhalation PM 2.5 on lung function Penh value in asthmatic mice
2.3BALF中炎性细胞计数及分类 与PBS组比较,OVA组EOS显著升高(P<0.05)。OVA+PM 2.5组与OVA组比较,EOS升高,中性粒细胞升高(P<0.05,表2);PBS组与PM 2.5组比较,细胞总数、EOS、中性粒细胞差别无统计学意义(P>0.05)。
2.4细胞因子IL-17和TNF-α mRNA表达 实时荧光定量PCR结果显示,OVA+PM 2.5组的IL-17 mRNA表达量较OVA组升高明显(P<0.05),较PM 2.5组增高(P<0.05);OVA+PM 2.5组TNF-α的mRNA表达量较PM 2.5组升高(P<0.05,表3),OVA组与PM 2.5组差别无统计学意义(P>0.05)。
表2各组小鼠肺泡灌洗液中细胞分类计数比较
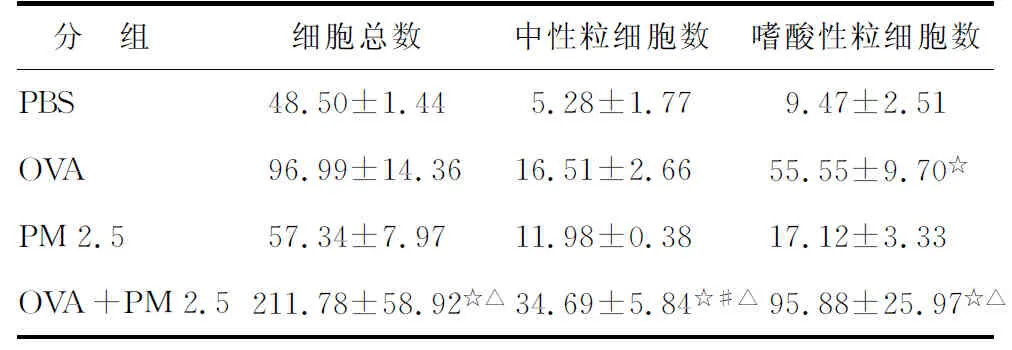
Tab 2 Comparison of the cell classification count in the alveolar lavage of mice ×104
PBS:磷酸盐缓冲液; OVA:卵清蛋白; PM 2.5:空气污染细颗粒物. PBS组:阴性对照组; OVA组:哮喘模型组; PM 2.5组:单纯吸入PM 2.5组; OVA+PM 2.5组:哮喘小鼠吸入PM 2.5处理组. 与PBS组比较,☆:P<0.05; 与OVA组比较,#:P<0.05; 与PM 2.5组比较,△:P<0.05.
表3各组小鼠细胞因子IL-17和TNF-α mRNA表达
Tab3Expression of cytokines IL-17 and TNF-α mRNA in each group of mice

分 组IL-17TNF-αPBS11OVA3.09±0.914.40±0.98PM 2.52.00±1.112.66±0.65OVA+PM 2.57.59±1.29# △9.29±2.16△
IL-17:白细胞介素-17; TNF-α:肿瘤坏死因子-α; PBS:磷酸盐缓冲液; OVA:卵清蛋白; PM 2.5:空气污染细颗粒物. PBS组:阴性对照组; OVA组:哮喘模型组; PM 2.5组:单纯吸入PM 2.5组; OVA+PM 2.5组:哮喘小鼠吸入PM 2.5处理组. 与OVA组比较,#:P<0.05;与PM 2.5组比较,△:P<0.05.
2.5肺泡灌洗上清液中IL-17的含量 PBS,OVA,PM 2.5及OVA+PM 2.5组的IL-17分别为(2.76±0.02),(4.31±0.38),(2.80±0.15)及(6.03±0.31) pg/mL。OVA组与PBS组比较,BALF中细胞因子IL-17含量升高(P<0.05);OVA+PM 2.5组与OVA组比较,IL-17含量升高,差别有统计学意义(P<0.05)。
2.6内质网应激相关蛋白GRP78,p-IRE和CHOP的蛋白表达量 在哮喘模型小鼠中,ERS相关蛋白CHOP,GRP78和p-IRE表达量均增加。与OVA组比较,OVA+PM 2.5组的CHOP,GRP78和p-IRE表达量均显著增加(P<0.05)。与PBS组比较,OVA组的CHOP增高,差别具有统计学意义(P<0.05)。

A:内质网应激相关蛋白电泳条带; B:CHOP与β-actin、BIP与β-actin及p-IRE1与IRE1比值柱状图. CHOP:CCAAT/增强子结合蛋白同源蛋白; GRP78:葡萄糖调节蛋白; IRE1:肌醇必需酶1; p-IRE1:磷酸化肌醇必需酶1; β-actin:β-肌动蛋白; GAPDH:甘油醛-3-磷酸脱氢酶; PBS:磷酸盐缓冲液; OVA:卵清蛋白; PM 2.5:空气污染细颗粒物. PBS组:阴性对照组; OVA组:哮喘模型组; PM 2.5组:单纯吸入PM 2.5组; OVA+PM 2.5组:哮喘小鼠吸入PM 2.5处理组. 与PBS组比较,☆:P<0.05; 与OVA组比较,#:P<0.05.图4 Western-blot分析吸入PM 2.5对哮喘小鼠内质网应激相关蛋白CHOP,GRP78和p-IRE1表达的影响Fig 4 Western-blot analyzed the effects of inhaled PM 2.5 on the expression of endoplasmic reticulum stress related protein CHOP, GRP78and p-IRE1 in mice with asthma
3 讨 论
支气管哮喘是由多种细胞(如EOS、肥大细胞、T淋巴细胞、中性粒细胞、平滑肌细胞、气道上皮细胞等)和细胞组分参与的一种以AHR和气道慢性炎症为特征的变态反应性疾病。本研究病理结果显示,哮喘小鼠出现小支气管黏膜上皮内杯状细胞明显增生,黏膜的基底膜增厚,支气管黏膜水肿,管壁周围组织及肺间质有炎性细胞浸润,大量炎性细胞浸润冲断黏膜肌层,杯状细胞明显增生等改变。吸入PM 2.5能够加重OVA诱导的哮喘小鼠气道损害,说明PM 2.5会加重气道炎症和破坏气道结构,增加黏液分泌。多种免疫细胞和细胞因子参与哮喘发病机制,其中CD4+T淋巴细胞介导的免疫调节失衡在哮喘的气道炎症中发挥重要的作用[12]。当CD4+T细胞被抗原激活后,通过多种途径分化成具有不同生物学功能的细胞亚群,包括辅助性T2细胞(helperT cell 2,Th2)和产生IL-17的Th 17细胞[13]。研究发现,哮喘患者的外周血Th1/Th2、Th17/调节性T淋巴细胞(Treg)比例失衡,且中重度哮喘患者的Th17细胞应答增强[14]。Rhonda等在大鼠模型中研究发现,单独IL-17免疫应答或单独Th2免疫应答均不能引起大鼠的AHR,但在Th2和Th17免疫反应共同作用下,大鼠出现了气道EOS、中性粒细胞浸润,并发生AHR[15]。本研究结果显示,吸入PM 2.5的重症哮喘小鼠IL-17表达量明显增高,AHR增强。笔者推断,PM 2.5加重哮喘气道炎症,诱导炎性细胞浸润,加重AHR,可能与IL-17相关的Th17免疫状态有关。
内质网是一种动态细胞器,确保细胞内稳态能在蛋白质翻译或折叠及炎症和细胞凋亡过程中建立。氧化应激、病原体感染和过敏原暴露等刺激能引起ERS,并激活UPR诱导不同的炎症反应和先天免疫功能失衡,导致哮喘状况的恶化[16]。Lee等研究发现,HDM能诱导气道上皮细胞发生ERS/UPR,ER分子伴侣BIP,GRP94和ERP57表达量升高[17]。PM 2.5也可激活ERS,从而损害斑马鱼的生育功能[7]。本研究结果显示,吸入PM 2.5的哮喘小鼠炎症更加严重,肺组织中ERS标志蛋白GRP78和CHOP表达显著增加,在ERS/UPR信号通路中磷酸化IRE1显著增多,黏液分泌增加,气道反应性升高。Kim等在LPS+OVA联合致敏小鼠哮喘模型中,发现肺组织中大量炎症细胞浸润,BALF中IFN-γ,IL-4,IL-5,IL-13和IL-17等炎症因子增多,肺组织中ERS/UPR标志物:BIP,CHOP,ATF6α,XBP1等表达量增加。炎症细胞因子诱导ERS,进而又促进炎症的发生[8]。Castaeda研究发现,细颗粒物PM 2.5通过诱导哮喘小鼠氧化应激,增强肺组织的过敏性炎症反应[18]。从以上研究笔者推断,PM 2.5能激活ERS,加重哮喘发作时炎症反应,其机制可能是PM 2.5进入肺组织后加重炎症细胞浸润,炎症因子分泌增加,诱导IRE磷酸化,激活ERS,进而又促进炎症反应。
空气污染颗粒PM 2.5可引起哮喘状态下气道上皮强烈的炎症反应,而炎症过程中产生的细胞因子是引起内质网中蛋白折叠错误和ERS诱发凋亡的原因之一。因此笔者推测,PM 2.5可能通过炎症因子引起气道上皮细胞发生ERS,促进气道黏液分泌,加重AHR,从而在哮喘急性发作中发挥重要作用。ERS在吸入PM 2.5加重哮喘的作用及其分子机制尚需进一步研究,其结果将为寻找以ERS为靶点的预防哮喘急性发作治疗措施提供理论和实验依据。

