国产牛磺酸滴眼液中抑菌剂使用状况分析
肖 璜,戴 ,杨美琴,马仕洪
(中国食品药品检定研究院,北京 100050)
根据给药频次,滴眼液可分为单剂量制剂和多剂量制剂,国内常用滴眼液以多剂量制剂为主,为保证其在连续使用过程中不发生微生物污染,需添加适宜的抑菌剂。滴眼液中所使用的抑菌剂种类和添加量对产品的质量与临床安全性有直接影响。本研究中通过对国内13家企业的牛磺酸滴眼液[1-2]中抑菌剂的种类和含量进行分析,结合抑菌效力,探讨其抑菌剂使用的必要性和合理性,分析国产滴眼液中抑菌剂的应用现状,为提高国产滴眼液制剂质量和加强监管提供有效的技术支持。
1 材料与方法
1.1 试剂耗材
对照品:苯扎溴铵(Sigma-Aldrich公司);羟苯甲酯、羟苯乙酯、羟苯丙酯(中国食品药品检定研究院)。
样品:牛磺酸滴眼液,来自13家企业的75批样品,均为2015年全国评价性抽验样品。
色谱柱:Agilent Zorbax Eclipse XBD-C18柱(序列号USNH033839,250 mm × 4.6 mm,5 μm)。
测试菌株:金黄色葡萄球菌(Staphylococcus aureus)CMCC(B)26003、铜绿假单胞菌(Pseudomonas aeruginosa)CMCC(B)10104、大肠埃希菌(Escherichia coli)CMCC(B)44102、白色念珠菌(Candida albicans)CMCC(F)98001 黑曲霉(Aspergillus niger)CMCC(F)98003(以下简称金葡菌、铜绿菌、大肠菌、白念菌、黑曲霉,中国食品药品检定研究院医学菌种保藏中心,均选第3代菌种)。
培养基:沙氏葡萄糖琼脂(SDA)无菌平皿培养基,胰酪大豆胨琼脂(TSA)无菌平皿培养基(上海诺狄生物科技有限公司)。
1.2 分析方法
抑菌剂含量按2010年版《中国药典·第二增补版》中收载的阿昔洛韦滴眼液中“羟苯乙酯、苯扎溴铵与硫柳汞”项下方法测定;抑菌剂效力按2010年版《中国药典(二部)》附录ⅪⅩN“抑菌剂效力检查法指导原则”要求,测定13家企业产品是否满足药典标准。控制标准见表1。
2 结果
2.1 处方分析
13家企业的样品共有14个处方,其中有1个因单剂量品种未添加抑菌剂(7.14%),有2个使用季铵盐抑菌剂(14.29%),其余均使用尼泊金酯类抑菌剂(78.57%)。详见表 2。可见,国产牛磺酸滴眼液中抑菌剂使用较单一,主要使用尼泊金酯类和季铵盐类抑菌剂,且处方质量浓度差别不大。

表1 眼用制剂抑菌效力评价标准
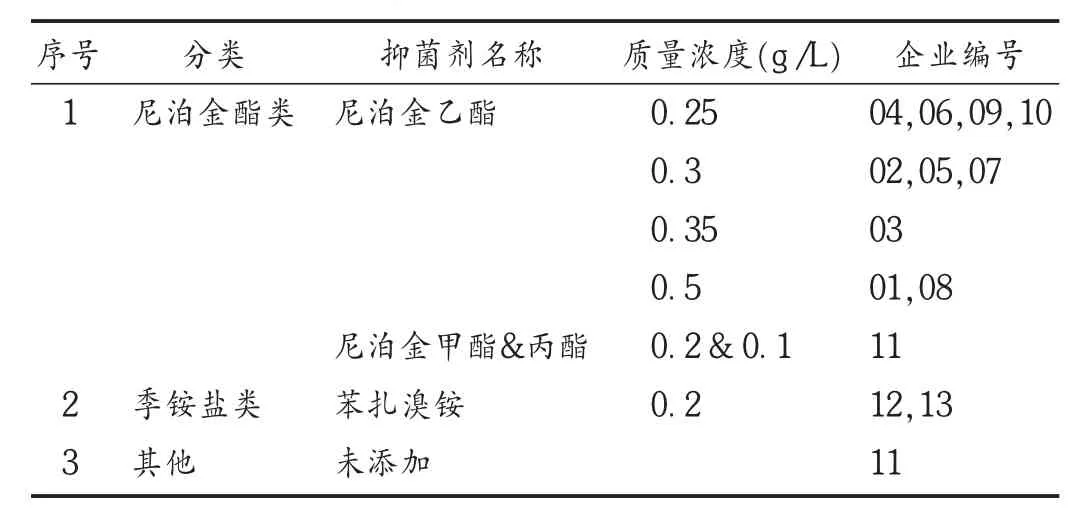
表2 国产牛磺酸滴眼液中抑菌剂处方情况
2.2 抑菌剂含量分析
按照检测方法,对所有含抑菌剂的产品进行含量测定,结果见图1。5家企业产品不足5批,不利于综合分析。箱式分布图仅代表本次试验测定数据。由图1可知,部分企业(编号为 02,05,07,11)部分批次的样品中抑菌剂含量低于80%。

图1 牛磺酸滴眼液中抑菌剂实测含量及相对含量
2.3 抑菌效力分析
不同菌株供试液在不同计数法下的回收率见表3。其中牛磺酸滴眼液原液经直接接种法后回收率不足70%。可见,原液具有一定的抑菌活性,用直接接种法无法保证足够的回收率,需要薄膜过滤法去除抑菌活力。为了获得更真实的微生物数据及便于操作,设定方法如下:在供试品原液级计数时,取供试液1 mL,溶解于100 mL 0.9%无菌氯化钠注射液中,全部通过薄膜过滤器,滤干后,贴于相应的琼脂培养基表面,倒置培养后计数。每家企业的产品进行3次评价,取均值代表产品的抑菌效力。结果国产牛磺酸滴眼液各品种中,苯扎溴铵类抑菌剂的抑菌效力更优,符合2010年版《中国药典(一部)》对抑菌效力的相关要求。而应用较多的尼泊金酯类抑菌剂的抑菌效力未能达到药典要求。主要表现在细菌组,尤其是大肠埃希菌。详见图2。
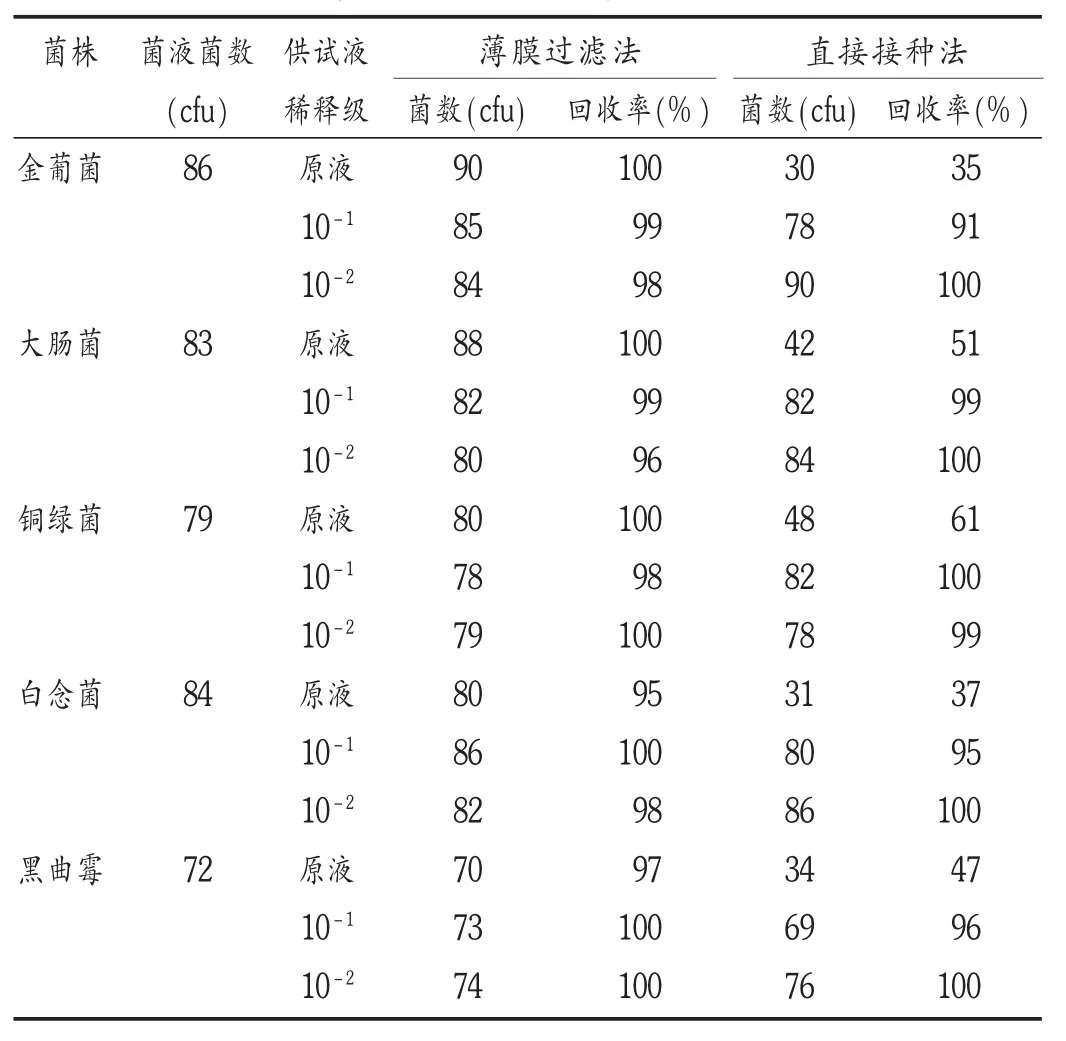
表3 计数方法考察结果
3 讨论
3.1 抑菌剂含量
2010年版《中国药典》在牛磺酸滴眼液品种项下并未收载抑菌剂含量测定方法。本试验中采用了阿昔洛韦滴眼液品种项下方法,因其分离类别多,基本能用于检验添加类别不同的情况,且为2015年版《中国药典》收载。在本实验室开展的专项研究中,该方法对尼泊金酯类(甲酯、乙酯和丙酯)、季铵盐类(苯扎溴铵)、汞类(硫柳汞)均能达到良好分离(数据暂未发表)。
抑菌剂含量通常应控制在处方量的80%~120%。在本试验中,02,05,07,11号企业的部分批次产品中抑菌剂含量不足其处方量的80%,排除试验误差问题,通过回溯实验数据分析,可能存在以下问题:部分企业含量分布情况不一,制剂稳定性差(05企业和11企业);部分企业低限投料(02企业和07企业,不同来源同一批次产品在80%上下浮动)。
2010年版《中国药典》收录了10个滴眼液品种的抑菌剂测定方法,但其测定方法并不统一。目前,在2015年版《中国药典》中,收录项下抑菌剂含量测定的滴眼液品种略有增加(11个),然而并未全面覆盖所有滴眼液品种(共43个)。同时,各类抑菌剂在不同滴眼液品种中的测定方法也不相同。在文献收集过程中,发现各药检单位尝试对滴眼液品种项下不同抑菌剂含量测定进行统一,但各单位间并未达成一致[3-7]。方法不统一可能会造成检测人员操作烦琐,工作量大,而且厂家出厂放行和监管部门裁定认可的标准还存在差异。因此,需要进一步开展标准统一的协调工作,以保证各级产品认可部门最终试验数据的可重复性和认可标准的规范性。2018年3月28日,国家药典委员会于官网发布了《滴眼剂中抑菌剂含量测定法(征求意见稿)》,并提请相关单位按所附方法进行自检,于6月30日前返回检测数据及修订意见。统一规范、灵敏度高、专属性好的滴眼剂中抑菌剂的通用检测方法,将为企业自查提供技术支持,为监管部门有效执法提供有力武器,最终保障临床安全、有效使用滴眼剂[8]。

图2 13个含抑菌剂处方产品抑菌效力测试结果
3.2 抑菌效力
2010年版《中国药典(一部)》附录ⅩⅤD[9]中的《抑菌剂效力检查法指导原则》在2015年版[10]中被修订为《抑菌效力检查法》。名称的改变,不仅在于执行力度上的加强,同时,代表对于产品抑菌能力的认知被进一步推进。抑菌效力已不仅仅被认知为由抑菌剂产生,而是更进一步被认定为由产品整体协同产生。
由表2、图1和图2可见,在使用尼泊金酯类抑菌剂的企业产品评价中,抑菌效力和抑菌剂质量浓度并未呈现简单的正相关关系。以尼泊金乙酯处方含量最高(0.5 g/L)的企业为例,虽然08企业滴眼液中的抑菌剂实测含量明显高于01企业,但01企业的滴眼液抑菌效力更优。回溯处方,01企业在产品中添加了依地酸二钠。据报道,依地酸二钠与抑菌剂联用,可起到更好的抑菌作用[11]。尼泊金乙酯处方含量最低(0.25 g /L)的 04企业,其产品抑菌效力在真菌方面表现优异。回溯处方,04企业添加了较其他企业处方量更大的硼类化合物。硼类化合物对抑菌效力亦有贡献,主要体现在对真菌组的抑制。此结果与同期探索试验结果可以相互佐证[12]。
在所有含抑菌剂的产品评估中,仅含苯扎溴铵类产品抑菌效力满足2010年版《中国药典》要求,而广泛使用的尼泊金酯类产品抑菌效力全线不满足要求。这一现象也应引起业内人士的重视和思考。牛磺酸类品种属于非抗生素类品种,此次试验中发现其抑菌剂使用种类单一,大部分产品不满足标准。相关试验显示,既往抗生素类品种中抑菌剂使用种类和量差异较大[13-15],说明过去研发阶段的抑菌效力问题未引起生产企业重视。要解决老旧处方中的此类问题,需要得到监管、生产和使用三方的进一步重视。
目前已上市品种的评价参照2010年版《中国药典》要求,而申报品种的评价均参照更严格的2015年版《中国药典》要求。药典对相关内容的改版,通过提高检测标准来良性引导企业在处方设计阶段加强对产品性能的整体关注,使其关注点不仅仅局限于主药和杂质成分含量,而是扩大到产品的安全性、稳定性和有效性。
3.3 制剂展望
此次抽验中发现,市场流通领域存在单剂量包装产品。由于2015年版《中国药典》效力检查标准的提高,可能造成企业选用更强效能的抑菌剂或增大抑菌剂投料量,从而增加不良反应发生风险。但单剂量包装产品通过减少使用过程中微生物污染的风险而降低对抑菌剂的依赖,无疑是品种研发的另一方向。

