MCC950在野百合碱诱导大鼠肺动脉高压模型中的治疗作用及其机制研究
齐先梅 王 蕾 张瑞恒 柳 婷 刘 杰 杨 汀 王 军 张知非* 王 辰,4
(1.首都医科大学呼吸病学系,北京 100069;2.首都医科大学基础医学院,北京 100069;3.北京中日友好医院呼吸与危重症医学科,北京 100029;4.中国医学科学院北京协和医学院,北京 100730)
肺动脉高压(pulmonary hypertension,PH)是指以肺血管阻力进行性增高,进而引起右心衰竭,导致患者死亡的临床综合征。近来,炎性反应在PH的发生、发展中的作用越来越受关注[1]。炎性小体是位于胞质内的多蛋白复合物,参与促炎因子如白介素-18(interleukin-18,IL-18)和IL-1β的成熟。炎性小体主要有4种,即NLRP1炎性小体、NLRP3炎性小体、IPAF炎性小体和AIM2炎性小体[2]。其中NLRP3炎性小体由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)和procaspase-1组成,是迄今为止研究最多的炎性小体,被证实与多发性硬化症、痛风和动脉粥样硬化等炎性反应相关疾病的发病机制有关[3-4]。柳婷等[5]研究已证实NLRP3炎性小体参与PH的发生、发展,提示其具有作为治疗PH的潜在手段,但由于一直缺乏特异性阻断剂,致使靶向NLRP3炎性小体治疗PH的研究停滞不前。目前一种新型的选择性NLRP3炎性小体抑制剂(MCC950)的发现[6],使得这一研究成为可能。MCC950 (CRID3, CP-456、773)是一种二芳基磺酰脲类小分子化合物,最初发现其能阻断ASC寡聚并抑制NLRP3炎性反应小体激活[7]。最近研究[6]显示MCC950能选择性抑制NLRP3炎性小体,而不抑制NLRP1、NLRC4和AIM2炎性小体。但目前在肺动脉高压中的作用还不清楚,本研究旨在探讨MCC950对MCT诱导的大鼠PH模型的治疗作用。
1 材料与方法
1.1 主要试剂及仪器
野百合碱(monocrotaline,MCT), MCC950和抗-GAPDH抗体(兔源)均购自美国Sigma公司;抗-NLRP3抗体(兔源)、抗-Caspase-1抗体(羊源)和抗-IL-1β抗体(羊源)均购自美国Santa Cruz公司;IRDyeTM800标记的驴抗兔和驴抗羊二抗均购于美国Rockland公司;NLRP3、ASC、IL-1β和GAPDH引物均购自大连Takara公司。其他常规试剂均为国产分析纯。Odyssey红外成像系统购自美国LI-COR公司;梯度PCR仪及显示系统购自北京北方仪涛商贸有限公司;Real-time qPCR系统购自美国Agilent Technologies公司;导管SPR-838购自美国Millar公司。
1.2 实验动物建模及分组
SPF级雄性SD大鼠27只,体质量250~300 g,首都医科大学实验动物中心提供,实验动物许可证号:SCXK(京)2016-0011。采用数字表法将大鼠随机分为3组(每组9只):Control组、MCT组、MCT+MCC950组。待大鼠适应环境后开始实验,MCT组和MCT+MCC950组:实验第1天单次腹腔注射MCT(60 mg/kg);Control组:实验第1天单次腹腔注射与MCT同等剂量的0.9%(质量分数)氯化钠注射液作为溶剂对照。MCT+MCC950组在注射MCT后,第16~28天每2 d鼠尾静脉注射MCC950(3 mg/kg)[6],共7次。Control组和MCT组给予同等剂量的0.9%(质量分数)氯化钠注射液作为溶剂对照。
1.3 右心室压力及右心肥厚指数测量
实验第31天,大鼠给予2%(质量分数)戊巴比妥钠(30 mg/kg)麻醉后,暴露右侧颈静脉,采用经颈静脉右心导管插管的方法检测右心室收缩压 (right ventricular systolic pressure,RVSP)。麻醉处死后开胸取心脏,剪去心房及心耳,再沿室间隔将右心室(right ventricular, RV)和左心室(left ventricular, LV)+室间隔(interventricular septum, S)分离,用滤纸吸干血液后分别称质量,计算右心肥厚指数RV/(LV+S)。
1.4 肺组织病理学观察和血管厚度的测定
取各组大鼠左肺,0.9%(质量分数)氯化钠注射液灌注冲洗后4%(质量分数)多聚甲醛固定48 h,脱水,石蜡包埋,行常规病理学切片,HE染色。光镜下观察肺部细小动脉病理改变。通过Image Pro Plus 5.1测量管腔的内径和外径,计算肺小动脉血管壁中层厚度占外径的百分比(media thickness,MT%)。为明确各级血管的重构情况,将100μm以内的血管分为4级(0~25 μm,26~50 μm,51~75 μm和76~100 μm),分别统计血管壁中层厚度百分比(MT%)。
1.5 NLRP3 mRNA检测
采用实时定量反转录-聚合酶链反应(real-time polymerase chain reaction, RT-PCR)方法检测,Trizol(Sigma Aldrich公司, 美国)法提取肺组织中的RNA;然后用Takara反转录试剂盒按试剂盒说明反转录为cDNA。-20℃保存备用。以cDNA为模板分别加入NLRP3、ASC、IL-1β和GAPDH正反向引物及相关试剂,于real-time qPCR仪中进行扩增。引物由Primer3.0软件设计,引物资料见表1。PCR反应条件:95℃预变性5 min后,95℃15s、58℃30s、72℃30s,40个循环。以GAPDH为内参照,计算相对定量(Relative quantification, RQ)值进行比较。
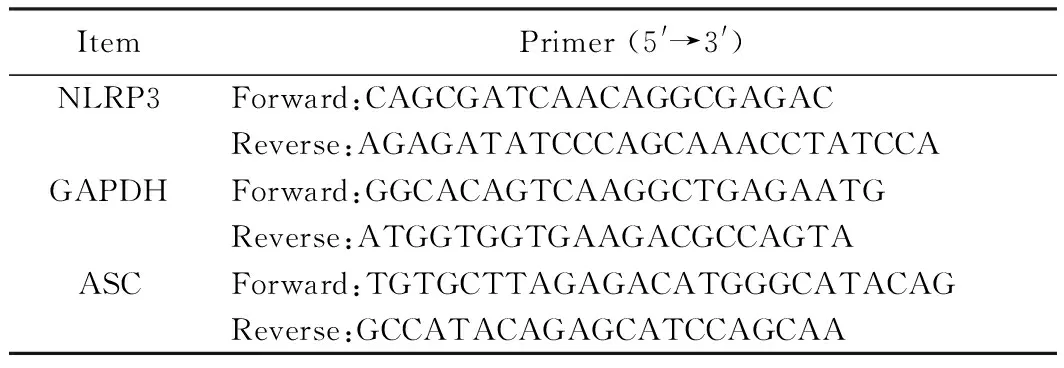
表1 PCR引物Tab.1 Primer used for real-time PCR
1.6 Western blotting法检测
提取肺组织蛋白后用BAC法检测浓度,95 ℃变性5 min。取总量相等的蛋白样品,十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE)法电泳,转膜后5%(质量分数)脱脂奶粉非特异性封闭1 h,加入一抗,NLRP3(1∶50)、Caspase-1(1∶100)、IL-1β(1∶50)和GAPDH(1∶2 000),4 ℃过夜,分别在IRDye 800标记的驴抗兔溶液(1∶10 000)和驴抗兔羊溶液(1∶10 000)中避光孵育1 h,Odyssey扫膜。用Image Pro Plus 5.1软件计算蛋白表达条带灰度值。
1.7 统计学方法

2 结果
2.1 右心室收缩压的改变
在腹腔注射MCT后第31天,MCT组大鼠RVSP较对照组相比明显升高[(50.72±3.65)mmHg(1 mmHg=0.133 kPa)vs(24.29±1.28)mmHg,P=0.000]造模成功;而MCT+MCC950组大鼠RVSP虽然仍高于对照组[(34.19±1.94)mmHgvs(24.29±1.28)mmHg,P=0.000],但明显低于MCT组(50.72±3.65,P<0.01),MCC950能有效降低MCT肺动脉高压大鼠模型的RVSP(图1)。
2.2 右心室肥厚指数的改变
与对照组RVHI 0.29(0.02)相比,MCT组大鼠的RVHI为0.61(0.12),明显高于对照组(P=0.000)。MCT+MCC950组RVHI较MCT组下降至0.48(0.15),差异有统计学意义(P<0.01);MCT+MCC950组与对照组相比,差异有统计学意义 (P<0.01,图2)。
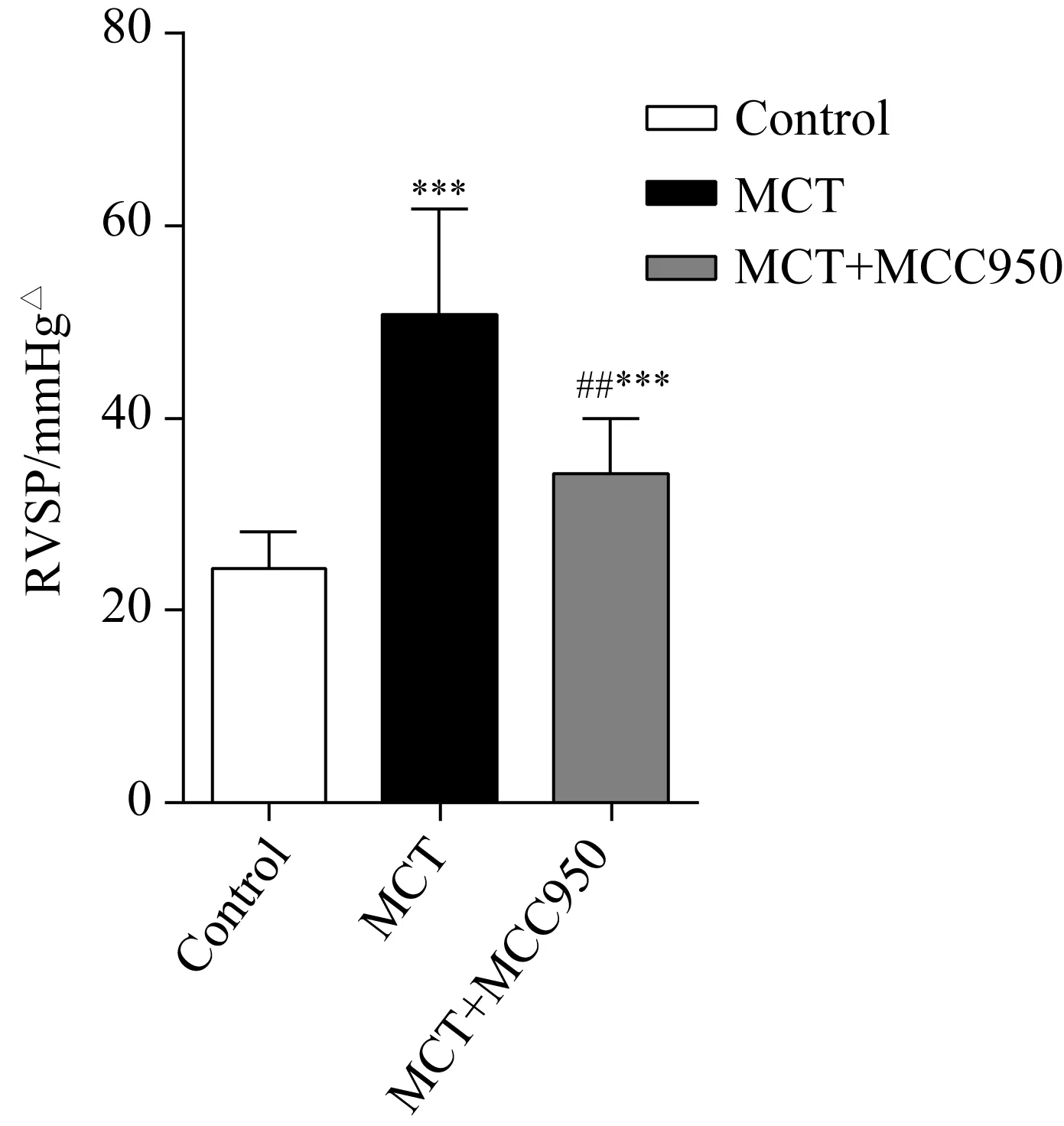
图1 各组大鼠右心室收缩压的比较Fig.1 Comparison of RVSP among different groups*** P=0.000 vs control group,## P<0.01 vs MCT,n=9;△1 mmHg=0.133 kPa.MCT:monocrotaline; RVSP:right ventricular systolic pressure.

图2 各组大鼠右肥厚指数的比较Fig.2 Comparison of RVHI among different groups* P<0.01,** P=0.000 vs control group,# P<0.01 vs MCT (Mann-Whitney U), n=9; MCT:monocrotaline; RVHI:index of right ventricular hypertrophy.
2.3 肺小动脉结构改变
对照组、MCT组及MCT+MCC950组小血管结构改变如图3。对照组大鼠肺小动脉管壁薄,管腔正常,周围无炎性反应细胞浸润;而MCT组大鼠肺小动脉壁增厚明显,肺血管及其周围组织可见大量炎性反应细胞浸润,平滑肌细胞增生明显,排列紊乱,管腔狭窄;与MCT组相比,MCT+MCC950组肺小动脉重塑情况明显改善,但与对照组相比仍重构明显。与对照组相比,MCT组<100 μm各级血管MT%均显著增加(P=0.000);而MCT+MCC950组各级血管MT% 均降低,与MCT组相比,差异有统计学意义 (P<0.01,图4)。
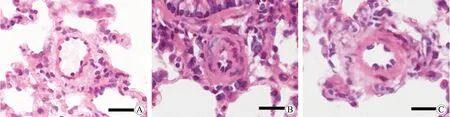
图3 各组大鼠肺组织Fig.3 Sections of the lungs (HE staining,bar=20 μm)A:control group; B:MCT group; C:MCT+MCC950;MCT:monocrotaline.
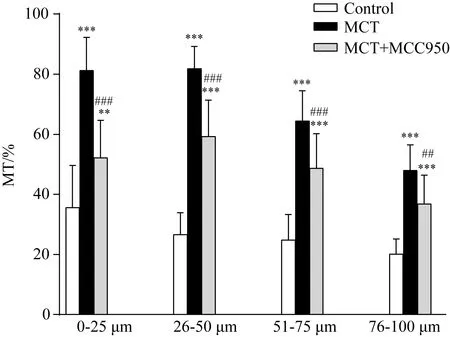
图4 各组大鼠MT%比较Fig.4 Comparison of MT% of small pulmonary arteries among different groups
**P<0.01,***P=0.000vscontrol group,n=3;##P<0.01,###P=0.000vsMCT group,n=3;MCT:monocrotaline;MT:media thickness.
2.4 肺组织NLRP3、IL-1β和ASC mRNA表达
与对照组相比,MCT组大鼠肺组织NLRP3、IL-1β和ASC mRNA表达量明显高于对照组,分别为(2.24±0.23vs1.00±0.04,P<0.05)、(1.66±0.23vs1.±0.02,P<0.05) 和(2.51±0.19vs1.00±0.08,P=0.000);MCT+MCC950组NLRP3、ASC和IL-1β mRNA表达量均较MCT组降低,分别为(0.4±0.07vs2.24±0.23,P<0.01)、(0.25 ± 0.11vs1.66±0.23,P<0.01)和(0.56±0.32vs2.51±0.19,P<0.01);MCT+MCC950组与对照组相比NLRP3 和IL-1β mRNA表达量降低(P<0.01);ASC与对照组相比
差异无统计学意义(P>0.05)(图5)。
2.5 肺组织NLRP3、IL-1β和Caspase-1蛋白表达
NLRP3的蛋白表达结果与RT-PCR技术检测结果基本相符。与对照组相比,MCT组大鼠肺组织NLRP3、IL-1β和Caspase-1蛋白表达量明显增高,分别为(2.47±0.36vs1.00±0.18,P<0.05)、(1.36±0.11vs1.00±0.03,P<0.01)和(1.50±0.12vs1.00±0.02,P<0.05);MCT+MCC950组NLRP3、IL-1β和Caspase-1蛋白表达量均较MCT组降低,分别为(1.21±0.03vs2.47±0.36,P<0.05)、(0.66±0.28vs1.36±0.11,P<0.05)和(0.90±0.05vs1.50±0.12,P<0.01);MCT+MCC950组与对照组相比NLRP3升高(1.21±0.03vs1,P<0.01);Caspase-1和IL-1β与对照组相比差异无统计学意义(P>0.05,图6)。
3 讨论
本研究旨在探讨MCC950对MCT诱导的肺动脉高压的治疗作用。MCT诱导的大鼠肺动脉高压模型是目前最常用的肺动脉高压的模型之一,主要的病理改变与临床动脉性肺动脉高压相似。MCT是从野百合种子中提取的一种吡咯里西啶类生物碱,本身没有毒性,在大鼠体内经肝P450酶系统代谢转化成有毒性的吡咯野百合碱后作用于肺小动脉管壁,导致血管内皮损伤和功能失调,伴有肺血管平滑肌层明显增生肥厚。本研究结果显示, MCT能显著诱导大鼠形成肺动脉高压,说明造模成功。
炎性反应在肺动脉高压疾病进展中的作用越来越受到关注。研究[8]表明,动物模型及人肺动脉高压疾病发展过程中炎性反应起到非常关键作用。损伤和应激时肺血管细胞产生的炎性反应介质募集炎性反应细胞,而炎性反应细胞可能持续释放炎性反应因子和生长因子,形成正反馈的恶性循环,导致肺组织基质重构、胶原沉积和血管细胞的增生和迁移,最终导致肺血管阻力增加和右心衰竭[9]。有研究[5,10]表明低氧及MCT诱导的肺动脉高压模型中NLRP3、IL-1β表达显著上调,提示NLRP3炎性小体的活化及下游的炎性反应因子参与了肺动脉高压的发生、发展。研究[5,10]结果显示格列本脲和鞣花酸能缓解PH并抑制NLRP3炎性小体,提示阻断NLRP3炎性小体通路可能是PH治疗的有效途径。然而,降糖药格列本脲和抗氧化剂鞣花酸都是NLRP3炎性小体的非特异性阻断剂,作用机制复杂。
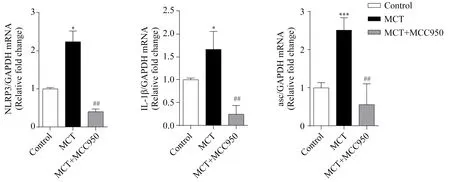
图5 RT-PCR检测各组大鼠肺组织中NLRP3、ASC和IL-1β mRNA水平Fig.5 Lung mRNA level of NLRP3, ASC and IL-1β in rats by real-time PCR*P<0.05,***P=0.000 vs control group, n=3;## P<0.01 vs MCT group,n=3;MCT:monocrotaline;NLRP3:nucleotide-binding domain and leucine-rich repeat PYD-containing protein 3; IL-1β:interleukin-1β; PCR:polymerase chain reaction.

图6 Western blotting检测各组大鼠肺组织中NLRP3、Caspase-1和IL-1β的蛋白表达Fig.6 Expression of lung NLRP3, Caspase-1 and IL-1β in rats by Western blotting* P<0.05,**P<0.01 vs control group,n=3;# P<0.05,## P<0.01 vs MCT group,n=3,MCT:monocrotaline;NLRP3:nucleotide-binding domain and leucine-rich repeat PYD-containing protein 3; IL-1β:interleukin-1β.
MCC950是新发现的选择性NLRP3炎性小体抑制剂,研究证实MCC950可通过2条途径抑制NLRP3的活化,经典途径中MCC950抑制Caspase-1的活化以及IL-1β的加工;非经典途径中MCC950阻断Caspase-11诱导的NLRP3活化。因此该研究指出MCC950可能与NLRP3结合,从而影响其活化,这一过程可能涉及翻译后修饰。此外MCC950还可以抑制NLPR3诱导的ASC的寡聚化,而这一过程是NLPR3炎性小体活化的关键步骤。研究[6]显示MCC950特异性抑制NLRP3,是因为其能有效抑制NLRP3炎性小体活化,而不影响NLRP1、NLRC4和AIM2炎性小体,以及K+外流和Ca2+内流。因其选择性阻断NLRP3炎性小体的特性,与IL-1β生物抑制剂相比存在某些优势,因为MCC950没有阻断主要的抗菌炎性小体NLRC4或NLRP1,靶向性阻断NLRP3炎性小体不会导致体内IL-1β完全被阻断[6],有研究[11]显示MCC950可能不影响LPS诱导的脾细胞中IL-1β和TNF-α的产生,提示抗菌反应可能保持不变,因此与生物制剂IL-1β单克隆抗体如康纳单抗相比,MCC950的免疫抑制作用更小,可能降低机会性感染的风险[12]。
本研究通过检测3组大鼠的血流动力学和形态学指标,发现MCC950能显著缓解MCT诱导RVSP、RVHI以及各级肺血管重构情况,证实了MCC950对PH的治疗作用。通过RT-PCR 和Western blotting法检测各组大鼠肺组织中NLRP3、IL-1β及相关分子基因转录与蛋白表达,发现MCT组与对照组相比各项指标均上调。而使用MCC950后,NLRP3、IL-1β及相关分子mRNA及蛋白表达与MCT组相比表达降低,且MCT+MCC950组 NLRP3和IL-1β的mRNA量比对照组低,提示MCC950在基因转录水平负性调节NLRP3/IL-1β信号通路的表达,具有较强的NLRP3抑制功能。这项研究的结果表明MCC950可以缓解MCT诱导的大鼠肺动脉高压,证实NLRP3炎性小体参与了PH的发生发展。为选择性NLRP3炎性小体抑制剂MCC950作为一种有前景的治疗药物提供了证据。
综上所述,本实验研究结果提示MCC950可能通过抑制NLRP3炎性小体活性缓解雄性MCT大鼠的肺动脉高压。MCC950能下调MCT诱导的雄性肺动脉高压大鼠中NLRP3炎性小体的表达水平,未能完全逆转MCT大鼠的血流动力学指标和形态学表现,一方面可能因为实验给予MCC950干预的时间点选择在MCT 诱导肺动脉高压的第16天,肺动脉高压已经形成,完全逆转疾病的进程非常困难。另一方面,肺动脉高压病因及发病机制复杂,NLRP3炎性小体的激活只是参与肺动脉高压发病的机制之一。
本研究将NLRP3炎性小体特异性抑制剂MCC950应用于大鼠MCT-PAH模型,证实了特异性抑制NLRP3炎性小体有作为PAH治疗途径的潜在可能,与之前用非特异性NLRP3抑制剂缓解PAH的研究相比,排除了其他复杂机制的干扰。

