从阿西洛马会议到华盛顿峰会:专家预警在生物技术治理中的角色与局限
(中国科学院 自然科学史研究所,北京 100190)
1972年,斯坦福大学的生物化学家伯格(Paul Berg)第一次实现了不同物种间基因片段的拼接,从而标志着重组DNA技术的诞生。四十年后,现代生物技术的发展突飞猛进,CRISPR/Cas9(Clustered regularly interspaced short palindromic repeats/CRISPR-associated 9)技术出现,这种源于古细菌免疫机制的基因编辑技术使人们能够以传统技术多倍的效能完成对基因组的编辑。短短五年间,这一技术已成为全球各大生物实验室的平台技术,被广泛地使用在植物、动物、体细胞甚至人类胚胎细胞的编辑中。早在2016年,这一技术被美国中央情报局主任James Clapper称为潜在的大规模杀伤性武器。[1]
每一次激进的技术进步都会引发强烈的社会关注与讨论,同时也衍生出与技术应用相匹配的各项制度与法规。1974年,8位生物学家公开致信《科学》杂志,提出DNA重组技术的风险需要得到充分评估,在此之前呼吁暂停这项技术的应用。[2]同时,科学家们还呼吁组织一次国际会议以探讨技术的潜在风险。于是,1975年在美国加利福尼亚州举办了阿西洛马会议(Asilomar Conference),探讨了重组DNA技术应该在什么样的条件下继续,这次会议也成为当代生物技术治理的重要里程碑。历史总是惊人的相似。2015年3月12日,5位科学家在《自然》杂志发声,提议不要使用基因编辑技术编辑人类胚胎细胞,即使是为了研究服务,[3]他们还提出应该清晰地界定体细胞编辑与生殖细胞基因编辑的差异,倡议科学界能够自愿暂停与生殖细胞有关的研究活动,并呼吁进行一次更加全面的国际对话。然而一个月后,由中山大学黄军就团队完成的人类胚胎编辑的论文便发表在《蛋白与细胞》杂志上[4],这一事件继而引发了更加激烈的讨论。2015年12月,由美国科学院、英国皇家学会与中国科学院共同举办的人类基因编辑峰会在华盛顿特区举行。这次会议也被人们称作是基因编辑的阿西洛马会议,尝试在技术发展之初获得更大范围的对发展的共识。本文希望就这两次对于新兴生物技术的“共识会议”进行讨论与对比,来探讨这种以科学家为中心的自我规制与预警式技术治理模式的优势及问题。同时,本文还将审视基因编辑技术的国际治理难题以及与之相关的诸多努力。
一、阿西洛马会议:预警性技术治理的开始
1975年2月在美国加利福尼亚州举行的阿西洛马会议,已经成为人们回溯当代生物技术治理的起点,被作为科学界成功自我调节的典范。李建军在国内较早地阐释了阿西洛马会议的意义[5],认为阿西洛马会议是预警性思考的成功例证。车静在其硕士论文《生物安全管理的基石:阿西洛马重组DNA会议研究》中也对这次会议的背景、议程、共识以及其在生物安全领域起到的重要作用进行了研究。[6]在国际学术界,对阿西洛马会议的讨论集中在其历史地位及其在实验室生物安全管理中起到的积极作用[7,8]。同时,近年来也有若干学者反思阿西洛马模式的不足,如Krimsky在2006年的一篇文章中就批判了阿西洛马会议采用的风险评价模式带来的社会管理的局限性,以及这种还原论的立场是如何影响了美国的法规的建立。[9]Jasanoff在文章中也谈到阿西洛马会议没能在生物技术的研究之初纳入更多利益与价值的冲突,这甚至导致了GMO技术路线的问题以及全球争议的产生。[10]Paul Berg是这次会议的主办者之一,他认为这是改变世界的会议之一,他曾在《自然》杂志上撰文,表示阿西洛马会议取得了辉煌的成就,这为“遗传学家在不危害公众健康的基础上将研究发展到极致”铺平了道路。[11]那么,这一广受瞩目的会议是如何组织举办的,解决了哪些问题,又搁置了哪些争议呢?
20世纪70年代初,对重组DNA技术的应用引发的担忧最早出自于Paul Berg位于斯坦福大学的实验室。DNA重组的中介是细菌,因为细菌间遗传信息的交换是一个天然、普遍的现象,而利用这一特征使得遗传信息跨越物种传播则是人类的壮举。Berg的实验室正在准备用猴病毒SV40与噬菌体DNA重组成一个杂合分子,并将这一杂合分子导入大肠杆菌,但是实验室的研究员担心猴病毒SV40所包含的原癌基因会通过大肠杆菌逃逸到环境中,使得实验室人员徒增罹患癌症的风险。这一问题带来的担忧就由刚才我们谈到的发表在《科学》上的公开信传达了出来[1]。这篇文章建议成立一个调查委员会来考察重组DNA分子的后果,在未得到结果前,相关的实验都需暂停。美国国家科学院主席任命Paul Berg成立分子生物学家小组,详细调查重组DNA技术的可能风险。很快,这一小组也在《科学》发表了“重组DNA技术的潜在生物风险”的文章,提出四点建议。第一,在完全评估重组DNA实验的潜在危害、相关的防范措施前科学家应自愿主动地禁止涉及重组DNA分子操作的实验;第二,那些计划连接动物DNA和质粒DNA或者噬菌体DNA的实验人员应该要意识到许多动物细胞DNA包含致癌的病毒RNA片段;第三,建议NIH成立咨询委员会,评估重组DNA实验潜在的生物学危害和生态学危害,并采取措施把这些重组分子在人群及其他群体中传播的可能性降到最低;第四,尽快在1975年召开一次国际会议重新审视分子生物学的进展,讨论出适当的处理基因重组技术的潜在生物危害的方式。[12]在这一提议后,大批使用重组DNA技术的科学家自愿暂停了实验,大家在风险面前表现出谨慎的保守态度,这也使得在第二年召开的阿西洛马会议有的放矢,针对如何应对生物技术的风险与治理进行了充分的讨论。
1975年2月24日,来自全世界的150名科学家(其中有1/3来自美国以外),4名律师,16名媒体代表以及政府官员来到阿西洛马,共同商讨重组DNA技术的未来。参会者按照重组DNA的来源分为:原核生物、噬菌体和质粒小组;动物病毒小组;真核生物小组。通过讨论,三个小组建议采用以下三个步骤来应对实验中的风险。首先要确定潜在的生物危害,其次配备与潜在的危害相匹配的严格的实验室防护措施,最后要严格管理实验室中的生物体,同时禁止那些可能产生危害的实验。会议的前期,讨论一直集中在科学家如何防范实验室中的风险以及生物泄露等问题,Paul Berg认为“我们不能告诉公众,100多名科学家在这里花了几天时间只得出了重组DNA实验具有潜在生物风险,连一个像样的结论都拿不出来”。[13]就在科学家们陷入僵局的时候,一位印第安纳大学的法学教授发言,强调尽管科学界可以自主管理,但是科学家如果在安全条件不充分的情况下进行危险的实验,并产生了对他人的伤害,将承担不可推卸的法律责任。[14]来自法律界的不同声音震动了科学家,大多数参与者开始采取更谨慎的态度,他们最终拟定了一份《阿西洛马重组DNA声明》发表在《美国国家科学院会刊》中[15]。
这份《声明》总结了在阿西洛马会议上得到的一些共识。(1)对重组DNA 技术发展初步达成共识:大多数的重组 DNA 实验应该在适当的安全措施下继续进行;那些存在潜在重大风险的实验应该在现有控制条件下暂停进行。(2)确立了重组DNA实验研究的指导方针或准则:在实验设计阶段就应该考虑其潜在的生物危害等风险,明确相应的控制措施。(3)就一些暂缓或严令禁止的实验达成共识:如利用重组DNA技术制造可能造成潜在危害的杂交人类等。(4)提出生物科学家、科研机构的行动指南。
经历了16个月,生物实验室在新的指导原则下开始了试验,科学并没有因为暂停受到阻碍,反而这一主动的暂停为科学界赢得了信任,为此后生物技术的发展赢得了宝贵的空间。科学共同体在新技术的不确定性面前的主动预警是一切新兴技术治理的开始,这也是阿西洛马会议最宝贵的遗产。然而预警是不足以满足善治的目标的,尤其是当科学与商业利益的契约越来越根深蒂固,这种预警似乎只能影响到那些受政府经费限制的科学家。美国20世纪80年代的新保守主义的立场将大学与产业的边界模糊,从而使得科学更加倾向于私人利益而非公共事业。[8]然而,反观阿西洛马会议,其讨论的问题仍然集中在预测基因重组技术的生物学风险上,甚至是以实验室内的风险与如何防止实验室产物的外溢为核心的。同时,其整体议程是以科学研究为中心的,并未对技术应用的可能的制度、伦理与法律等问题进行深入的讨论。虽然阿西洛马会议突出了科学家们的前瞻性,但是,同时也反映了会议中对于研究风险的设想是简单化的、受局限的。当转基因作物走向消费市场时,在美国引发了热烈的讨论,但如果治理措施只集中在实验室内外的防护,那么我们就无法预见到新技术争议的广度和强度。阿西洛马会议中制定的风险、利害关系的范围太过狭窄,没有覆盖到道德、法律及伴随科技革命带来的一系列社会问题,这甚至是导致转基因争议的导火索。[9]
那么,在面临新的技术挑战时,我们是否从阿西洛马会议中吸取到了经验与教训,我们能否构建公众对于新技术的信任与合理的分配机制呢?
二 、华盛顿人类基因编辑峰会
基因编辑为人类提供了一个非常有益、甚至难以拒绝的技术转型,它能够在快速、价格低廉的基础上精准地找到异常基因并且对其进行修正。然而这项技术距离临床还存在着巨大的差距,这也带来了一系列技术风险。Doudna将这些风险归结为五类。第一,一些编辑可能会被靶向的诱变混淆,例如,一个人可能无意中将镰状细胞病转化为地中海贫血症。第二,尽管脱靶效应的比例会随着技术进步不断降低,甚至被最小化,但仍有可能发生关键基因的突变,而编辑后的个体的后代也许会因为基因突变增加其风险。第三,如果“被编辑”的个体希望纠正的是嵌合体,那么他们仍然可能在关键组织中有病变细胞。第四,疾病突变存在的遗传背景可能在某种程度上适应了携带这种突变,而将基因修正回“野生型”可能会产生一些意想不到的后果。第五,很难预测和评估生殖细胞系编辑带来的非预期的长期后果。[16]
与以往的技术进步不同,在基因编辑领域,中国科学家的角色从跟随者变成了领跑者,这就要求中国科学界与政府更好地参与这一问题的国际治理。因此,在黄军就事件后的八个月,2015年12月1日—3日,在华盛顿特区举办的人类基因编辑国际峰会(International Summit on Human Gene Editing)中,中国科学院成为了重要的组织方,会议的主办机构还包括美国科学院、美国国家医学院以及英国皇家学会。诺贝尔奖得主、加州理工大学的巴尔的摩(David Baltimore)是此次会议的主持人,他在四十年前也同样参与了阿西洛马会议的组织工作。与阿西洛马会议相似的是,这一峰会的举办也是国际科学共同体的意愿,他们期待能够通过国际会议来塑造对这一技术发展的共识,因此峰会的主要任务就是讨论人类基因编辑有关的科学、伦理与治理问题。华盛顿峰会共吸引了500余人参会,更多的人通过网络观看了峰会的视频。参会的中国科学家包括许志宏院士、季维智院士、李劲松研究员、裴端卿研究员等人,他们作为中国科学界的代表介绍了中国的治理与伦理框架以及基因编辑的研究进展。
整体来看,会议沿着四条线索展开。第一,介绍基因编辑技术的历史、发展与科学背景;第二,探索基因编辑技术在人类胚胎、体细胞等方向的应用前景;第三,探讨这项技术的社会应用以及问题;第四,从机构、国家与国际层面探讨基因编辑技术的治理问题。在二十余场报告中,只有来自芝加哥洛约拉大学的伦理学家Hille Haker“效仿”阿西洛马的传统,提出了暂停胚胎细胞有关的基础研究两年,并要求国际社会确保禁止以生殖为目标的基因编辑活动。她认为,我们社会发展的目标应该是建设一个可以让全体社会成员都感到自由与尊重的社会,但基因编辑不会帮我们靠近这一目标,反而带来更多问题。然而,这一提议并未成为大会共识的一部分。经历了三天的讨论,与会代表们达成了三点共识。(1)与人类基因编辑有关的基础研究可以在现行的管理条例下进行,包括在实验室对体细胞、干细胞系和人类胚胎的基因组编辑来进行基础科学研究试验;(2)对于体细胞基因编辑,报告提出四点原则:利用现有的监管体系来管理人类体细胞基因编辑研究与应用,临床试验与治疗只能在已有治疗手段不足的情况下使用,从风险与收益两个角度来评价安全性与有效性,在应用前需要广泛征求大众意见;(3)对于生殖细胞的基因编辑,报告提出的原则是:在有令人信服的治疗目标、预防严重疾病或残疾的目标的情况下,同时临床操作需在严格监管体系下才允许开展;任何可遗传生殖基因组编辑都应该在充分的、持续的反复评估和公众参与下进行。[17]
在华盛顿峰会结束后,由美国科学院主导的另一项相关研究开始了,即研究人类基因编辑技术的可能应用、伦理与公众参与问题。这一研究由一个跨学科的专家委员会引导,包括生物学、伦理学、法学、公共政策等领域的专家。在峰会结束后,研究者们完成了大量的针对研究者、医生、政策制定者以及公众的访谈,并组织了四场公众会议。最终,在2017年年初发表了《人类基因组编辑:科学、伦理与治理》研究报告。[18]这本报告维持了峰会上对基因编辑基础研究、体细胞研究与生殖细胞编辑以及人类增强研究的态度,同时花了大量笔墨探讨如何在不同的社会与国家语境中完善治理结构,推动公众参与。接下来,在2018年的11月27—29日,将在香港举办第二届人类基因组编辑国际峰会。与第一次峰会相比,四个主办单位中,只有中国科学院变成了香港科学院。
如何评价这次峰会的意义与在生物治理领域的价值?这次会议几乎为人们所担忧的所有基因编辑的应用松了绑,只要求研究符合其所处国家与地区的研究规范与伦理、法律规则,那么其管理就极大地依赖各国的政策环境。如在美国,人类胚胎基因编辑的研究无法获得联邦资助,如果要取消相关限制,那么就要证明这些研究是迫不得已的唯一选择,同时,其研究将被限制在非常狭窄、严格的监管体系下。但是在很多非联邦资助的实验室中,与人类胚胎细胞相关的研究一直走在最前沿。[19]在中国,人类胚胎相关研究的进行若符合《人类辅助生殖技术管理办法》(2001)与《人胚胎干细胞研究伦理指导原则》(2003),通过研究者所处机构的伦理委员会(IRB)便可以进行(这也是黄军就等研究组经历的审查过程)。在英国,所有与人类胚胎相关的研究都需要经过人类生育与胚胎管理局(Human Fertilization and Embryology Authority, HFEA)的统一审核才能在相关法规下进行。不同国家与地区有着严厉程度不同的管理模式与理念,但是科学研究的成果却是普世的。同时,人类基因组并不属于任何特定的文化、国家或者地区,也并不属于科学本身。它属于人类,对每个人来说都是平等的。该项技术研究发展的进度务必要对人类自身负责。那么这次“国际峰会”是否能够承担起这项重要责任呢?Berg在2008年的文章[6]中,除了回顾了阿西洛马的辉煌成就外,也指出了这类会议在处理当今的科学与公众的争议的问题,并不是一个成功的模式。这意味着生物与遗传学家有权利“将研究发展到极限”,而限制他们的只是技术上的风险。科学家们将CRISPR技术的问题窄化到他们最了解的风险,从而要求广大公众听从科学家们所理解的“危险”。即使有呼声要求“广泛公众对话”,也会受到专家的限制。此外,整个峰会的讨论分为两大阵营,科学专家探讨技术问题,而研究伦理与法律问题的学者则探讨这一技术的伦理风险与社会规范的问题,两个阵营之间缺少相互交流。这一模式似乎又回到了自人类基因组计划开始成立的ELSI(ethical, legal,social implication)所设定的研究进路。而ELSI进路广受批评的主要原因就是它在为科学的平稳发展寻求保护圈。[20]
与阿西洛马会议时期相比,基因编辑技术面临的最大的变化是,四十年后的生物技术产业已然蓬勃发展,而基因研究已经不仅仅局限在大学的实验室、政府资助的研究机构之中,大量医药企业内的生物实验室也是这股浪潮的重要参与者。“将研究发展到极限”意味着将生物医学的商业潜力发展到极限,而这条发展良好的技术通路如果不加以调节,必然会在基因编辑问题上为我们造成更大的麻烦。财务与资源的差距会使得穷人和富人抱有不同的健康预期,这种不公平甚至可以从出生便开始了。因此,简单地套用阿西洛马模式来完成对基因编辑的治理,恐怕只算是在这一复杂、困难的问题上迈出了很小的一步,[21]甚至是在原地踏步,亦或是一种退步。
三、结论与讨论
我们经常将阿西洛马会议与华盛顿峰会相提并论,主要原因是这两次会议都是在技术发展之初寻求科学共同体内部甚至更大范围内对技术发展的共识的努力。首先,我们通过表1将这两次会议的主要内容、目标、结果、争议进行对比。
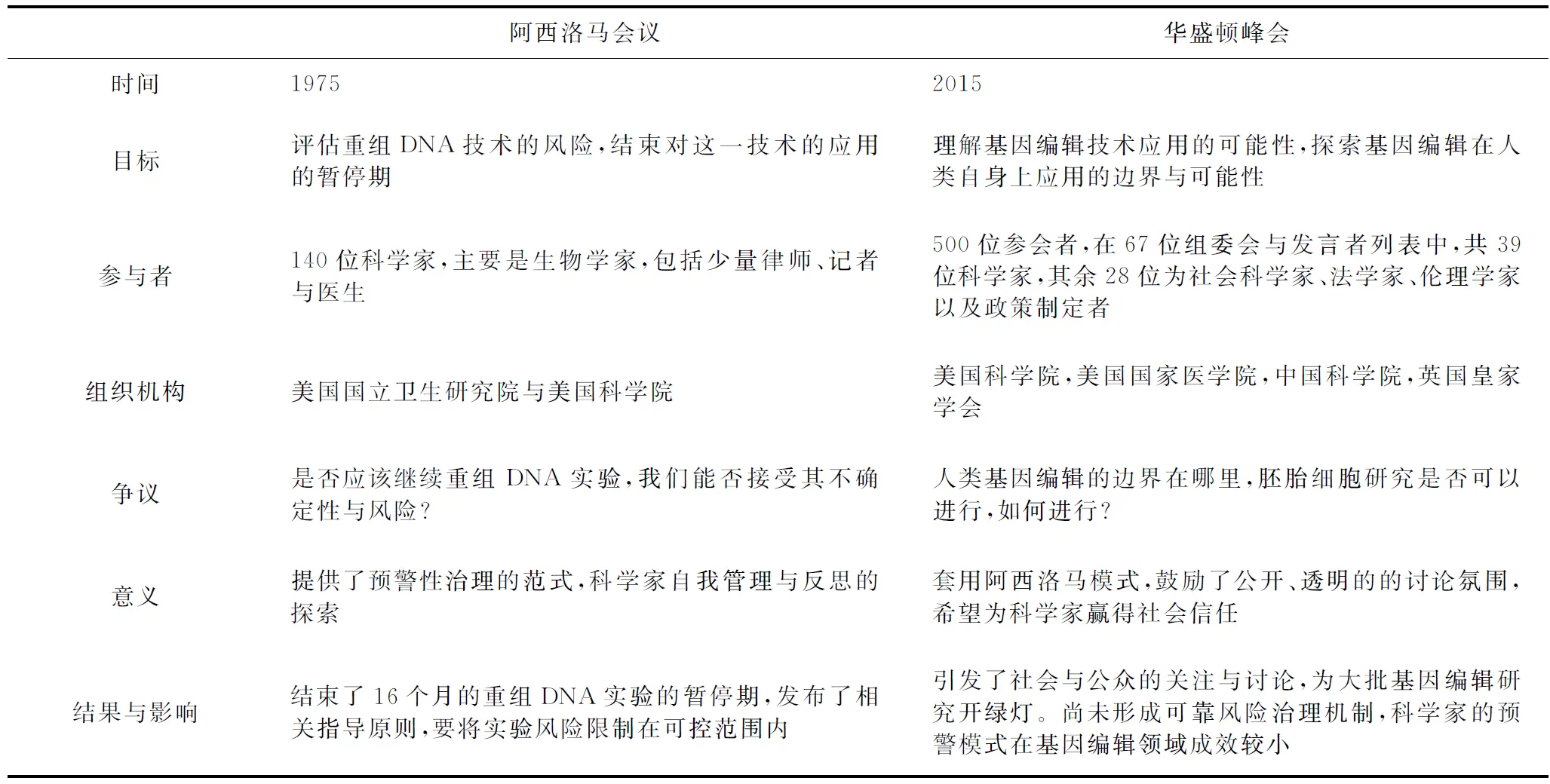
从两次会议的简单对比我们可以发现,尽管技术在飞速进步,然而人类社会与其相互适应的能力却提高不多,甚至在某种意义上是原地踏步或退步。当然,近四十年来以西方科学社会学、伦理学与STS群体为主的社会科学家在不断思索技术如何能够更好的嵌入社会。最后,我们或许应该将眼光放远,看一看近年来在新兴技术的治理领域有哪些可供参考的思维框架,能够帮助我们更好地应对这些充满着不确定性的技术。比如,我们所熟知的有建构性技术评估(constructive technology assessment,CTA), 这一进路旨在通过尽可能多的相关社会因素的持续参与,为实现技术与社会发展的最佳结合而扩展关于技术的决策过程。[22]亚利桑那大学Guston等人提出的实时技术评估(Real-time Technology Assessment)与CTA有着相似的路径,更注重技术的政策制定过程,力图在研究初期融合公众与研究者的价值,建立可预期的未来场景,并反思这些结论应该如何影响决策。[23]在英国,研究理事会以超越ELSI为目标,资助STS学者进行参与式的生物技术的知识生产与治理的探索,被称之为STS“参与进路”。[24]欧盟自“地平线2020”计划将“负责任研究与创新”(Responsible Research and Innovation)作为重要目标和贯穿性议题,所有的科研项目都该反思其研究的社会意义与价值。负责任研究与创新强调一个透明互动的过程,在这一过程中,社会行动者和创新者彼此相互反馈,充分考虑创新过程及其市场产品的(伦理)可接受性、可持续性和社会可取性,让科技发展适当地嵌入我们的社会中。[25]这些美好的研究框架在一些微观研究上获得了一定的成功。比如,英国在应对合成生物学带来的争议的过程中,为了避免另一个“转基因”事件,就不断地采取与公众、利益共同体及各领域专家互动的工作方式,在研究初期获得了较好的社会信任度,并引导合成生物学的研究设计更加趋向于公众利益。这类研究的一个共同目标就是要将价值、社会选择与伦理等考虑融入到科学技术的研究过程中,从而尝试构建一种新的科学观——这种科学不仅满足科学家的好奇心与优先权焦虑,更要满足科学的根本目标,即服务于生生不息的人类社会。然而,此类研究的弊端也显而易见,当科学家的利益、产业利益、未被定义的公众的利益出现冲突的时候,没人能够真正代表利益受损方。
在生物医学研究中,科学家们“将研究发展到极限”的观点不仅仅反映了他们想要满足好奇心的欲望,同时也反映出想要通过知识战胜疾病的希望。但一项技术只有真正变成大众可以购买和使用的产品,才有可能使人们从中获益。也就是说,接受治疗与产品生产很重要一部分取决于制度与经济上创新。然而,当我们考虑科技发展的条件时,经常以科学进步为起点来外推,相反,在面对人类胚胎编辑这类的技术突破时,我们应该寻找的约束条件应该是现有的监管与政治制度在多大程度上能够保障这项技术被安全、公平、合理的使用。这一“倒推”式的分析视角,并不是要限制发展,而是帮助我们从另一个角度来清醒地认识技术发展的壁垒时刻存在,并且急需一种全盘的考虑。我国学者对此也有探索,例如,刘益东基于长期对科技巨风险研究,提出科学的总体安全观,强调底线安全、人类安全、可持续安全。明确指出一项科技是否应该发展首先不取决于其正面效应,而是取决于其负面效应的严重性,取决于社会能否承受、化解、抵消该科技的负面效应[26],这为相关政策制定提供了参考。他还提出“可持续创新与发展(SID)”理论[27],比较系统深入地探讨了社会对技术的约束与转型问题。
社会与科学的不成文的契约保证了科学的自主权,同时,在当前的生物技术治理中有一种倾向,即在科学研究前沿的人最容易发现、理解技术风险。依赖专家的倾向存在着合理性,但也应该反思这种倾向是否也存在着“风险”。很多时候,科学家都倾向于限制关于人类基因编辑的争论,尤其会设定这样的前提:在技术能力确实存在之前,没有必要去解决编辑胚胎细胞是否值得干预的难题。但结果却是科学发展一旦被实现,我们便不可避免地难以对其进行控制(著名的科林里奇困境),尽管它们是科学家们的选择的产物。因此,反思这种“专家预警”在技术治理中的角色与局限,在当今的后基因组时代尤其重要。我们无法一劳永逸地完成道德和规章的制定,良好的治理与审议过程应该是不断循环上升的、包容的,科学家在其中的角色应该是重要的参与者,共同塑造有益于科技的健康发展,科学家无需扮演传统的权威专家角色。毕竟,在后基因组时代,更好地理解技术带来的社会关系、伦理、法律等社会变革才有可能理解技术本身,才能更好地将技术进步转化为惠及全社会的福祉。

