两种新型含噻吩衍生物的卟啉材料的合成及光伏性能研究
向钠,郭清华,曾礼丽
(湖南理工职业技术学院,湖南 湘潭411104)
0 引言
染料敏化太阳能电池(DSSC)的提出是由瑞士的Grätzel 教授首次提出,他们实验室合成的钌吡啶染料转换效率达到了7.1%,自此DSSC得到了科研工作者的关注和研究[1]。染料敏化太阳能电池是由光敏剂剂、光阳极、对电极和电解质等四个部分组成,而光敏剂的研究是当前DSSC研究的中热点之一。在光敏剂的研究中,多吡啶钌染料是一种转换效率比较好的染料,比如:N719,N3等染料的光电转换效率超过了11%。但是这些染料也有限制其大规模发展的因素:①稀有元素钌比较昂贵;②TiO2容易引起钌光敏剂光解而降低其太阳能电池的稳定性。因此,研究更加便宜、高效稳定的染料成为很多研究者的重要方向,在众多的染料中,卟啉由于在可见光区具有较强的光吸收性能得到广泛关注。
为了进一步提高卟啉染料分子的能量转化效率,本文合成了β位噻吩修饰卟啉结构D1和中位二噻吩修饰卟啉结构D2 (见图1)。其中D1的结构是在β位引入双键己基噻吩,其目的是增强染料的共平面性,使电荷的传输更加有利;而己基的引入主要是考虑降低相邻卟啉分子的在TiO2上的聚集几率。而D2的结构则是在卟啉中位引入了双己基噻吩,其目的是加宽染料的吸收光谱。同时,本文还对两种染料的光物理、电化学和能量转换效率进行了比较研究。

图1 染料D1、D2分子结构图Fig.1 Molecular structure diagram of D1 and D2
1 染料的合成与表征
1.1 D1的合成方法
D1和D2的合成路线如图2所示,D1染料的合成中,化合物1-4的合成方式参照文献合成方法[2-5],本文重点讲述化合物5,6,7,以及D1的合成方法,具体方式如下:
化合物5
将化合物 3 (0.34g,0.48mmol),化合物 4 (0.29 g,0.94 mmol)加入到100 ml圆底烧瓶中,并添加THF溶液30 ml。通入氮气保护,逐滴BuOK(8 equ)的THF溶液,室温下搅拌反应12 h。粗产物通过提纯后得到紫红色固体化合物5 (0.27 g,63%)。
化合物6
在100 mL的三口瓶中通入氮气保护,在冰浴条件下,加入DMF (0.47 mL,20 mmol)后再加入POCl3(0.55 mL,20 mmol),搅拌 10 min,将化合物5 (0.26 g,0.3 mmol)溶入到50 mL 1,2-二氯乙烷中,再逐滴加入到三口烧瓶中。待温度缓慢升至室温后再加热回流12 h。将三口烧瓶中的溶液冷却至室温,加入饱和的醋酸钠溶液搅拌0.5 h。反应溶液经过萃取、水洗、干燥后,粗产品通过硅胶提纯法得紫色固体化合物6(0.22g,75.4%)。
化合物7
将化合物6 (0.18 g,0.2 mmol)和醋酸锌(0.92 g,5 mmol) 加入到100 mL的三口瓶中,加入并加入CHCl3:CH3OH =1:5混合溶液 100ml,加热回流2 h后,再冷却至室温,经过水洗干燥后,旋干溶剂得到紫红色固体7 (0.17 g,90%)。
D1
将卟啉化合物7 (0.20 g, 0.2 mmol)和氰基乙酸(0.07 g, 0.8 mmol)加入到50 mL的三口瓶中,再加入乙腈15 mL和甲苯5 mL,体系通入氮气30 min后,再加入哌啶0.5 mL。反应混合物加热回流12 h。反应物经过冷却、萃取、水洗、酸洗、干燥后,旋干溶剂,得到粗产品用硅胶柱提纯得紫红色固体化合物D1 (0.14 g, 70%)。
1.2 化合物D2的合成方法
化合物D2的合成路线如图3所示。化合物8-11的合成方式参照文献方法,化合物15的反应过程与化合物7相似,用化合物14代替化合物6即可。化合物16的反应过程与化合物13相似,用化合物15代替化合物12即可。化合物D2的反应过程与化合物D1相似,用化合物16代替化合物7即可。本文重点讲述化合物12,13,14的合成。
化合物12
依次将4-溴苯甲醛(3.42 g,0.02 mmol)和对甲基苯甲醛(7.2 g,0.06 mmol)加入到三口烧瓶中,随后加入丙酸200 mL,将油浴锅温度调到140℃回流。再逐滴加入吡咯(5.36 g,0.08 mmol),在140℃下继续搅拌30 min。溶液冷却至室温后,先蒸馏掉二分之一的丙酸,再加入100 mL的甲醇溶液,冷冻过夜使溶液结晶,抽滤并过过硅胶柱后,再用甲醇和三氯甲烷的混合溶液重结晶得到了紫色晶体化合物12 (2.8 g, 4.8%)。
化合物13
将化合物12 (0.74 g,1 mmol)和醋酸锌(1.85 g,10 mmol) 加入到250 mL的三口瓶中,然后加入CHCl3(150 mL)/CH3OH (10 mL)的混合溶液,加热回流4 h后。溶液冷却、水洗、干燥后旋干溶剂即得到紫红色的固体13 (0.73 g, 91%)。
化合物14
在100 mL的三口瓶中通入氮气保护,并依次加入化合物13 (0.51 g, 0.64 mmol),化合物11(12g,1.92 mmol),催化剂 Pd[P(Ph3)]4(15.5 mg,0.014 mmol),并加入DMF 50 mL。将油浴锅温度调整到100℃,保持搅拌3天。溶液冷却、萃取、干燥、旋干溶剂后,将粗产物用过硅胶柱提纯即可得到紫色固体化合物4 (0.27 g,41%)。
2 结果与讨论
2.1 染料的光物理性能研究
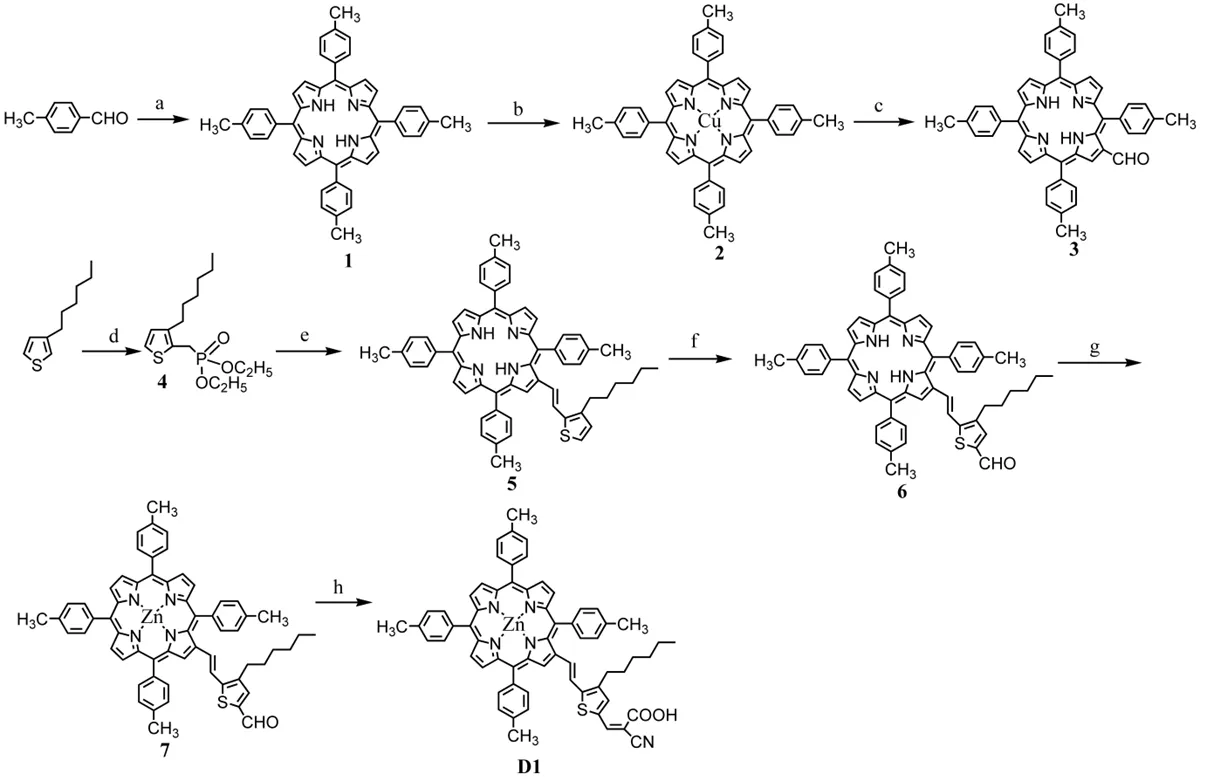
图2 染料D1的合成路线图Fig2. The route for the synthesis of D1

图3 染料D2的合成路线图Fig.3 The route for the synthesis of D2
染料的光物理性能主要通过两种方式进行,一种是染料在溶液的吸收及荧光光谱,另一种是染料在TiO2膜上的吸收及染料的荧光光谱。图4是染料D1和D2在CHCl3(10-5mol L-1)溶液中的紫外可见吸收光谱,从图中可以看出D1在433 nm处出现了一个比较强的Soret吸收带,另外还在562 nm和613 nm出现了两个中等强度的Q吸收带。而D2的Soret吸收带(445 nm)及Q 吸收带(572 nm,608nm)与D1相比都有大约10nm的红移。主要原因可能是D2卟啉的两个己基噻吩使染料的共轭能力有所增强。D1、D2的摩尔吸光系数通过计算分别是 0.96×105mol L-1cm-1和 1.14×105 mol L-1cm-1,从D2较高的摩尔吸光系数可以看出D2比D1具有更强的光俘获能力。图5是染料在TiO2膜上的UV-vis吸收光谱,从该图中可以看出,两种染料在TiO2膜上的吸收曲线与在溶液中的很相似,但是比在溶液中的加宽并红移,主要是因为卟啉染料在TiO2膜表面形成了J型聚集体[6]。本文测定了染料在TiO2膜表面的吸附量,如表1所示。从表中看出,D1的吸附量值(0.95×10-8mol cm-2)比D2 (1.52×10-8mol cm-2)低,其主要原因有一下两个方面:(1) D1染料中己基噻吩个数比D2少,导致分子间π-π相互作用强度降低;(2) 从D1分子结构可以看出,在β位引入己基噻吩的卟啉染料,由于苯环的影响,加大了空间位阻,使染料中羧基与TiO2的健合受到阻碍[7]。
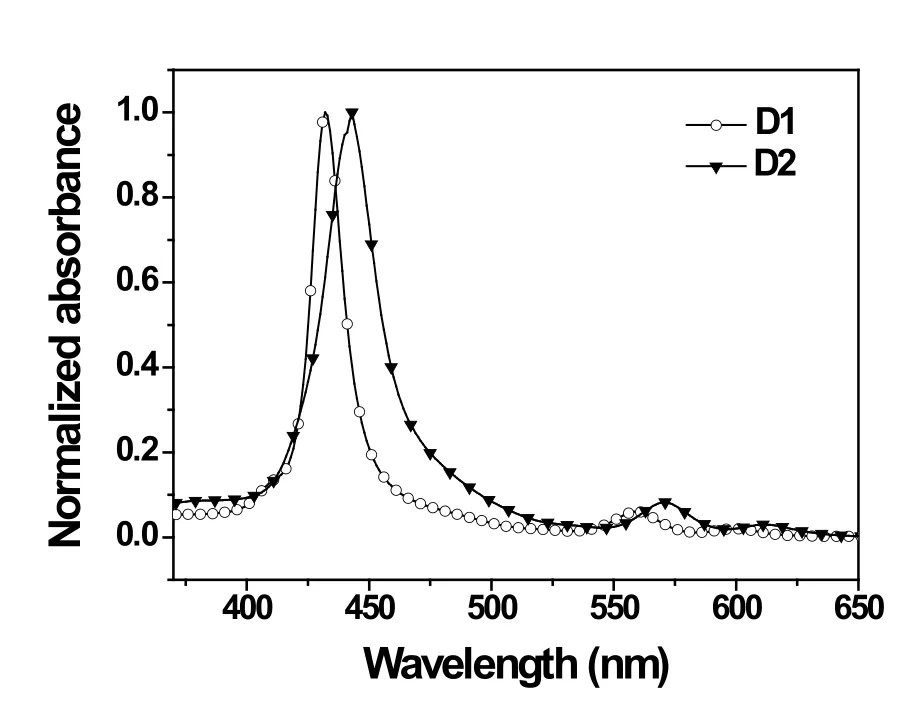
图4 染料D1和D2在三氯甲烷溶液中的紫外可见吸收光谱Fig.4 UV-visible absorption spectra of D1 and D2 in CHCl3
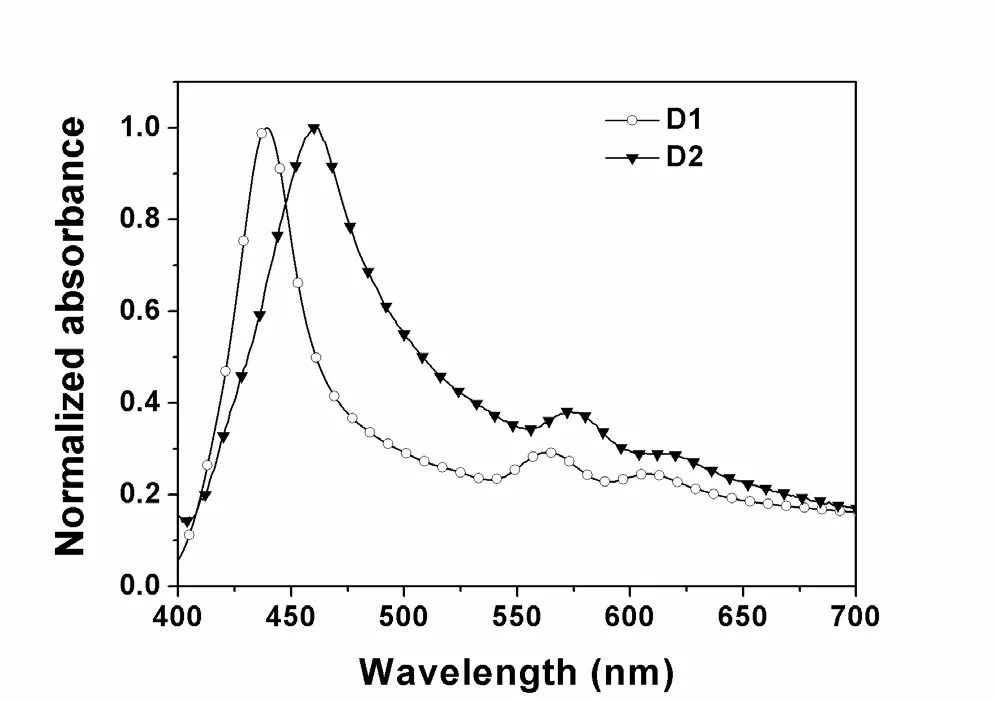
图5 染料D1和D2在TiO2膜上的紫外可见吸收光谱Fig.5 UV absorption spectra of D1 and D2 on TiO2
图6是染料D1和D2在三氯甲烷溶液中的发射光谱。D1在635nm和657nm有两个强度几乎相同的发射峰,而D2在624nm出现一个较强的发射峰,667nm出现一个稍弱的发射峰,主要原因分析可能是因为噻吩个数的增加促使噻吩段的特征发射峰增强。但是测试D1和D2在TiO2膜上的发射峰的发射光谱缺没有发现发射峰,这说明了染料的电子处于激发单线态,能很好的注入到TiO2导带中。通过归一化的紫外吸收光谱和荧光光谱,利用公式Eg=hν=hc/λint=1240/λint[8]计算得出两个染料E0-0能级分别是D1=2.15 eV,D2=2.11 eV。

图6 染料D1和D2在三氯甲烷溶液中的荧光发射光谱Fig.6 Emission spectroscopy of D1 and D2 in CHCl3
2.2 染料的电化学性能
染料的电化学性能测试方法通过文献方法得出[9]。染料D1、D2的氧化还原电势由二茂铁(Fc+/Fc)进行标定。染料的实际电势(vs.NHE)是染料与二茂铁电势之差再加上0.642 V,电化学结果如表2所示。染料D1和D2的氧化电位分别为0.893 V和0.918V,还原电位分别为-1.119V和-1.054V。通过公式(10):HOMO=-e(Eox +4.40)(eV);LUMO=-e(Ered+4.40)(eV);Egce=e(Eox-Ered)(eV)我们计算了D1和D2的HOMO-LUMO能隙分别为2.02 eV和1.98 eV,该结果与染料的光化学能级趋势一致。结合染料的光谱及电化学数据,计算出了卟啉处于单线态的激发态染料到TiO2导带的电子注入驱动能(-0.5V vs.NHE) (ΔGinj)和卟啉激发态阳离子被(I-/I3-)对还原的染料再生能(0.5V vs.NHE) (ΔGreg),通过计算可以证明两种卟啉染料的电子注入和染料再生这两个过程都是动力学可行。
2.3 染料的光伏性能分析
染料D1和D2的光伏性能测试条件如下:工作电极为含氧化镁的双层TiO2膜,对电极为Pt电极,电解质为3-methoxyproponitrile的混合溶液体系:0.05 M的 LiI,0.5 M的I2和0.5 M的4-tertbutylpyridine (TBP),将染料配成浓度为10-3mol L-1的DMF溶液,在工作电极浸泡15 min后,用模拟太阳光AM 1.5 irradiation (100 mW cm-2)照射工作电极70 min后再进行测试。经测试所得的D1和D2的J-V特征曲线如图7和表3,从图中可以看出D1和D2的光伏效率分别为η = 2.19% (Jsc= 5.42 mA cm-2, Voc= 0.65 V和FF = 0.64)和η= 3.43% (Jsc= 8.91mA cm-2, Voc= 0.62 V和FF=0.64)。根据两种染料的光伏性能参数发现Jsc数据的大小是引起效率不同的主要因素。关于短路电流的趋势一般可以通过IPCE来解释,因此我们通过测试两个染料的IPCE值对其光伏性能进行进一步分析。图8是D1和D2染料的入射光-电流转化效率图,我们可以看出形状与染料的紫外吸收光谱相似,这说明了卟啉部分是光电流产生的主要来源。从图中曲线可以看出D1和D2染料的最大IPCE数值分别是32%和43%。两种染料的IPCE趋势和对应能量转换效率趋势一致,但结果与其他文献报道的高效率的染料IPCE值相比较低,这也就可以解释两个染料电池效率较低的主要原因。根据IPCE计算公式:IPCE(λ)=LHE(λ)×Φinj×ηcoll,可以看出,染料如果要想获得较高的IPCE值,必须具有宽而强的吸收光谱。从表2可以看出,两种染料的电子注入驱动力相似,这也就排除了光电子注入效率对D1和D2效率的影响。而D2的摩尔吸光系数比D1的摩尔吸光系数高且吸收光谱比D2红移,由此可说明D2的光俘获效率比D1高。另一方面,由于D2在TiO2膜上的吸附值比D1大,这可以说明有更多的D2分子与TiO2作用,而实现提高染料的光收集能力的目的。通过以上几点可以解释D2染料的能量转化效率较大的原因。

表1 染料的紫外吸收及荧光数据Table 1 UV absorption and fluorescence data of D1 and D2

表2 染料的电化学数据Table 2 Electrochemical data of dyes
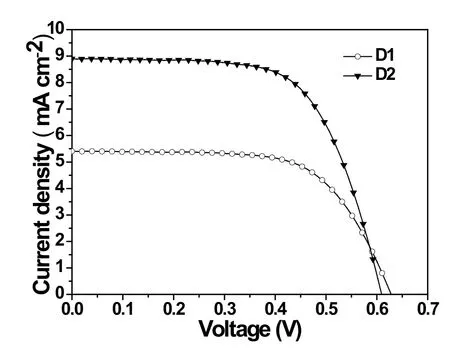
图7 染料D1和D2的电流-电压特征曲线Fig.7 The Current-Voltage characteristic curve of D1 and D2

表3 染料D1和D2的光伏数据Table 3 Photovoltaics data of D1 and D2

图8 D1和D2的染敏化的TiO2电池的入射光-电流转化效率图Fig.8 Incident Light - Current Conversion Efficiency of D1 and D2 on TiO2 film
3 结论
本文通过设计合成了两种以卟啉衍生物染料D1和D2:卟啉单元作为电子给体,以噻吩衍生物分别修饰在卟啉β位和中位作为π-共轭体系、氰基乙酸为电子受体和锚定基团。通过对两种染料在溶液中和在TiO2固体膜中的紫外可见吸收光谱的研究,发现中位引入了双己基噻吩的卟啉分子D2由于具有更长的π-共轭体系,使其光谱吸收带往长波方向移动,与D1相比,D2的摩尔吸光系数也较大,这也就说明了染料D2有更强的光获取能力。通过对染料进行电化学性质测试,结果表明D1和D2两种染料无论是电子注入还是从染料再生都是动力学可行的。通过对两种染料的光伏性能研究,得到D2的光伏效率η = 3.43% (Jsc= 8.91mA cm-2, Voc= 0.62 V和 FF = 0.64),高于D1的光伏效率η = 2.19% (Jsc= 5.42 mA cm-2, Voc= 0.65 V和 FF = 0.64)。从能量转化效率结果来看,两个卟啉分子的染料敏化太阳能电池效率与当前文献报道的卟啉衍生物的能量转化效率相比还有一定的差距,希望通过后续的研究,设计合成高能量转化效率的卟啉染料分子。

