1株秸秆降解高温菌的筛选、鉴定及堆肥应用
文亚雄, 谭石勇, 邱 尧, 刘 备, 杨丽丽, 刘 翔, 杨梅玉
(湖南泰谷生物科技股份有限公司农业生物技术研究院/农业部植物营养与生物肥料重点实验室,湖南长沙 410300)
作物秸秆是农业生产中产生的一种大量废弃物,我国是世界秸秆产量最高的国家之一,占全世界秸秆总量的30%左右[1]。我国每年产生的秸秆约有7亿t,根据其氮、磷、钾养分含量计算,相当于350多万t氮肥,800多万t钾肥,80多万t磷肥[2]。将秸秆还田是农田土壤有机质的重要来源,也可节约大量化肥的施用,然而我国秸秆还田率还不足50%,在国家明令禁止露天焚烧秸秆以前,约97%的秸秆被焚烧、堆积或者遗弃,极大地造成了资源的浪费,同时也严重污染了环境[3-4]。秸秆还田方式包括覆盖还田、粉碎还田、堆肥还田及过腹还田等[5],其中,前3种还田方式适用于大量秸秆的处理,但覆盖还田和粉碎还田属于直接还田,秸秆腐解速度慢,还易引发病虫害[6-7]。通过堆肥方式将秸秆制成有机肥还田,不但能大量处理秸秆,还能加快秸秆的腐解,提高肥效,改良土壤,培肥地力,是解决我国当前有机肥短缺的有效途径。
秸秆主要由纤维素、半纤维素和木质素构成,约占秸秆干质量的80%,其中纤维素与木质素较难被分解[8]。在秸秆细胞中,木质素、纤维素与半纤维素等交联沉积在细胞壁中,木质素还可通过多糖桥交联影响微生物降解纤维多糖。细菌因其体积小、营养吸收面大、物质交换快等特点,常被用于堆肥生产[9]。针对秸秆中纤维素含量较高。堆肥过程中堆体内部温度较高的特点,本研究通过筛选耐高温产纤维素酶的微生物,进行秸秆崩解及堆肥试验,以期筛选出简单高效的秸秆堆肥菌剂。
1 材料与方法
1.1 试验材料
1.1.1 试验样品 平菇菇渣,以木屑为主要原料,在自然堆积过程中可升温至60 ℃以上。
1.1.2 培养基 分离培养基用牛肉膏蛋白胨琼脂培养基。富集培养基:秸秆10.0 g、蛋白胨5.0 g、KH2PO42.0 g、MgSO40.5 g、蒸馏水1 000 mL。纯化培养基营养琼脂(NA)培养基。羧甲基纤维素(CMC)鉴别培养基:CMC-Na 7.5 g、(NH4)2SO42.0 g、KH2PO41.0 g、NaCl 1.0 g、MgSO40.5 g、琼脂20.0 g、蒸馏水1 000 mL、pH值自然。基础发酵培养基:葡萄糖10.0 g、蛋白胨5.0 g、KH2PO42.0 g、蒸馏水1 000 mL、pH值自然。秸秆崩解培养基:水稻秸秆10.0 g,豆粕/尿素5.0 g,KH2PO42.0 g,蒸馏水1 000 mL。
1.2 试验方法
微生物及堆肥试验于2016年在湖南浏阳农业部植物营养与生物肥料重点实验室进行。
1.2.1 菌株筛选 称取10.0 g菇渣样品置于灭菌的 90.0 mL 富集培养基中,40 ℃摇床培养振荡24 h,采用稀释涂布法于 40 ℃ 条件下分离细菌。所得菌株分别点接于CMC鉴别培养基上,40 ℃ 恒温培养。CMC鉴别培养基培养的菌株菌落出现后,倒入1.0 g/L刚果红溶液染色1 h,倒出染色液,用 1.0 mol/L 的NaCl冲洗脱色,观察菌落周围有无纤维素水解圈,并测量水解圈直径,将具有分解纤维素能力的菌株编号保存备用。
将以上保存菌株分别接种于2种不同氮源(豆粕、尿素)的秸秆崩解培养基中,35 ℃振荡培养10 d,培养完成后过滤,将固体残渣用蒸馏水冲洗,除去菌体,105 ℃烘干后称质量,以不接菌为对照,采用失质量法计算秸秆降解率[10]。
1.2.2 菌株鉴定
1.2.2.1 形态学特征及部分生理生化特性 菌株纯化后,观察菌株在纯化培养基上的菌落特征,并对细菌菌体进行革兰氏染色鉴别,通过显微镜观察菌株的形态特征,并根据《伯杰氏系统细菌手册》(第2版)研究细菌的部分生理生化特征。
1.2.2.2 16S rDNA鉴定 将纯化得到的菌株送至生工生物工程(上海)股份有限公司进行序列测定,细菌测序用通用引物16S F(5′-AGAGT TTGATCCTGGCTCAG-3′)和16S R(5′-GGTTACCTTGTTAC GACTT-3′)。将获得的细菌DNA序列分别输入到EzBioCloud中,用Identify程序与数据库中的所有序列进行比较分析。并利用MEGA5.0软件构建系统发育树。
1.2.3 发酵培养基初步优化
1.2.3.1 菌株生长曲线测定 将活化菌株以2%的接种量分别接入装有50 mL灭菌基础发酵培养基的250 mL锥形瓶中,于35 ℃,160 r/min条件下摇瓶发酵,发酵培养期间每隔 2 h 取发酵液样品,测定其吸光度(D600 nm)。换算倍数后以其代表发酵液菌体浓度,并以发酵时间及菌体浓度绘制菌株生长曲线。
1.2.3.2 不同碳源对发酵液菌体浓度的影响 分别以 10.0 g/L 糊精、甘露醇、淀粉、葡萄糖、乳糖、蔗糖替代基础发酵培养基中的碳源进行发酵试验,于摇床35 ℃,160 r/min摇瓶中发酵20 h,测定发酵液吸光度(D600 nm),比较不同碳源对发酵液菌体浓度的影响。
1.2.3.3 不同氮源对发酵液菌体浓度的影响 分别以 5.0 g/L 硝酸钠、蛋白胨、酵母膏、牛肉膏、硝酸铵、硫酸铵、尿素替代基础发酵培养基中的氮源,以上述筛选的最佳碳源及浓度代替基础发酵培养基中的碳源进行发酵试验,于35 ℃,160 r/min 条件下摇瓶发酵20 h,测定发酵液吸光度(D600 nm),比较不同氮源对发酵液菌体浓度的影响。
1.2.3.4 不同无机盐对发酵液菌体浓度的影响 分别以 2.0 g/L 磷酸氢二钾、磷酸二氢钾、磷酸二氢钠、磷酸氢二钠、氯化钠、硫酸镁替代基础发酵培养基中的无机盐,以上述筛选的最佳碳、氮源及浓度代替基础发酵培养基中的碳、氮源进行发酵试验,于35 ℃,160 r/min条件下摇瓶发酵20 h,测定发酵液吸光度(D600 nm),比较不同无机盐对发酵液菌体浓度的影响。
1.2.3.5 不同无机盐浓度对发酵液菌体浓度的影响 分别以1.0、1.5、2.0、2.5、3.0 g/L磷酸二氢钾替代基础发酵培养基中的无机盐,以上述筛选的最佳碳、氮源及浓度代替基础发酵培养基中的碳、氮源进行发酵试验,于35 ℃,160 r/min条件下摇瓶发酵20 h,测定发酵液吸光度(D600 nm),确定合适的磷酸二氢钾质量浓度。
1.2.3.6 不同碳氮比对发酵液菌体浓度的影响 分别以 10.0 g/L 淀粉,2.5、5.0、7.5、10.0、12.5、15.0、17.5 g/L酵母膏及上述筛选得到的最佳无机盐及浓度替代基础发酵培养基中的各对应组分,35 ℃,160 r/min摇瓶发酵20 h,测定发酵液吸光度(D600 nm),比较不同碳氮比对发酵液菌体浓度的影响。
1.2.3.7 最佳碳氮比下不同浓度碳氮源对发酵液菌体浓度的影响 将淀粉、酵母膏分别以(1)5.0、6.25 g/L;(2)10.0、12.5 g/L;(3)20.0、25.0 g/L;(4)30.0、37.5 g/L;(5)40.0、50.0 g/L;(6)50.0、62.5 g/L的浓度添加,无机盐为上述筛选得到的最佳无机盐及浓度,于35 ℃,160 r/min条件下摇瓶发酵20 h,测定发酵液吸光度(D600 nm),确定各碳氮比下碳氮源的质量浓度。
1.2.4 秸秆堆肥验证 堆肥炎症试验设置为处理1:玉米秸秆38.0 kg、菜粕2.0 kg、试验菌剂;处理2:玉米秸秆38.0 kg、菜粕1.0 kg、尿素1.0 kg、试验菌剂;CK:玉米秸秆38.0 kg、菜粕2.0 kg、市售EM菌剂。
堆肥菌剂:试验菌剂为筛选得到细菌的发酵液,接种量以干物质计,细菌为2.5×1011CFU/kg;市售EM菌剂由沧州旺发生物技术研究所有限公司提供,接种量为2.4×1011CFU/kg。
将各物料及菌剂加水混匀,初始水分含量为60%。堆肥开始后,每天测定堆内温度,定期翻堆,堆肥结束后测定各堆肥样品的有机质含量,另各取10.0 g堆肥样品,加水至 50.0 mL,振荡1 h过滤,取滤液进行油菜种子发芽率试验,以蒸馏水为对照,测定种子发芽率及发芽指数(GI)[11]。
2 结果与分析
2.1 菌种筛选
以CMC鉴别培养基从菇渣中分离到3株高温产纤维素酶的细菌,将菌株分别接种于2种不同氮源的秸秆崩解培养基,35 ℃恒温培养48 h,测量细菌,水解圈大小(水解圈直径-菌落直径,D-d)。从表1可以看出,3株细菌均具有不同程度的纤维素酶活性,可见明显的水解圈,其中以G2水解圈最大。由图1可知,3株细菌均对秸秆具有不同程度的降解效果,以豆粕为氮源的秸秆崩解效果优于以尿素为氮源的处理,其中G2以豆粕为氮源的秸秆降解率最高,达14.59%。

表1 不同菌株水解圈大小

2.2 菌株鉴定
2.2.1 菌株形态学和相关生理生化特性 菌株G2在纯化培养基平板上的菌落中间有凸起,白色,表面褶皱不规则,革兰氏染色呈阳性。菌株G2相关生理生化特性见表2。

表2 G2相关生理生化特征
注:“+”“-”分别表示反应阳性、反应阴性;V-P表示乙酰甲基甲醇试验;MR表示甲基红试验。
2.2.2 DNA鉴定 以细菌菌株G2基因组DNA为模板,利用细菌16S rDNA基因通用引物进行PCR扩增,成功扩增出长约1.3 kb的DNA片段,将细菌测序结果输入到Ezbiocloud中进行Identify比对分析,从比对结果中选取同源性较高的菌株,用MEGA 5.0构建系统发育树,结果(图2)表明,G2与芽孢杆菌属(Bacillus)的多个菌株具有同源性,其中与BacillussiamensisKCTC 13613的遗传距离最近,同源性达99%。
2.3 发酵培养基初步优化
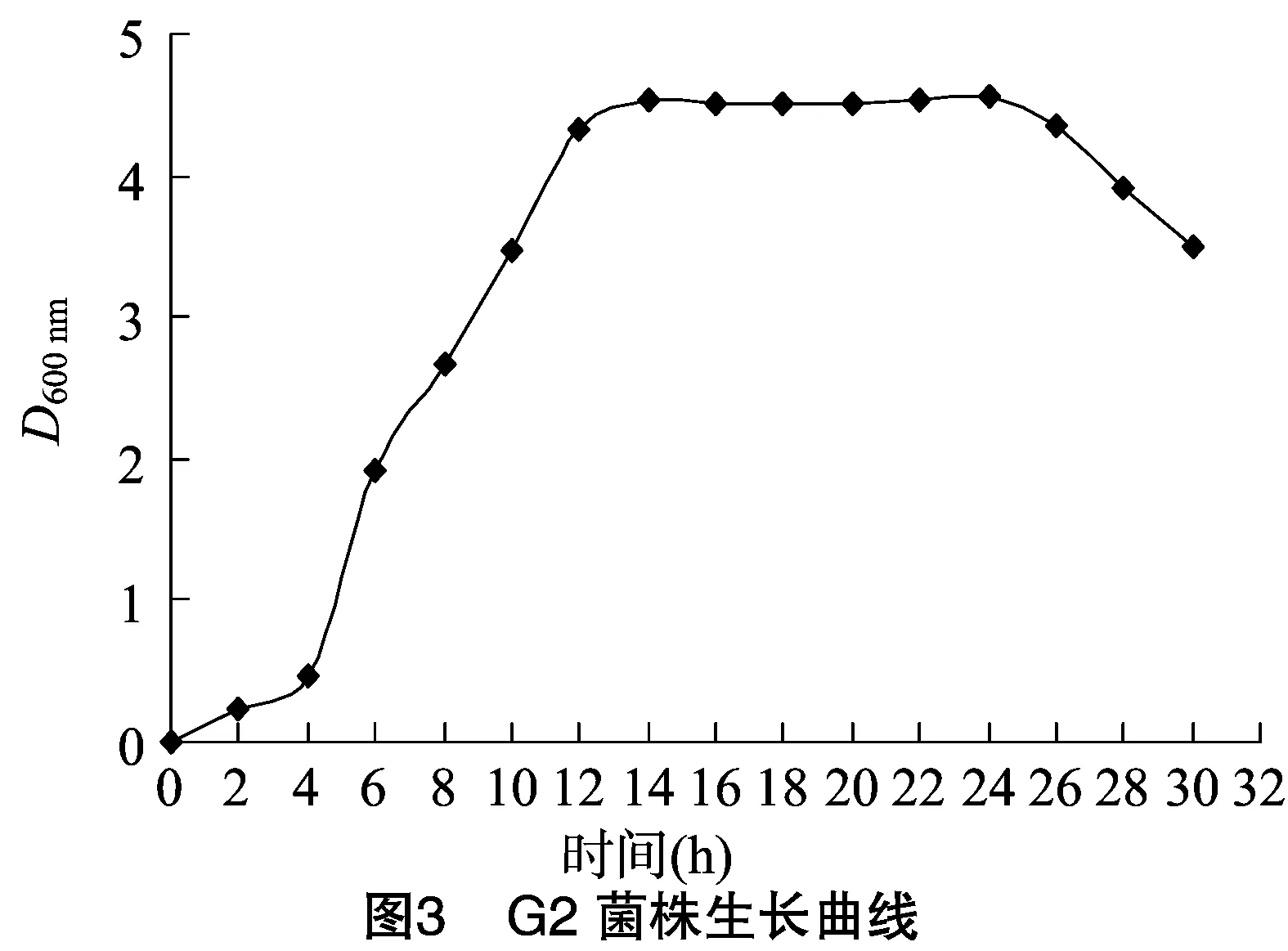
2.3.1 菌株生长曲线测定 从图3可以看出,0~4 h为G2的生长停滞期;4 h以后进入对数生长期,菌体数量增长快速;14 h 后进入稳定期,菌体浓度稳定,变化小;24 h 后进入衰亡期,菌体浓度开始下降。由此可知,种子液发酵时间可选择为12~14 h,该时期细菌生长旺盛,且菌体浓度较高;而测定最高菌体浓度可选择发酵时间为16~24h,该时期菌体浓度最高且稳定。

2.3.2 不同碳源对G2发酵液菌体浓度的影响 从图4可以看出,在糊精、甘露醇、淀粉、葡萄糖、乳糖、蔗糖6种碳源中,以淀粉作碳源时,G2菌体浓度最高,因此选择淀粉作为发酵培养基的碳源。
2.3.3 不同氮源对G2发酵液菌体浓度的影响 从图5可以看出,有机氮源处理G2的菌体浓度明显高于无机氮源,其中以酵母膏作氮源时,G2菌体浓度最高,因此选择酵母膏作为发酵培养基的氮源。


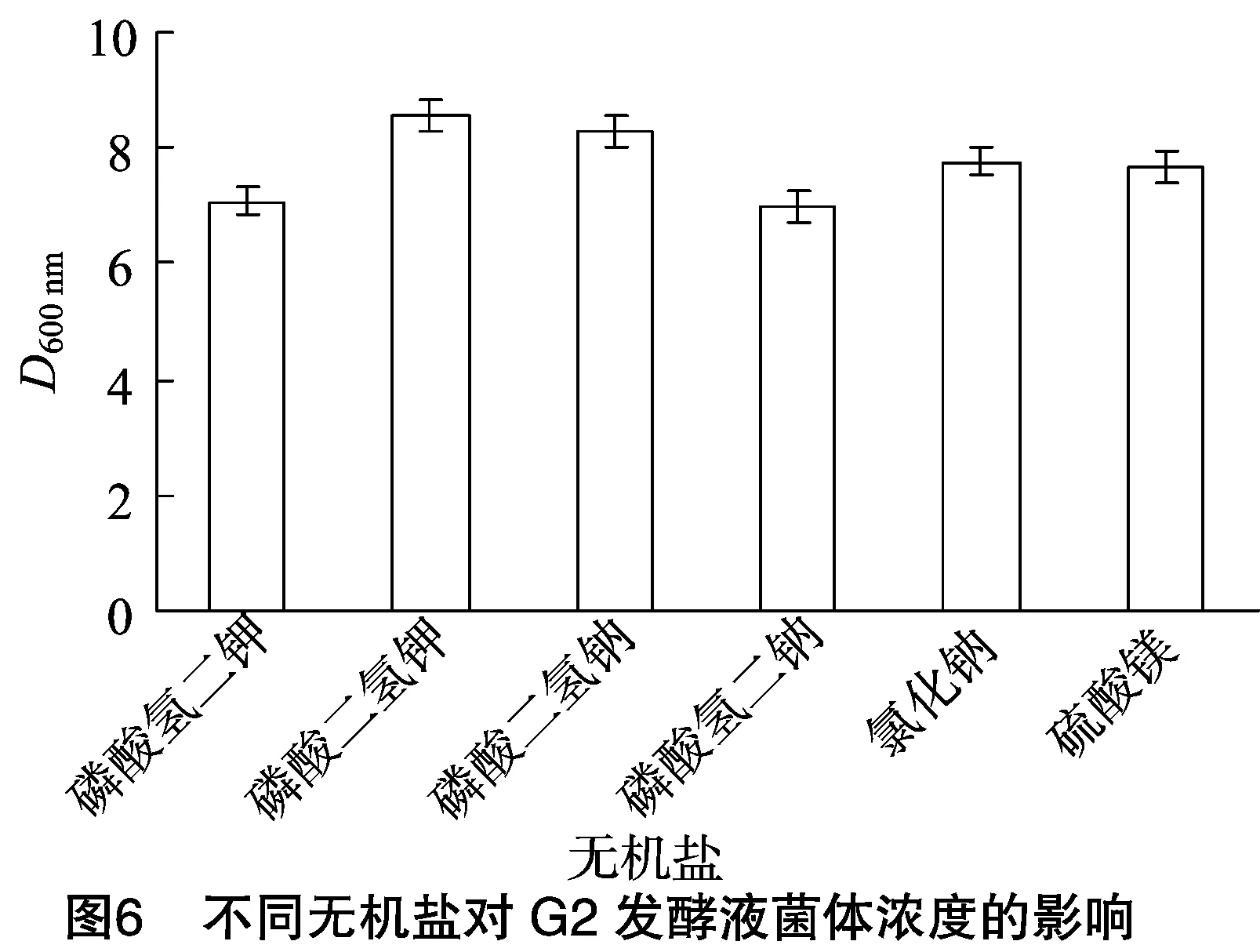
2.3.4 不同无机盐对G2发酵液菌体浓度的影响 从图6可以看出,不同无机盐对G2菌体浓度的影响差异较小,其中以磷酸二氢钾作无机盐时,细菌G2菌体浓度最高,因此选择磷酸二氢钾作为发酵培养基的无机盐。
2.3.5 不同无机盐浓度对G2发酵液菌体浓度的影响 从图7可以看出,磷酸二氢钾浓度为1.0 g/L时,G2菌体浓度最高,而随着磷酸二氢钾添加量的提高,菌体浓度逐渐降低,因此磷酸二氢钾浓度的最佳为1.0 g/L。

2.3.6 不同碳氮比对G2发酵液菌体浓度的影响 从图8可以看出,随着碳氮比的降低,G2菌体浓度呈先上升后下降的趋势,当碳源、氮源浓度分别为10.0、12.5 g/L时,G2菌体浓度最高,因此选择该比例作为发酵培养基的碳氮比。
2.3.7 最佳碳氮比下不同浓度碳、氮源对G2发酵液菌体浓度的影响 从图9可以看出,随着碳、氮源浓度的增大,G2菌体浓度呈先上升后下降的趋势,当碳源、氮源浓度分别为30.0、37.5 g/L时,G2菌体浓度最高D600 nm=10.395,较基础发酵培养基发酵浓度(D600 nm=4.77)提高了117.92%,因此选择该比例作为发酵培养基的碳、氮源浓度。由此得出,初步优化的G2发酵培养基为可溶性淀粉 30.0 g/L,酵母膏 37.5 g/L,磷酸二氢钾1.0 g/L。


2.4 秸秆堆肥验证试验
选取降解秸秆效果最佳的G2进行不同秸秆堆肥试验,测定堆内温度、有机质含量及腐熟后种子发芽率。
2.4.1 温度 好氧堆肥过程一般可分为升温期、高温期、降温期3个时期。从图10可以看出,不同试验处理堆内温度表现出上升、平稳、下降的趋势,试验处理在1 d内均达到了 50 ℃ 及以上,第2天不同处理均达到了60 ℃以上,60 ℃以上温度持续时间均达到5 d及以上,符合堆肥无害化处理的标准。处理1、处理2第1天温度分别达到56、50 ℃,分别较对照处理高14、8 ℃;处理1最高温度达68 ℃,较其他2处理高3 ℃,高温持续时间也较其他处理长1 d。处理1与对照处理堆肥物料相同,而堆肥菌剂不同,说明试验菌剂较该市售菌剂更适用于玉米秸秆堆肥;处理1与处理2所用氮源不同,说明有机氮源更适合于微生物生长,这也进一步验证了秸秆崩解试验的结论。
2.4.2 理化指标 从表3可以看出,不同处理的有机质含量均有减少,说明堆肥原料中的部分有机质被微生物分解,其中,处理1堆肥结束后有机质含量最低,说明试验菌剂对玉米秸秆的降解能力优于市售菌剂,但使用无机氮源时效果稍差。GI常用于评价堆肥腐熟度,能直接反应堆肥的腐熟状态,当GI指数达到80%~85%时,表明堆肥对植物没有毒性,已经腐熟[12-13]。从表4可以看出,处理1的GI指数已大大高出腐熟标准,说明腐熟秸秆已完全腐熟,且对植物没有毒性[14],此外试验处理的种子平均根长平均值大于对照处理,说明该腐熟秸秆的浸提液可促进植物的生长。
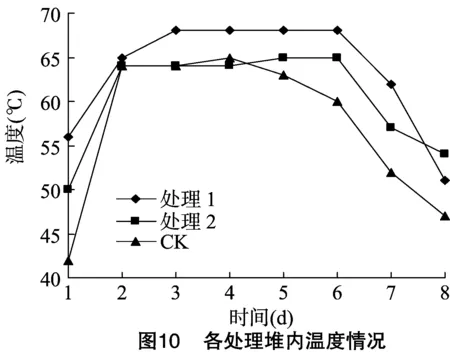

表3 不同处理有机质含量

表4 种子发芽率及GI指数
3 讨论
秸秆的资源化利用已成为国家提出的“一控、两减、三基本”目标之一,秸秆堆肥是秸秆资源化利用的重要方法,将越来越受到重视。目前,针对农作物秸秆堆肥的研究主要集中在工艺优化和筛选降解秸秆的高温菌等方面[15],尤以产木质纤维素酶高温菌的筛选多见报道。高温菌在堆肥过程中代谢快、活性高、酶的热稳定性高,可有效提高堆肥效率[16-17]。秸秆的主要成分包括纤维素、半纤维素及木质素,该类物质较难降解,筛选产相关酶系的微生物可有效分解秸秆中的难降解成分,加快堆肥的腐熟,因此,筛选该类高温菌一般以酶活性为筛选条件。但由于酶活性的测定方法、条件以及酶活性单位的定义等比较多样化,因此不同报道中的菌株酶活性参考性不大,而酶活性的测定误差也较难控制,且对多菌复合的情况并不适用,不能很好反应菌株对秸秆降解的作用能力。失质量法是将微生物接入以秸秆为碳源的培养基中培养,培养后计算秸秆的质量损失,得出秸秆的降解率。该方法简单直接,可以直观反映出微生物对秸秆的降解能力,并适用于多菌复合以及复合菌群的筛选,在工业生产上,可将失质量法得出的结果直接用于小试生产,可节约成本及时间。
发酵条件优化试验常用的设计方法有正交试验设计法、响应面设计法等,一般是由单因素试验确定试验因素与水平,后经多因素设计试验得出多因素试验条件下的最优组合。而常规的单因素试验确定的碳、氮源浓度,并未考虑C/N的问题,确定最佳C、N浓度只是在基础培养基的基础上进行的,确定碳源氮源浓度的试验中C/N各不相同,所得结果可能不是最优浓度。如本试验结果,以最佳C/N进行浓度试验,相同C/N不同浓度的C、N存有优化空间,所得结果应为最佳浓度。如本试验不进行该项试验,则单因素优化的结果为C、N最佳浓度为10 g/L左右,与最佳结果相差较大,如进行正交优化,则须进行多次试验或不能得出最佳结果。本试验只对发酵培养基进行了初步优化,若要进行工业化生产,则应进一步对发酵条件等进行深入研究。

