桥脑梗死高分辨率磁共振基底动脉管壁成像研究
王 诺, 朱 宣, 张 萍, 陈 蕾, 张敏敏, 邓本强, 吴 涛
桥脑梗死是椎基底动脉系统最常见的脑梗死,主要机制是基底动脉主干发出的穿支动脉闭塞所致,常见病因有:(1)穿支动脉本身的透明样变性,即腔隙性脑梗死;(2) 发出穿支动脉的主干动脉狭窄或闭塞导致穿支动脉供血区低灌注;(3) 心源性栓塞;(4)穿支动脉入口处发生动脉粥样硬化所致的狭窄或者闭塞,称分支动脉粥样硬化病(branch atheromatous disease,BAD)[1]。脑桥梗死按照部位可以分成脑桥旁中央梗死(paramedian pontine infarction,PPI)和脑桥深部梗死(small deep pontine infarction SDPI),目前认为前者机制为动脉粥样硬化穿支闭塞,后者为小血管透明变性累及穿支动脉[2]。尽管两种类型的脑桥梗死临床症状相似,但潜在的发病机制不同,因此,治疗方法存在一定差异。传统脑血管成像技术如CTA、MRA或DSA仅反映血管狭窄程度,不能显示动脉壁及动脉粥样硬化斑块的形态及结构特征,难以全面评估动脉血管病变和粥样硬化性质和程度。高分辨率磁共振成像(high-resolution magnetic resonance imaging,HR-MRI)可以弥补这一缺陷,HR-MRI能够显示动脉粥样硬化斑块的成分、斑块形态和结构特征以及动脉管壁变化,可以全面地评估斑块稳定性。大的斑块脂质核心、斑块内出血、薄/破裂纤维帽、斑块明显强化是斑块不稳定的表现,有助于明确缺血性卒中发生的机制[3~6]。目前,对基底动脉管壁成像在不同类型桥脑梗死时基底动脉粥样硬化的差异研究较少。本研究利用HR-MRI管壁成像研究PPI和SDPI孤立性桥脑梗死患者的基底动脉粥样硬化情况,探讨桥脑梗死的病因,为临床治疗方案的选择提供影像学基础。
1 资料和方法
1.1 病例选择 纳入2014年6月~2017年6月期间第二军医大学长海医院脑血管病中心收治的发病7 d内、经磁共振弥散加权成像(DWI)证实存在孤立的急性桥脑梗死,并且,行颅内基底动脉和椎动脉管壁成像患者。排除颈部CTA或MRA检查显示颅外椎动脉狭窄(≥50%);排除心源性脑栓塞和栓子来源为椎动脉及其他原因,如血液系统疾病、烟雾病、夹层动脉瘤等。患者均签署书面知情同意书。
1.2 临床资料 采集人口学特征和血管危险因素包括年龄、性别、血管危险因素(高血压、糖尿病、血脂异常、冠心病、吸烟、卒中及短暂性脑缺血发作史);入院时美国国立卫生研究院卒中量表(NIHSS)评分;实验室检查指标包括血常规、空腹血糖、总胆固醇、三酰甘油、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、肝肾功和同型半胱氨酸等;必要时检查免疫自身抗体,所有患者均行头部和颈部MRA或CTA检查。心脏评估指标包括常规心电图、动态心电图、心脏彩超。
根据磁共振DWI上病灶分布将患者分为两组[2]:PPI组:桥脑梗死病灶靠近中线并达桥脑表面;SDPI组:桥脑靠近中线的深部梗死未及桥脑表面。
1.3 HR-MRI检查及参数 所有基底动脉和椎动脉颅内段管壁成像均在3.0T MRI检查系统进行(HDX platform,GE Healthcare,Milwaukee),采用标准8通道头部线圈。定位线平行于枕骨大孔前后缘连线,矩阵320×320。首先采用三维时间飞跃法MR血管成像(3D TOF-MRA)法,进行血管重建后明确病变血管部位,然后采用“黑血”法进行基底动脉和椎动脉颅内段多序列扫描,具体参数如下:快速自旋回波T1加权成像(T1WI-FSE) TR 567/TE 15.8、快速自旋回波T2加权成像(T2WI-FSE) TR 2 883/TE 49、T1加权增强成像(T1WI+C) TR 567/TE 15.8 ms,FOV 100 mm×100 mm,层厚2 mm,间距2.5 mm。3D T1SPACE序列TR900/TE 5.6 ms,层厚0.5 mm,矩阵320×320。增强采用钆喷酸葡胺 (Gd-DTPA)作为增强剂,静脉注射Gd-DTPA 5 min后进行扫描,扫描参数同3D T1SPACE。整个序列扫描完成时间约30~40 min。以往我院磁共振研究显示“黑血”法T2WI-FSE管壁与管腔有较高对比度,管壁和斑块面积定量分析在T2WI序列进行。
1.4 影像分析 3D-TOF MRA成像上选择基底动脉和椎动脉颅内段血管最狭窄,并选择远端正常动脉作为参考。依据WASID法计算狭窄率,狭窄程度大于50%定义为动脉粥样硬化性狭窄。在T2WI序列判断斑块的形态和部位,T2WI上明显偏心或局灶管壁增厚,最厚处超过最薄处50%,定义为斑块[6]。环形斑块定义为斑块沿管壁360°生长,斑块处管壁最薄部分至少为最厚处的50%;弧形斑块定义为斑块偏心生长,最薄管壁部分小于最厚处的50%[6]。以同序列正常脑组织信号作为参考分析斑块的信号特征,将基底动脉斑块分为等信号、高信号、低信号和混杂信号四种类型。注射增强剂前后对比,斑块在T1WI系列信号强度提高超过20%,称为有强化。本研究评价项目包括病变基底动脉管腔狭窄程度,斑块的形态及T2WI和T1WI序列上斑块的信号性质,T1WI序列增强扫描后斑块是否强化和强化程度。
1.5 统计学处理 使用SPSS 17.0软件进行统计分析。对分类变量,采用χ2检验或Fisher精确检验比较组间差异;对连续变量,采用t检验或秩和检验比较组间差异。检验水准(α)为0.05。
2 结 果
2.1 临床资料 入组患者共55例,其中PPI组37例,SDPI组18例。两组患者中,性别、年龄、高血压、血脂异常、吸烟、TIA或卒中史等经统计学分析无显著差异(P>0.05),但PPI组患者糖尿病患病率明显高于SDPI组(64.9% vs 33.3%),具有统计学意义(P=0.043)。两组患者NIHSS评分差异无统计学意义(P=0.479)。统计学分析显示两组患者总胆固醇、甘油三酯、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇无显著差异(P>0.05),PPI组患者入院时空腹血糖明显高于SDPI组,差异具有统计学意义(P=0.026)(见表1)。
表1 PPI和SDPI组患者人口学特征、血管危险因素和血检验结果比较
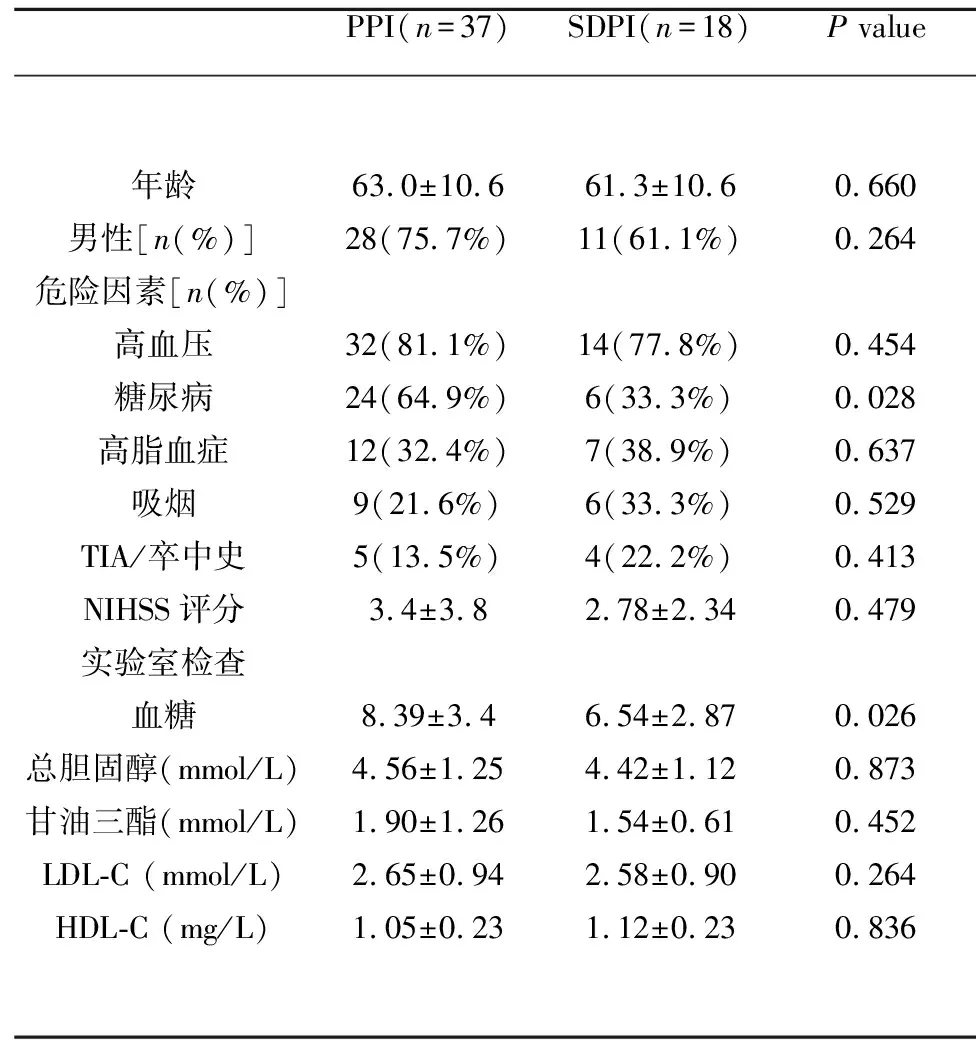
PPI(n=37)SDPI(n=18)P value年龄男性[n(%)]危险因素[n(%)]高血压糖尿病高脂血症吸烟TIA/卒中史NIHSS评分实验室检查血糖总胆固醇(mmol/L)甘油三酯(mmol/L)LDL-C (mmol/L)HDL-C (mg/L)63.0±10.628(75.7%)32(81.1%)24(64.9%)12(32.4%)9(21.6%)5(13.5%)3.4±3.88.39±3.44.56±1.251.90±1.262.65±0.941.05±0.2361.3±10.611(61.1%)14(77.8%)6(33.3%)7(38.9%)6(33.3%)4(22.2%)2.78±2.346.54±2.874.42±1.121.54±0.612.58±0.901.12±0.230.6600.2640.4540.0280.6370.5290.4130.4790.0260.8730.4520.2640.836
PPI:桥脑旁中央梗死,SDPI桥脑深部小梗死;NIHSS:National Institute of Health Stroke Scale;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇
2.2 HR-MRI管壁成像特征 HR-MRI检查PPI组患者35例(94.6%)、SDPI组10例(55.6%)检测到基底动脉存在斑块,PPI组明显高于SDPI组(P=0.001)。3D TOF MRA显示PPI组和SDPI组基底动脉狭窄50%以上患者分别为58.8%和38.9%,统计分析显示两组无明显差异(P=0.214,见表2)。HR-MRI进行基底动脉斑块检测,PPI患者基底动脉斑块以弧形斑块(71.4%)多见,SDPI患者为弧形或环形斑块,见表3。PPI和SDPI患者斑块在T1WI、T2WI系列上斑块信号差异无统计学意义(P>0.05)。PPI和SDPI患者斑块内出血发生率分别为4例(11.4%)和1例(10.0%),PPI和SDPI患者Gd-DTPA增强后斑块明显强化分别30例(85.7%)和8例(80.0%),统计学分析均无显著差异(P>0.05)(见表3)。
PPI组16例基底动脉狭窄小于50%,其中14例(87.5%)可见基底动脉斑块形成,为分支动脉粥样硬化病(BAD),明显高于SDPI组(27.3%),两组差异具有统计学意义(P=0.001),BAD分别占PPI和SDPI中37.8%和16.7%,斑块均以弧形斑块为主。PPI组BAD中92.3%斑块强化,明显高于SDPI组(33.3%),两组差异具有统计学意义(P=0.014)(见表4)。BAD不稳定斑块分别占PPI组和SDPI组中35.1%和5.6%,两组比较具有统计学意义(P=0.018)(见表2)。

表2 PPI和SDPI组间基底动脉管壁成像特征比较

表3 PPI和SDPI组间基底动脉斑块特征比较
表4 PPI和SDPI组间基底动脉狭窄小于50%管壁成像特征比较

PPI(n=16)SDPI(n=11)P value斑块弧形环形斑块强化无轻度明显14(87.5%)13(92.9%)1(7.1%)1(7.1%)013(92.9%)3(27.3%)3(100%)01(33.3%)1(33.3%)1(33.3%)0.0010.6330.028
3 讨 论
本研究应用HR-MRI研究不同类型桥脑梗死患者的基底动脉管壁变化,探讨桥脑梗死的病因。研究显示基底动脉大动脉粥样硬化和分支动脉粥样硬化病(BAD)是PPI的原因,而大动脉粥样硬化和小动脉透明变性是SDPI的主要病因。在PPI和SDPI患者大动脉粥样硬化病变分别占57.8%和38.9%。而BAD在PPI患者中明显高于SDPI患者(35.1%和5.6%),两种类型桥脑梗死危险因素中,PPI患者糖尿病患病率和空腹血糖水平明显高于SDPI患者,结果提示不同类型桥脑梗死在病因学有所不同。
桥脑旁中央梗死主要指基底动脉旁中央支供血区的梗死,占后循环梗死的29.3%,脑桥梗死的60%[7],发病机制主要与基底动脉的主干发出的穿支动脉起始处动脉粥样硬化引起的狭窄或闭塞有关。Fisher和Caplan在病理尸检中发现穿支动脉疾病导致PPI大多数是基底动脉粥样硬化引起,首次提出分支动脉粥样硬化病(BAD)[8]。目前桥脑旁中央动脉供血区BAD常用日本高木诚等提出的诊断标准[9]:梗死灶在轴位头部MRI影像上表现为由脑桥深部延伸至脑桥腹侧表面,无基底动脉高度狭窄(50%以上)或闭塞,无心源性栓子来源。以往临床研究是借助桥脑梗死范围的影像学特征来诊断,即梗死灶由脑桥深部延伸至脑桥腹侧表面。近年来,由于神经血管影像学的进展,临床研究通过HR-MRI管壁成像可以直接观察到穿支动脉入口处动脉粥样硬化。国内学者研究显示HR-MRI可以清晰显示基底动脉管壁结构,93.5%PPI患者有基底动脉的斑块形成,为环形或弧形斑块,都位于桥脑旁正中梗死责任血管穿支动脉的开口附近[10]。Isabelle研究发现65%患者基底动脉血管造影正常,但77%患者HR-MRI上存在动脉粥样硬化[2]。病理研究也证实基底动脉粥样硬化可以闭塞穿支动脉开口,导致PPI[11]。本研究发现PPI患者MRA显示58.8%的患者存在基底动脉狭窄≥50%,诊断为大动脉粥样硬化型。而16例基底动脉狭窄小于50%中,大部分患者(87.5%)HR-MRI管壁成像发现基底动脉有斑块,且斑块明显强化,提示斑块不稳定,结果证明大动脉粥样硬化和BAD不稳定斑块是PPI的原因。
传统观念认为SDPI主要病因是累及穿支动脉的透明变性,导致桥脑深部小梗死,但是,大动脉病变也是SDPI的病因。HR-MRI基底动脉管壁成像研究发现SDPI患者中54%存在基底动脉管腔狭窄,73%检测到基底动脉斑块[2]。本研究也显示38.9%的SDPI患者有基底动脉中度以上狭窄(≥50%),8例(44.4%)基底动脉管壁正常,3例(16.7%)存在斑块,仅1例(5.6%)斑块明显强化,为不稳定斑块。本研究提示大动脉粥样硬化是SDPI的常见病因,但是,BAD在SDPI中少见。
综上所述,HR-MRI管壁成像技术研究结果显示,大动脉粥样硬化和分支动脉粥样硬化是PPI的病因。大动脉粥样硬化也是SDPI的常见原因,但是,分支动脉粥样硬化在SDPI中少见。

