PI3K/Akt和Wnt/β-catenin信号通路在大鼠脑缺血再灌注损伤中的相互作用
邱 月, 邢雪松, 吕威力
血管性痴呆(Vascluar Dementia,VD)是由脑缺血、出血或急慢性缺氧性脑血管病等脑血管疾病引起的有记忆及认知功能障碍为表现的临床综合征,是临床上老年期痴呆的一种常见类型,其患病率仅次于阿尔茨海默病,是第二大老年期痴呆病。当前,血管性痴呆的病因多种多样,发病机制也尚不明确,但是围绕着血管性痴呆的脑血管危险因素的相关因素越来越多,血管性痴呆是当前唯一可预防性的痴呆类型,所以明确其危险因素对于疾病的早期预防有重要意义。磷脂酰肌醇-3-激酶/蛋白激酶B (phosphoinositide 3 kinase/Akt,PI3K/Akt)信号转导通路广泛存在于各种细胞中,是参与细胞存活、增殖和分化调节的信号转导通路。GSK-3β既是PI3K/Akt信号通路下游的分子,同时它又是Wnt信号通路对β-catenin调控的关键因子[1~4]。GSK-3β是一种丝氨酸/苏氨酸激酶,通过对磷酸化细胞内多种蛋白,广泛参与细胞基本调节功能,比如细胞周期、细胞骨架和基因表达的稳定等[5,6]。为了更加深入的研究Akt/GSK-3β在脑缺血再灌注损伤发生机制中的调控作用,本实验采用bFGF和LY294002体内注射,观察激活和抑制PI3K/Akt通路对其下游分子的影响,并通过测定细胞内GSK-3β的含量,探讨Akt对GSK-3β的调控作用,目的在于进一步阐述PI3K/Akt和Wnt/β-catenin信号通路在缺血性脑损伤中的协同作用机制。
1 材料和方法
1.1 化学试剂 LY294002,兔抗大鼠p-Akt多克隆抗体(美国Cell Signaling公司),HRP-标记的羊抗兔抗体IgG(北京中杉公司),原位末端标记细胞凋亡TUNEL试剂盒(天津灏洋公司,Roche分装)。LY294002溶于DMSO,用生理盐水将DMSO浓度稀释为总体积的0.02%。其它未提到的试剂购买于Sigma公司。
1.2 实验动物 级健康雄性SD大鼠78只,10~12 w龄,体重在280~320 g。购于沈阳医学院实验动物中心,动物质量合格证号(SCXK(辽)2003-0016)。建立局灶性脑缺血再灌注SD大鼠模型,将实验大鼠随机分为4组:假手术组(S组)、脑缺血再灌注组(I/R组)、脑缺血再灌注+bFGF后处理组(bFGF组)、脑缺血再灌注+bFGF后处理+LY294002(LY组),每组各24只大鼠。依据缺血后再灌注时间点12 h、24 h、48 h、72 h,将每组大鼠再分成4个亚组。
1.3 动物模型 依照Longa改良法建立局灶脑缺血再灌注SD大鼠模型。腹腔注射10%水合氯醛350 mg/kg进行麻醉,取仰卧位,颈正中切口约3 cm,逐层分离颈前组织,依次暴露右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA),并结扎右侧颈总、颈外动脉,用酒精灯将4-0尼龙线烧成圆头,在颈总动脉分叉处上方约2 mm处将其插入颈内动脉,直至感觉有轻微阻力处为大脑中动脉入口,线拴进入深度约为18~20 mm。假手术组线栓进入约为10 mm。阻塞2 h后,抽出尼龙线开始再灌注。术后大鼠出现左侧以前肢为重的偏瘫提示造模成功。缺血后30 min给予bFGF处理,从右侧侧脑室注射含bFGF1.2 μg生理盐水10 μl。S组和I/R组于相同时间点向右侧侧脑室注射等体积的生理盐水;LY组于再灌注前15 min按照0.3 mg/kg将LY294002经股静脉注入大鼠体内。各组大鼠分别于再灌注12 h、24 h、48 h、72 h再次麻醉,用4%多聚甲醛进行心脏灌注,固定后取脑,制备石蜡切片厚约4 μm,进行HE染色观察大脑皮质组织学形态。
1.4 TUNEL原位检测细胞凋亡 石蜡切片二甲苯脱蜡,酒精梯度水化,以3%过氧化氢30 ℃避光处理10 min,微波抗原修复3 min,加TUNEL反应液,37 ℃孵育1 h,加转化剂-PO,37 ℃孵育30 min,DAB显色约3 min。
1.5 免疫组织化学染色 石蜡切片脱蜡水化,3%过氧化氢室温避光孵育10 min,抗原修复(微波修复)3 min,正常山羊血清封闭,室温下孵育20 min,滴加一抗(p-Akt,稀释1∶200)4℃孵育过夜。生物素化二抗工作液处理,37 ℃孵育30 min。滴加辣根酶标记链霉卵白素工作液,37 ℃孵育30 min,DAB显色约3 min。苏木素复染,分化返蓝,中性树胶封片。
1.6 原位杂交法测定GSK-3β mRNA的表达 采用多相寡核苷酸探针,地高辛标记。针对大鼠GSK-3β寡核苷酸探针序列:5’-CTCCT CGGAC CAGCT GCTTT GCACT TCCAA-3’。切片经新鲜配制的0.5%H2O2/甲醇室温处理30 min,3%枸橼酸新鲜稀释的胃蛋白酶37 ℃消化。切片于37℃恒温箱预杂交2 h后,滴加杂交液40℃过夜,滴加封闭液、生物素化鼠抗地高辛、链霉亲和素-过氧化物酶复合物和生物素化过氧化物酶。
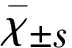
2 结 果
2.1 HE染色评估组织学改变 S组神经元数量较多,形态结构完整,排列整齐;I/R组和LY组神经元细胞肿胀,核分布不均,细胞周围间隙增宽,有的细胞体积缩小,核固缩深染,以缺血再灌注48 h组脑皮质变化最为明显;bFGF组右侧大脑皮质存活神经元数比I/R组和LY组增多,神经元胞体肿胀明显减轻,细胞形态明显改善(见图1)。
2.2 TUNEL检测大脑皮质神经元的凋亡 TUNEL阳性染色结果为细胞核呈棕黄色颗粒,I/R组和LY组大鼠皮质神经元凋亡趋势相似,随着再灌注时间的增长凋亡细胞逐渐增多,在48 h达到高峰,72 h逐渐减少。而在同一时间点I/R组和LY组凋亡细胞数较S组明显增加(P<0.05),相较于I/R组和LY组bFGF组皮质凋亡细胞明显减少(P<0.05)(见图1、表1)。
2.3 免疫组织化学染色检测大脑皮质p-Akt的表达 S组大鼠大脑皮质p-Akt阳性表达较少,I/R组和LY组较S组表达明显增多(P<0.05)。I/R组和LY组右侧大脑皮质p-Akt阳性表达产物在脑血缺再灌注后24 h达到高峰,然后逐渐减少。bFGF组、I/R组和LY组p-Akt阳性表达趋势均相同,但是bFGF组p-Akt阳性表达明显增加(P<0.05)(见图1、表2)。
2.4 原位杂交检测GSK-3βmRNA的表达 右侧大脑皮质GSK-3βmRNA表达在I/R组和LY组阳性表达较S组表达明显增多(P<0.05),GSK-3βmRNA阳性产物出现在大鼠脑缺血再灌注后12 h,在48 h阳性表达达高峰,然后72 h逐渐减少。bFGF组与I/R组和LY组比较,GSK-3βmRNA在右侧大脑皮质胞浆内表达明显减低(P<0.05)(见图1、表3)。
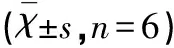
表1 各组脑缺血再灌注大脑皮质TUNEL染色阳性细胞数
vs Sham group;*P<0.05,vs I/R and LY group△P<0.05
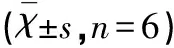
表2 大鼠脑缺血后大脑皮质神经元p-Akt表达的吸光度值
*P<0.05 vs Sham group;△P<0.05 vs I/R and LY group
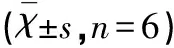
表3 大鼠脑缺血后大脑皮质神经元GSK-3βmRNA表达的吸光度值
*P<0.05 vs Sham group;△P<0.05 vs I/R and LY group
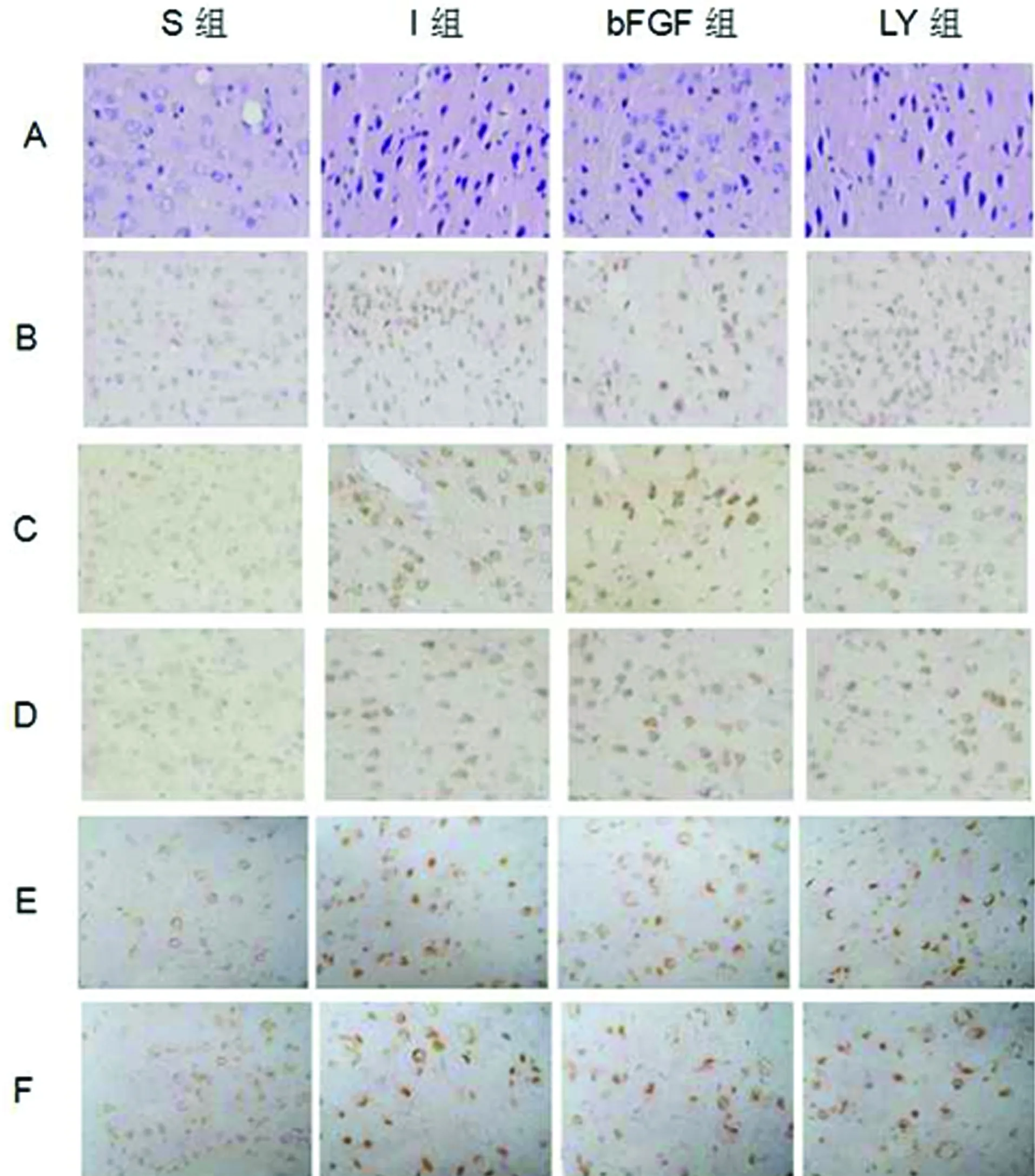
A:HE染色检测各组缺血再灌注48 h大鼠大脑皮质组织学改变;B:TUNEL法检测各组缺血再灌注48 h大鼠大脑皮质凋亡细胞数;C:免疫组织化学染色法检测各组缺血再灌注24 h大鼠大脑皮质p-Akt的表达;D:免疫组织化学染色法检测各组缺血再灌注48 h大鼠大脑皮质p-Akt的表达;E:原位杂交法检测各组缺血再灌注24 h大鼠大脑皮质GSK-3βmRNA的表达;F:原位杂交法检测各组缺血再灌注48 h大鼠大脑皮质GSK-3βmRNA的表达
图1 脑缺血再灌注大鼠大脑皮质HE染色、TUNEL、免疫组化和原位杂交检测(×400)
3 讨 论
Akt是PI3K信号通路中一个重要的下游靶点,具有丝/苏氨酸蛋白激酶活性,Akt被激活后,可通过磷酸化胞内多种底物蛋白质从而调节它们的活性。PI3K/Akt信号通路参与调控细胞内多种信号途径,在促进细胞存活及增殖、抗凋亡、调节糖代谢和蛋白合成等过程中起关键的作用[7~9]。
本实验通过应用PI3K/Akt信号通路特异性抑制剂,LY294002可高度选择性抑制PI3K,当PI3K/Akt信号通路被抑制后,观察其对Wnt/β-catenin信号通路主要成员GSK-3β表达的影响。通过免疫组织化学法检测大脑皮质中P-Akt蛋白水平,结果提示S组大脑皮质P-Akt表达水平在不同灌注时间点均低于I/R组和LY组;bFGF组各亚组P-Akt表达均高于I/R组和LY组各亚组表达,bFGF组、I/R组和LY组均在24 h达高峰,说明bFGF可激活脑缺血再灌注损伤大鼠的PI3K/Akt信号通路,而bFGF对该通路的激活作用可被LY294002有效的抑制。此外,本实验还采用原位杂交技术检测Wnt信号通路主要成员GSK-3β mRNA在缺血再灌注大鼠大脑皮质的表达情况。结果表明I/R组和LY组缺血再灌注大鼠大脑皮质GSK-3β mRNA表达在不同时间点亚组均高于S组,分别在48 h和72 h达高峰。bFGF组各亚组GSK-3β mRNA表达明显相较I/R组和LY组明显降低。该实验结果可说明bFGF可以通过激活缺血再灌注损伤大鼠大脑皮质的Akt表达,进而抑制GSK-3β的表达。在Akt/GSK-3β信号通路中,由于GSK-3β的表达减少,β-catenin被GSK-3beta-Axin-APC复合物降解减少,致使β-catenin细胞浆内积聚,继而进入胞核,促进Wnt靶基因转录,促进细胞增殖分化,修复缺血神经组织[10~12]。通过对缺血再灌注大鼠大脑皮质凋亡神经元的检测,bFGF组TUNEL阳性细胞数量明显低于I/R组和LY组,可提示bFGF通过激活PI3K/Akt信号通路保护神经元。结合既往研究结果[13],bFGF可抑制缺血再灌注损伤神经元凋亡,同时可以促进β-Catenin在脑缺血再灌注大鼠脑组织中的表达,对缺血损伤的神经元有保护作用。综和上述实验结果可得出,在脑缺血再灌注损伤PI3K/Akt信号通路协同Wnt/β-catenin共同发挥保护修复作用,以上2条信号通路均可被bFGF激活,即bFGF- Akt-GSK-3β-β-catenin。表明PI3K/Akt和Wnt/β-catenin通路的共同成员Akt、GSK-3β和β-catenin有可能成为缺血性脑损伤治疗中重要的靶分子。

