表没食子儿茶素没食子酸酯稳定性及稳定化方法研究进展
, ,
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是从绿茶中提取的一种儿茶素类单体,是绿茶主要的活性和水溶性成份,在儿茶素中含量最高,约占60%,占绿茶毛重的9%~13%[1-2]。大量研究表明,EGCG具有抗癌、抗炎、抗突变、抗衰老、改善肝功能、防紫外线、预防心血管疾病、预防内分泌紊乱和自身免疫疾病等多种生物活性[3]。并且,EGCG诸多药理活性均与其强力的抗氧化活性有关[4],其抗氧化活性是维生素E的20倍,超氧化物歧化酶的6倍[5]。EGCG的抗氧化活性与其化学结构(具有8个酚羟基)密切相关(图1)。在体外,EGCG的酚羟基易受光、氧、温度、pH值等因素的影响氧化形成邻醌,而邻醌又很不稳定,易发生复杂的聚合、缩合反应,形成双黄烷醇类、茶黄素类和茶红素等,存在贮存、运输、加工过程中的降解问题[6-7];在体内,EGCG在肠胃中滞留时间短,吸收率不高,且易受体液影响而降解,生物利用度较低[8]。因此,EGCG结构的稳定对维持其生物活性至关重要。目前,提高EGCG稳定性的方法主要有2种,即采用化学方法对其结构进行修饰和采用药物制剂技术进行剂型设计。作者重点综述EGCG体内外稳定性及稳定化方法,为保持EGCG活性及更广泛的应用提供新思路。
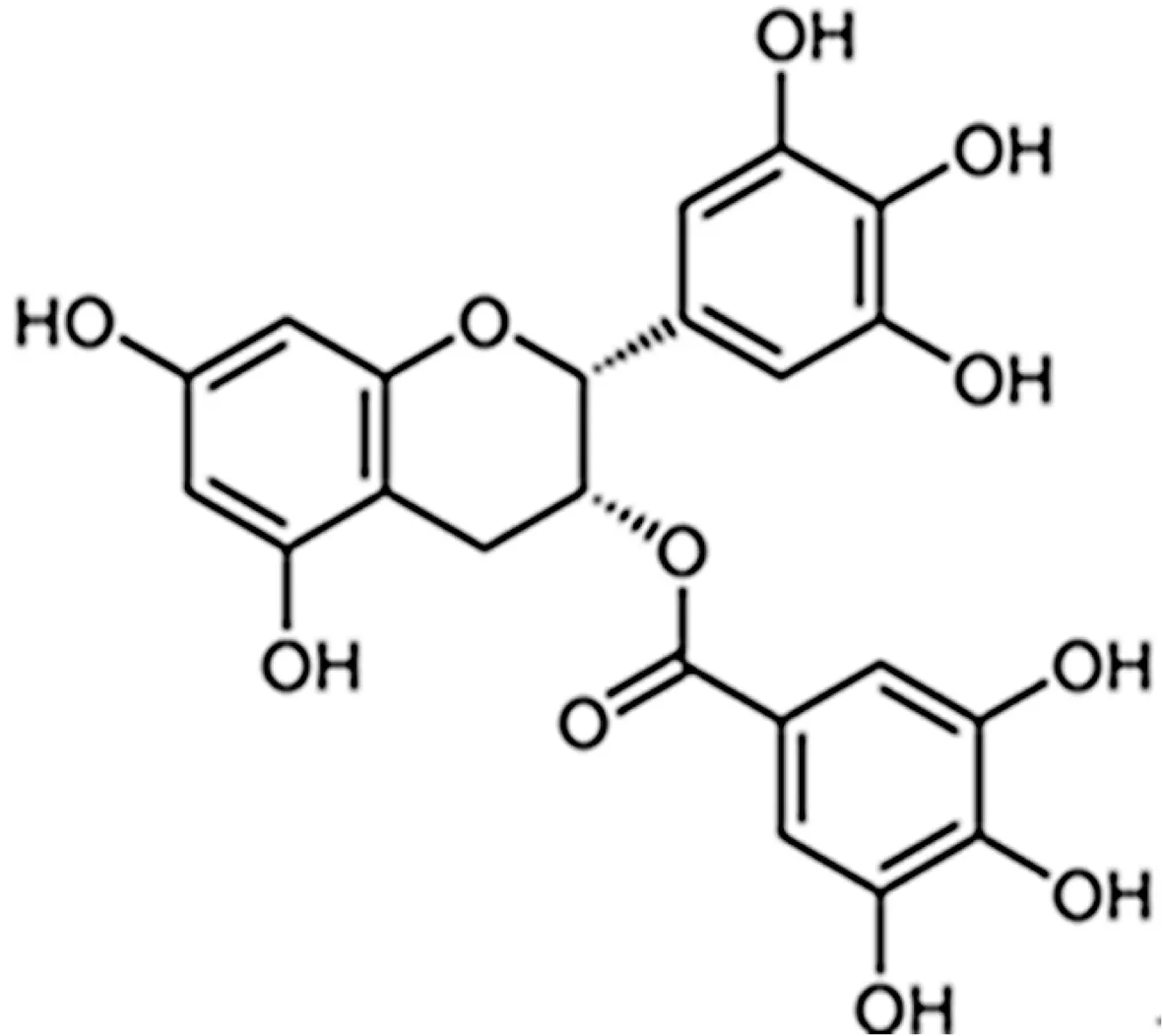
图1 EGCG的结构
1 EGCG稳定性
1.1 EGCG体外稳定性 EGCG结构中有6个邻位酚羟基(图1),在体外,随着pH值的增加、温度的升高、光照时间的延长等外界条件变化,易发生降解、异构化及氧化等。众多研究发现EGCG的体外转化产物非常复杂,结构难以确定。
许楠等[9]研究了EGCG在超声场和非超声场条件下,不同pH值对EGCG稳定性的影响。结果表明,EGCG在pH值6.0、6.2较稳定,并且在超声场条件下,EGCG的损失率均较非超声场高。陈利燕等[10]将不同酸度的儿茶素溶液在25 ℃放置18 h后,儿茶素的含量都有所减少,而EGCG是8种儿茶素组分中最稳定的。李邦玉等[11]采用紫外可见分光光度法定性研究温度、时间、酸碱、紫外光、溶剂等对EGCG稳定性的影响,以及EGCG分别与H2O2、DPPH·的反应。研究结果表明温度、时间、酸碱、紫外光等都不同程度影响EGCG的稳定性,并且H2O2和DPPH·均可与EGCG反应,破坏其结构。吴平等[12]研究了不同温度热处理的EGCG,发现EGCG的氧化产物比较复杂,无法进行定量分析。郭震等[13]考察了EGCG固体粉末的稳定性,结果显示EGCG在强光、高温、高湿条件下,EGCG粉末颜色有不同程度的变化,但含量均无明显变化,也未见新的降解物质产生,说明EGCG固体粉末的稳定性较好。
1.2 EGCG体内稳定性 EGCG在胃肠滞留时间短、渗透性差、容易受胃肠环境(如pH值、酶等)的影响而变得不稳定,从而使EGCG口服的生物利用度大大降低[14-16]。
EGCG在体内的主要降解途径有甲基化、葡萄糖醛酸化、硫酸化。如连续注射3 d EGCG的小鼠血浆中发现代谢产物主要有单甲基EGCG、单硫酸甲基EGCG、单葡糖苷EGCG、单葡糖苷甲基EGCG等[17]。Kida等[18]在大鼠胆汁中发现了5种EGCG代谢产物,分别以硫酸化、葡萄糖醛酸化、硫酸化或硫酸盐/葡萄糖醛酸结合物的形式存在。EGCG在过氧化物酶和过氧化氢酶作用下能够与谷胱甘肽或半胱氨酸生成EGCG硫醇偶合物[19]。在人的血浆和尿液中发现EGCG主要甲基化产物,并且血浆中浓度远远高于在尿液中的浓度,Meng等[20]认为其原因可能是人肾中儿茶酚-O-甲基转移酶活性较高的缘故。
2 EGCG稳定化方法
2.1 用化学方法修饰EGCG EGCG因结构中酚羟基较多,故脂溶性及稳定性差,生物利用度低,使其深度应用受到限制,而分子修饰能显著的改善EGCG多种理化性质。近年来,国内外开展了EGCG改性的相关研究,以期改善EGCG的应用特性。
1982年,日本科学家Saijo[21]首次从绿茶中分离出EGCG3″Me,随后,在茶叶和茶树体内代谢物中不断有甲基化的EGCG被发现,并且,这些甲基化产物的脂溶性、稳定性方面均有所改善,并能保留其相应的生物活性。在此启发下,诸多科学家为了解决天然甲基化EGCG数量有限和获取困难的问题,合成了一系列EGCG甲基化、酰化、糖苷化衍生物[22-23]。如,Miyase和Sano[24]将EGCG以及甲基供体CH3I溶于N,N-二甲基甲酰胺中,在Li2CO3催化下在EGCG4″-OH上引入甲基后得到3个甲基化EGCG衍生物。Meng等[20]将EGCG和CH3I加入丙酮溶液(或二甲基甲酰胺)中,以碳酸钾作为催化剂,水浴超声3 h后得到3种甲基化产物。吕海鹏等[25]以EGCG和CH3I作为原料,以丙酮作为溶剂,在碳酸钾催化下合成了5个甲基化EGCG衍生物(图2)。酰基化修饰是指在EGCG分子的8个酚羟基上选择性地接上脂肪链而形成酯键的修饰方法。杜亚俊[22]合成了一系列EGCG酰化衍生物(图3),如全乙酰化EGCG、全丙酰化EGCG、全丁酰化EGCG等,实验证明,EGCG及其衍生物在人工模拟胃液中均能保持一定的稳定性,且3种衍生物的稳定性相比于EGCG明显提高。糖苷化修饰是指在EGCG的8个酚羟基上选择性地接上1个或多个亲水性的单糖分子基团(图4)。如Kitao等[26]通过蔗糖磷酸化酶催化得到了2种EGCG糖苷化合物,分别是(-)-EGCG-4′-O-α-D-吡喃葡萄糖苷和(-)-EGCG-4′,4″-O-α-D-二吡喃葡萄糖苷。Moon等[27]从肠膜明串珠菌B-1299CB中提取蔗糖-6-葡萄糖基转移酶来催化蔗糖和EGCG反应,在28 ℃下反应6.5 h后将α-D-吡喃葡萄糖基引入C-4′位和C-7位,分离纯化后得到3种产物。柳敏等[23]综述了最近国内外EGCG结构修饰的常见方法,合成过程以及相应的药理活性研究,根据结合位点不同,将EGCG修饰总结为3类,第一类是对EGCG的酚羟基进行修饰,如对酚羟基进行不同程度的甲基化修饰,酰化修饰,糖苷化修饰[28];第二类是对EGCG的D环上的羟基进行3-O-酰化修饰[29];第三类是对EGCG苯环上H原子的取代修饰,如C-6位和C-8位上取代修饰[30]。经结构修饰获得的EGCG衍生物在其稳定性和生物活性等诸多方面都得到明显改善。

图2 甲基化EGCG的合成

图3 酰化EGCG的合成
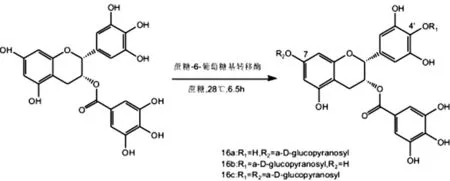
图4 葡萄糖基转移酶制备糖苷化EGCG
2.2 采用制剂技术 随着纳米技术、分子包合技术、脂质体技术、微乳技术等现代药物制剂技术的发展及新型载药系统的出现,使得药物在体内具有可控性、缓释性和靶向性等。同时,这些新技术也可用于包载药物提高不稳定药物的稳定性,从而提高其生物利用度。
2.2.1 制备成EGCG纳米粒 纳米微胶囊,其颗粒微小,易于分散和悬浮在水中,形成均一稳定的胶体溶液,并且具有良好的靶向性和缓释作用。通过将功能因子包裹于纳米粒子内部,能够提高功能因子的稳定性,促使其活性的最大发挥[15]。
侯绍云等[31]利用壳聚糖(chitosan,CS)和聚天冬氨酸(polyaspartic acid,PAA)之间离子交联作用制备CS-PAA纳米粒载体,装载EGCG,制备的EGCG-CS-PAA纳米粒,结果显示纳米体系对EGCG活性具有良好的保护作用,并且对EGCG在高温和碱性条件下的结构稳定性也有一定的保护作用。Zeng等[32]利用CS和三聚磷酸钠(sodium tripolyphosphate,TPP)之间交联作用制备了EGCG-CS-TPP纳米粒,并将EGCG包裹于CS-TPP纳米粒中,再用叶酸(folic acid,FA)和聚乙二醇(polyethylene glycol,PEG)进行修饰得到FA-NPS-PEG和FA-PEG-NPS。结果发现,2种纳米粒均增加了EGCG在MCF-7细胞中的稳定性、增强了EGCG对MCF-7细胞的靶向性,并可明显抑制MCF-7细胞的增殖分化。
2.2.2 制备成EGCG脂质体及类脂质体 脂质体或类脂质体可以在贮藏和胃肠道消化过程中保护活性物质;控制被包埋物在体内缓慢释放;拥有低毒性、生物相适性以及生物可降解性等特点[33]。

2.2.3 其他制剂技术稳定化方法 Onoue等[36]采用乳化溶剂挥发法制备了EGCG肠粘附微球,Eudragit®S100为肠粘附材料。结果显示,该微球直径为16 μm,在体外释放具有pH值依赖性,避免了在胃中的突释,并且能粘附于离体大鼠小肠中,明显降低了EGCG的化学稳定性和生物学稳定性。为改善EGCG的脂溶性,提高其生物利用度,陈金玉等[37]制备了EGCG磷脂复合物,结果显示,EGCG磷脂复合物具有显著的抗氧化活性,并且可以有效抑制大豆油的氧化。王荣镇等[38]以肉豆蔻酸异丙酯为油相,吐温-80和司盘-80复配表面活性剂(表面活性剂的亲水亲油平衡值为6)为表面活性剂,乙醇为助表面活性剂制备了油包水型的EGCG抗氧化微乳液,并对其稳定性和抗氧化活性进行考察。微乳液外观澄清透明,改善了EGCG脂溶性差的缺点,并且在植物油中表现出较好的抗氧化活性。
3 总结与展望
EGCG的化学结构(具有8个酚羟基)决定其具有超强的抗氧化活性,从而表现出广泛的药理作用。但EGCG特殊的化学结构也导致其在体内外的不稳定性,影响生物利用度,限制其成药性。目前,提高EGCG稳定性的方法主要集中在化学结构修饰和剂型改造两个方面。经过化学修饰的EGCG结构发生了改变,脂溶性和稳定性都有所提高,使EGCG在食品、医药、日用化工等领域得到了广泛应用。但是,不少修饰后的EGCG衍生物由于羟基数目的减少,其生物活性有所降低,并且毒副作用会随之发生改变,需要系统研究候选化合物生物活性和毒副作用,工作量大。而采用现代药物制剂技术进行剂型改造,不仅不改变药物的结构,可以完整地保留EGCG的8个活性酚羟基,改善其理化性质的同时又不会带来活性的损失,而且会提高药物的稳定性、缓释性和靶向性。所以,新的剂型和载体可能是提高EGCG稳定性的突破口。随着新技术新剂型的发现,EGCG的不稳定性将被克服,并最终应用临床。

