晚期肺鳞状上皮细胞癌患者应用PD- 1单抗治疗并发白癜风获长期生存1例
朱文婷,武馨,张晓红,陈书长
北京恒和中西医结合医院肿瘤科,北京100005
近年来,程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)抑制剂广泛应用于恶性黑色素瘤、非小细胞肺癌、结直肠癌、肾癌、霍奇金淋巴瘤等多种肿瘤,明显改善了肿瘤患者的生存状态,但PD-1抑制剂引起的免疫相关不良事件(immune-related adverse event,irAE)亦需引起关注。全身irAE主要包括免疫性结肠炎、免疫性肺炎、免疫性肝炎和自身免疫性甲状腺疾病等。而皮肤毒性又较之更为常见,如皮疹、皮肤瘙痒和皮肤白癜风样改变等。回顾性分析北京恒和中西医结合医院临床中发现的1例经PD-1抑制剂免疫治疗后出现广泛皮肤白癜风样改变的肺鳞状上皮细胞癌患者的病历资料,总结患者的临床特点,以提高临床医师对此类疾病的认识。
1 病历资料
患者男,75岁,2016年3月21日因咳嗽、喘憋就诊于北京朝阳医院。胸部CT提示左下肺肿块,肿瘤最长径约为2 cm。2016年5月5日于中国医学科学院肿瘤医院经活检病理示:左下肺非小细胞癌,结合免疫组织化学染色技术考虑为中分化肺鳞状上皮细胞癌。表皮生长因子受体(epidermal growth factor receptor,EGFR)、鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncgene,KRAS)未见基因突变,间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合基因阴性。于外院行氩氦刀局部治疗。2016年11月9日胸部CT提示左肺下叶肿瘤较前明显增大,肿瘤最长径约为3.6 cm。2017年4月19日复查PET/CT示病灶最长径增大至5.9 cm;双肺门及纵隔可见18F-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)摄取增高结节。
2017年4月26日患者为行进一步治疗就诊于北京恒和中西医结合医院肿瘤科。2017年5月4日查血常规、肝肾功能、凝血功能,均未见明显异常。肿瘤标志物:鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCCAg)9.1 ng/ml,癌胚抗原(carcinoembryonic antigen,CEA)7.75 ng/ml,神经元特异性烯醇化酶(neuron specific enolase,NSE)26.9 ng/ml,细胞角质蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1,CYFRA21-1)22.45 ng/ml。2017年5月8日行二次肺病灶穿刺活检,病理示:肺鳞状上皮细胞癌。
2 治疗方式及过程
患者咳嗽、咯痰症状逐渐加重,活动后胸闷明显,步行距离仅约20米。2017年5月5日复查胸部CT示左肺占位最长径约5.9 cm(图1A)。患者于2017年5月9日、5月23日共行2次纳武单抗200 mg,静脉滴注,每2周1次,用药过程顺利。患者咳嗽、咯痰、胸闷有所缓解,步行距离增至100米。
2017年5月25日,患者PD-L1阳性表达检测结果回报:≥27.2%。患者自2017年6月6日起改用派姆单抗150 mg,每3周1次,静脉滴注。2017年6月22日复查胸部CT示:左肺下叶前基底段占位,肿瘤较前缩小,最长径约4.1 cm;两肺门及纵隔多发淋巴结,大致同前。肿物最长径缩小30.5%,疗效评估为部分缓解(partial response,PR)。5次派姆单抗150 mg静脉滴注后,患者咳嗽、胸闷症状继续缓解,步行距离逐渐增至500米。用药期间复查血常规、肝肾功能、甲状腺功能,均未见明显异常。复查肿瘤标志物示:SCCAg2.8 ng/ml,CEA 6.49 ng/ml,NSE 19.9 ng/ml,CYFRA21-1 5.31 ng/ml,较之前均有所下降。2017年8月29日复查胸部CT示:左肺下叶前基底段占位,最大截面约为3.6 cm×2.4 cm;两肺门及纵隔多发淋巴结,大致同前;疗效评估仍为PR。自2017年9月4日起,患者头面部、双前臂、双手均出现散在圆形和椭圆形皮肤白斑,白斑直径为0.5~3.0 cm。此后患者白斑逐渐增多、融合,白斑约占体表面积的13%。
2017年12月12日复查胸部CT示:左肺下叶前基底段占位,最大截面约为3.9 cm×3.9 cm;两肺门及纵隔多发淋巴结无增大,疗效评价为SD。患者病灶长径无变化,短径增大,考虑患者PD-L1蛋白表达较低。2018年1月29日完成12次派姆单抗静脉滴注后,患者步行距离逐渐增至1000米。2018年2月1日,患者腹部、腰部、臀部、双大腿上段、双小腿、双足新见皮肤白斑,周身白斑约占体表面积的25%。2018年2月13日再次改用纳武单抗治疗。2018年6月20日顺利完成共10次纳武单抗200 mg输注。患者卡氏功能状态(Karnofsky performance score,KPS)评分维持在90分。2018年4月25日复查胸部CT示病灶最长径为5.7 cm,疗效评价可能为PD(图1B)。患者使用抗PD-1单克隆抗体治疗后,无进展生存期为8个月。病灶与基线评估,总疗效评价为SD。总生存时间>18个月。
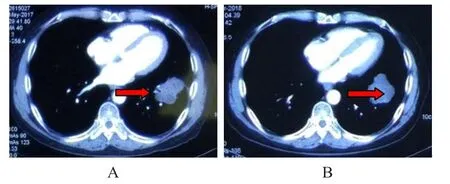
图1 晚期肺鳞状上皮细胞癌患者用药前后的影像图片
3 讨论
在应用PD-1抑制剂治疗的恶性黑色素瘤患者中,3.4%~25.7%的患者会出现皮肤白癜风样改变[1-2]。皮肤白癜风样改变与患者的无进展生存时间(progression-free survival,PFS)和总生存时间有关,未出现皮肤白癜风样改变患者的疾病进展和死亡风险是出现皮肤白癜风样改变患者的2~4倍(P<0.05)[1-2]。而关于应用PD-1抑制剂治疗的非恶性黑色素瘤患者出现皮肤白癜风样改变不良反应的报道较少。既往有过关于1例好转的急性髓性白血病患者使用纳武单抗后出现皮肤白癜风样改变的个案报道[3]。结合此病例,其他肿瘤患者出现白癜风样改变是否亦可拥有较好的临床获益尚需进一步研究证实。
皮肤白癜风样改变的发病机制尚不清楚。有证据表明,它反映了患者对肿瘤的免疫反应。在白癜风皮损的周围有许多活化的细胞毒性T细胞,这些浸润的淋巴细胞主要为表达皮肤归巢受体-皮肤白细胞相关抗原受体的细胞毒CD8+淋巴细胞[4]。而从白癜风患者皮损中分离纯化的CD8+T细胞能够诱导体外培养的自体无损皮肤组织中的黑色素细胞发生凋亡[5-6]。其原因可能是表达正常水平酪氨酸酶、酪氨酸相关蛋白(tyrosinase-related protein,TRP)的黑色素细胞被针对这些“自身”抗原的细胞毒性T细胞反应所破坏。应用PD-1抑制剂的患者之所以出现白癜风样改变,可能是T细胞活性增加的结果。恶性黑色素瘤患者出现皮肤白癜风样改变的概率较其他肿瘤高的原因可能为恶性黑色素瘤是一种高免疫原性肿瘤,常过度表达酪氨酸酶、TRP-1、TRP-2、gp100等几种黑色素细胞系抗原[7]。
综上所述,关于非恶性黑色素瘤的实体瘤患者应用PD-1抑制剂后并发大面积白癜风样改变的报道相对少见,而本例患者获得超过18个月的生存期,提示白癜风是一个有效预知疗效的指标,而与特定基因的突变有无关联值得进一步深入研究。

