早期母子分离对大鼠成年后认知功能及海马区神经型一氧化氮合酶表达的影响
李丹丹 马芮 王少朋 赵弘轶 黄勇华
大量文献证实,生命早期应激 (early life stress,ELS)可持久影响大脑神经元的生长发育,造成个体成年后学习记忆等认知功能障碍[1]。分离应激作为一种ELS可通过多条途径引起大脑广泛损害[2-3]。母子分离(maternal separation,MS)是啮齿类动物ELS的经典模型,常用于研究ELS对神经发育及情感认知功能等影响。神经型一氧化氮合酶(neural nitric oxide synthase,nNOS)参与中枢神经系统的多种病理生理过程[4],在丰富环境下,神经系统内nNOS活性增高[5]。而MS模型作为一种相对孤立的环境,对脑内nNOS及个体成年后脑区结构和功能改变的影响,目前鲜有文献报道。本研究拟对这一问题进行初步探讨。
1 材料与方法
1.1 实验动物将12只健康SD孕鼠随机分成母子分离组(MS组)和非母子分离(no maternal separation group,NMS)组,每组各 6只,照料孕鼠直至其自然生产。MS组所有新生幼鼠在出生后第3天(PND3)开始,每日将母鼠与幼鼠分离 3 h,直至PND22断奶。NMS组不进行任何干预。期间,给予母鼠和幼鼠充足的食物、清洁饮用水,定期更换新鲜干净的垫料,20℃左右舒适的室温,独立安静的饲养环境。断奶后,将两组中的雄性幼鼠(每组24只)分笼饲养至10周龄(同组每笼3~5只)。
1.2 研究方法
1.2.1 Morris水迷宫测试 幼鼠饲养至10周龄时,进行Morris水迷宫行为学测试,评估其空间学习和记忆能力。水迷宫为黑色圆形水池,直径150 cm,高60 cm,水深40 cm,分为西南、西北、东北和东南四个等分象限,一个透明的平台(直径8 cm)放置在西南象限水面以下1 cm处,由摄像机和追踪装置记录大鼠运动轨迹。适应性训练时,大鼠随机放置在任一象限,其找到平台时间记为逃逸潜伏期,如120 s仍未找到则将其放在平台上适应15 s。每只大鼠每天4次训练,持续4 d。在第5 d训练后,进行探针实验,即移除平台,记录大鼠在各个象限游泳时间、运动轨迹及穿越平台位置的次数。结果分析其逃逸潜伏期、目标象限停留时间及穿越平台次数。
1.2.2 蛋白质电泳 采用Western Blot法检测两组大鼠大脑海马区 nNOS、eNOS、Bax/BCL2、caspase-3及P53的含量。两组子代大鼠(每组取12只)迅速断头取脑,分离海马组织并充分研磨后,加入RIPA裂解液(PMSF与 RIPA Lysis Buffer按 1∶500配制)冰上孵育30 min,4℃下以12000 rpm离心15 min,取上清液,加入变性蛋白上样缓冲液,混匀后沸水煮10 min,然后按蛋白印迹法的步骤操作,一抗为NOS1、anti-eNOS抗体、anti-Bax抗体、BCL2 polyclonal抗体、anti-Caspase-3 p12抗体、TP53 polyclonal抗体,内参为鼠anti β-tubulin抗体,二抗为羊HRP标记的山羊抗兔IgG和山羊抗小鼠IgG。使用BIO-RAD XRS+Software显影,Image J图像分析软件对结果进行灰度分析。
1.2.3 免疫荧光染色 用Ki67标记两组大鼠海马齿状回(dentate gyrus,DG)增殖的神经元细胞,DCX标记神经元细胞的分化情况[6],用一步法TUNEL染色检测凋亡的神经元。两组子代大鼠(各取12只)用4%多聚甲醛心脏灌注后,将完整大脑取出放入蔗糖梯度溶液固定,OCT包埋后,将海马DG区以10 μm厚度冰冻切片。将切片在抗原修复液中煮 8~10 min,1×PBS冲洗 3次, 每次 5 min,Triton X-100打孔15 min,10%山羊血清封闭1 h后,加一抗4℃孵育过夜,1×PBS洗去一抗,加入二抗室温孵育 1 h,1×PBS洗去二抗,室温下DAPI染细胞核15 min,50%甘油PBS封片,荧光显微镜下观察海马DG区阳性细胞数。其中一抗为 anti-NeuN 抗体、anti-Ki67抗体、doublecortin,二抗为Alexa Fluor 488标记山羊抗兔IgG和Alexa Fluor 555标记驴抗小鼠IgG。
1.3 统计学方法采用SPSS 19.0进行统计学分析。Morris水迷宫结果中逃逸潜伏期的组间比较采用重复测量方差分析,其他行为学指标、免疫荧光染色中阳性神经元细胞数、蛋白质电泳中各蛋白表达情况的组间比较采用独立样本t检验。检验水准α=0.05,双侧检验。
2 结果
2.1 行为学测试结果两组大鼠的逃逸潜伏期结果经球形检验显示符合球形假设 (Mauchly’s W=0.078,P=0.067),重复测量方差分析示时间(训练天数)主效应有统计学意义(F=86.134,P<0.001),分组主效应有统计学意义 (F=40.509,P<0.001),时间与分组之间不存在交互效应 (F=2.561,P=0.057)。相比于NMS组,MS组子代大鼠的目标象限停留时间(t=7.036,P<0.001)和穿越平台次数减少(t=5.175,P<0.001),差异有统计学意义。 见表 1。
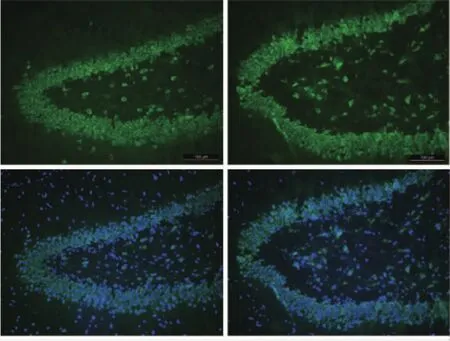
图1 NeuN神经元染色。NMS组(左)与MS组(右)成年大鼠海马DG区神经元的NeuN染色,NeuN阳性细胞镜下呈绿色,为正常神经元细胞。刻度杆=100 μm
2.2 海马DG区神经元细胞计数神经元NeuN染色结果见图1及表 2,NMS组与MS组子代雄性大鼠海马DG区正常神经元细胞数差异无统计
2.3 海马DG区神经元细胞的增殖、分化及凋亡
2.3.1 海马DG区神经元细胞的增殖与分化 Ki67/DCX免疫荧光结果见图2及表2,MS组大鼠相较于NMS组,海马DG区神经元Ki67阳性细胞数(t=16.102,P<0.001)和 DCX 阳性细胞数(t=9.238,P<0.001)均有统计学差异。
2.3.2 海马DG区神经元的变性坏死情况 相对于NMS组,MS组大鼠的海马DG区神经元细胞凋亡增多,两组之间结果有统计学差异(t=-13.805,P<0.001),见图 3 与表 2。
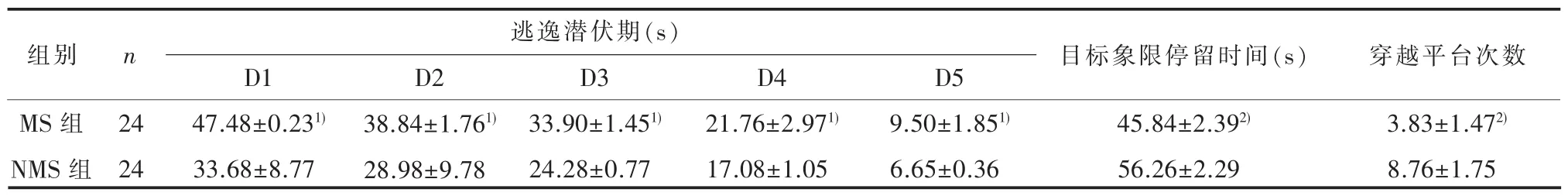
表1 两组子代大鼠行为学测试结果

表2 两组子代大鼠免疫荧光染色阳性细胞数

图2 Ki67+DCX免疫荧光染色。NMS组(左)与MS组(右)成年大鼠海马DG区神经元的Ki67与DCX染色,Ki67阳性神经元呈绿色,DCX阳性细胞呈红色。刻度杆=100 μm
2.3.3 神经元凋亡及机制 蛋白电泳结果显示,与NMS组相比,MS组大鼠海马区神经元组织中NOS 两个亚型 nNOS(t=10.034,P<0.001)和 eNOS(t=4.823,P=0.001)表达均减低且差异有统计学意义,两组间凋亡抗体Bax/BCL2比值差异也有统计学意义(t=-11.487,P<0.001),而 caspase-3(t=0.985,P=0.354)和 P53(t=0.740,P=0.481)的表达两组之间无统计学差异(P>0.05),见图4及表3。
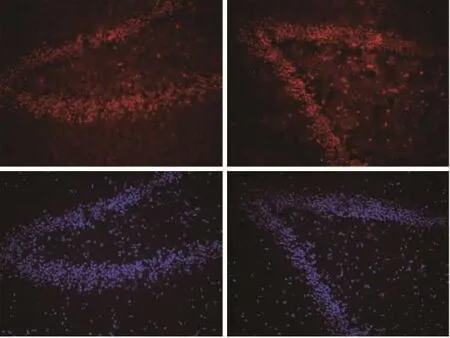
图3 TUNEL免疫荧光染色。NMS组(左)与MS组(右)成年大鼠海马DG区神经元的TUNEL染色,TUNEL阳性神经元呈红色。刻度杆=100 μm。
3 讨论
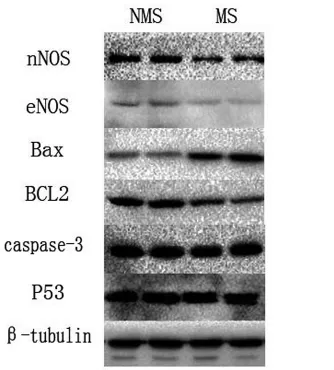
图4 蛋白电泳Western Blot。MS组与NMS组对大鼠大脑海马区神经元 nNOS、eNOS、Bax、BCL2、caspase-3 和 P53 表达的代表性条带。内参为β-tubulin。

表3 两组子代大鼠蛋白电泳标准化蛋白表达情况
无论人类或啮齿类动物,生命早期是大脑神经元高速生长发育的时期,在这一阶段任何应激都可能对神经元发育产生影响,造成个体成年后出现相关认知功能障碍[7]。在动物实验中,MS模型是研究ELS常用且较成熟的动物模型[8]。海马是学习和记忆的关键脑区[9],动物研究证实,MS会导致子代动物海马区锥体细胞发育异常及突触可塑性缺陷,海马功能下降[10],在Morris水迷宫测试中表现出空间导航与学习记忆等认知功能障碍[11]。在本研究中,Morris水迷宫行为学测试结果表明,MS造成雄性大鼠成年后学习、记忆相关认知功能损害,而NeuN免疫荧光染色结果则提示MS后海马区正常神经元数目无明显变化。
既往研究证实,中枢神经系统部分脑区能够产生新的神经元,如海马DG区的颗粒下层等[12]。海马DG区的神经发生在整个生命过程中持续存在,nNOS有助于戊四唑诱导海马神经发生[13]。本研究中蛋白电泳的检测结果提示,MS导致大鼠成年后海马区nNOS、eNOS表达降低;Ki67/DCX免疫荧光染色结果表明,MS导致大鼠成年后海马DG区神经元细胞增殖降低、分化减缓,提示在MS模型中,nNOS低表达的同时神经元细胞的发生与分化也受到抑制。
研究认为,nNOS与神经元凋亡密不可分[14]。本研究采用蛋白印迹法检测凋亡相关抗体表达,发现MS组Bax/BCL2表达增高,caspase-3、P53表达无统计学差异;TUNEL染色提示神经元凋亡增加。研究发现,Bax/BCL2与P53并非共同介导某些凋亡过程[15],这可能与“非依赖P53凋亡通路”存在有关;此外,Bax/BCL2介导的凋亡可能更多以线粒体为靶点[16],本模型中有关海马区线粒体功能的具体机制值得未来进一步研究。同时,线粒体能够参与调控依赖性和非依赖性caspase细胞凋亡通路[17]。本研究中两组大鼠海马区caspase-3的表达没有统计学差异可能是由于在该模型中,神经元凋亡是通过非依赖caspase细胞凋亡通路实现的。
本研究初步明确了MS导致的子代大鼠成年后学习记忆相关认知功能障碍可能与海马区nNOS表达降低有关,也与海马区神经元细胞增殖减低、分化减缓有关。研究的不足之处主要在于缺乏加入nNOS抑制剂及nNOS基因缺乏的设计,未能验证nNOS是这一通路中的关键点,未来研究需要加以弥补。

