菠萝皮渣多糖脱蛋白脱色方法研究及其抗氧化活性
胡会刚,赵巧丽,庞振才
(中国热带农业科学院南亚热带作物研究所农业部热带果树生物学重点实验室,广东湛江524091)
菠萝(Ananas comosus),又名凤梨、黄梨,是一种多年生草本植物,系热带四大名果之一[1],多汁,香甜,含有丰富的有机酸及维生素,具有生津止渴,清热解毒,消食利尿,补益脾胃,润肠通便等功效[2]。17世纪在我国引种成功后,种植面积和产量逐年扩大,2011年,我国菠萝生产总面积达5.6万公顷,总产量约119万吨[4],现已成为世界十大菠萝主产国之一[3]。在菠萝生产加工过程中会产生大量皮渣,占果实的15%~20%,大部分被直接丢弃,不仅造成资源浪费,还加重了环境污染。研究表明,多糖是菠萝皮渣中一类具有特殊生物活性的物质,具有抑制T、B淋巴细胞增殖[5],提高断奶仔猪的生产性能和抗病能力[6],抗脂质过氧化[7],抗氧化[8]和抗肿瘤[9]等作用,目前已鉴定出来的成分有木糖、阿拉伯糖等。菠萝皮渣多糖经初提后常含大量杂质,主要包括游离蛋白质和色素等,不但影响多糖的纯度和生物活性,而且给后期的色谱分析和结构表征带来很大困难[10]。因此,寻求一种除蛋白效果好、脱色率高、多糖损失少、对生物活性破坏小的菠萝皮渣多糖脱蛋白和脱色工艺尤为重要。关于菠萝皮渣多糖体外抗氧化活性的研究已有一些报道。罗建平等[11]发现,菠萝皮渣多糖对O2-·和ABTS+自由基的清除率表现为显著的量效关系,清除O2-·和ABTS+自由基的半抑制率(IC50)分别为1.76 mg/mL和2.49 mg/mL。王标诗等[12]发现在浓度范围(1.50 mg/mL~3.50 mg/mL)内,菠萝皮渣多糖对·OH、DPPH·均有良好的清除能力,对Fe3+的还原能力随多糖浓度的增加呈良好的量效关系。但目前针对脱蛋白脱色后菠萝皮渣多糖的抗氧化活性研究鲜见报道。
基于此,本研究以脱蛋白率、脱色率和多糖保留率为评价指标,对不同脱蛋白方法的作用效果进行了对比,并确定了活性炭法脱色的最佳工艺条件,进一步对所得精多糖体外清除自由基能力进行评价,考察其作为天然抗氧化剂的应用前景,以期为菠萝皮渣精多糖在化妆品和医药制品方面的综合利用与开发提供理论参考。
1 材料与方法
1.1 材料与试剂
菠萝皮渣:购自雷州市英利镇红土地菠萝皮综合利用厂;粉末活性炭:广东韩研活性炭制造有限公司;牛血清白蛋白、考马斯亮蓝G-250、1,1-二苯基-2-苦肼基(DPPH)、2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):美国 Sigma公司;木瓜蛋白酶(800 U/mg):Solarbio公司;葡萄糖:天津市福晨化学试剂厂;X-5大孔吸附树脂:郑州华溢科技新材料股份有限公司;聚酰胺:江苏长丰化工有限公司;浓硫酸:廉江市爱廉化试剂有限公司;无水乙醇、正丁醇、双氧水、氯仿、丙酮、苯酚、三氯乙酸、盐酸,均为分析纯试剂。
1.2 仪器与设备
UV-2550型紫外分光光度计:日本岛津公司;FD-1C-50型真空冷冻干燥机:上海乔跃电子有限公司;RE-3000B旋转蒸发仪:德国海道尔夫公司;DHG 9140A电热鼓风干燥箱:上海一恒科学仪器有限公司;GL-20G-II高速冷冻离心机:北京佳源兴业科技有限公司;MAXQ800型恒温摇床:美国Thermo公司;EL 104电子天平:梅特勒一托利多仪器(上海)有限公司;79-1型磁力搅拌器:新康医疗器械有限公司;SHZ-D(III)循环水式多用真空泵:巩义市英峪高科仪器;HH-4恒温水浴锅:常州澳华仪器有限公司。
1.3 方法
1.3.1 菠萝皮渣粗多糖的制备
将新鲜、成熟的菠萝皮渣烘干后用高速万能粉碎机粉碎,过40目筛。取一定量的菠萝皮渣干粉,以1∶5 g/mL料液比加入80%无水乙醇,室温搅拌浸泡2 h,抽滤弃去上清液,残渣于50℃烘干。以1∶30 g/mL料液比向脱脂物料中加入蒸馏水,于80℃超声波清洗仪中,以160 W的功率浸提90 min,6 000 r/min离心10 min,收集上清液,残渣重复提取1次。合并上清液,真空减压浓缩至原体积1/10,加入浓缩液4倍体积95%乙醇,4℃静置过夜。离心(4 000 r/min,10 min),沉淀依次用无水乙醇、丙酮、乙醚洗涤2~3次,冷冻干燥即得菠萝皮渣粗多糖。
1.3.2 菠萝皮渣粗多糖脱蛋白
1.3.2.1 盐析法[13]
取20 mL菠萝皮渣粗多糖溶液(5 mg/mL),置于小烧杯中,于磁力搅拌器上边搅拌边缓慢加入硫酸铵粉末至设定的饱和度分别为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,50℃搅拌30 min,冷却至室温后离心(4 000 r/min,20 min)去沉淀,收集上清液分别测定蛋白质含量和多糖含量。
1.3.2.2 三氯乙酸法
取20 mL菠萝皮渣粗多糖溶液,置于小烧杯中,加入20%三氯乙酸(trichloroacetic acid,TCA)至其终浓度为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%,30℃振荡30 min,后将其转移至4℃冰箱中静置12 h,5 000 r/min离心10 min,收集上清液分别测定蛋白质含量和多糖含量。
1.3.2.3 Sevag法
取20 mL菠萝皮渣粗多糖溶液,设置1~7次脱蛋白处理。每份多糖溶液中加入其体积1/4的Sevag试剂[氯仿 ∶正丁醇=4 ∶1(体积比)],混合振荡 60 min(转速180 r/min),4 000 r/min离心10 min,弃去下层有机相和中间层胶状变性蛋白质,取上层溶液分别测定蛋白质含量和多糖含量。
1.3.2.4 TCA-正丁醇法[14]
取20 mL菠萝皮渣粗多糖溶液,加入2倍体积TCA-正丁醇混合溶液[TCA∶正丁醇=1∶5、1∶10、1∶15、1∶20(体积比),TCA 浓度 20%],30℃、185 r/min振荡2 h,后将其转移至分液漏斗中静置2 h,待分层后取下层溶液,分别测定蛋白质含量和多糖含量。
1.3.2.5 TCA-Sevag法
取20 mL菠萝皮渣粗多糖溶液,按TCA法脱除一次,再用Sevag法脱除一次,分别测定蛋白质含量和多糖含量。
1.3.2.6 聚酰胺法
将聚酰胺用95%乙醇浸泡2 h后倾去乙醇,再用蒸馏水浸泡2 h,使其充分溶胀,超声除去气泡后备用。取20 mL菠萝皮渣粗多糖溶液,分别加入0.5%、1.0%、1.5%、2.0%、2.5%溶胀好的聚酰胺,搅匀,室温振荡3 h,抽滤,取滤液分别测定蛋白质含量和多糖含量。
1.3.2.7 酶法
取20 mL菠萝皮渣粗多糖溶液,调节pH值为6.0,分别加入 1.0%、1.5%、2.0%、2.5%、3.0%、3.5%的木瓜蛋白酶,搅匀,60℃水浴振荡水解3 h,沸水浴灭酶5 min,冷却至室温后4 000 r/min离心20 min,弃去沉淀,取上清液分别测定蛋白质含量和多糖含量。
1.3.3 菠萝皮渣粗多糖脱色
1.3.3.1 单因素试验
采用活性炭对脱蛋白后的多糖溶液进行脱色,分别探讨活性炭添加量、脱色温度、脱色时间和样液pH值对多糖溶液的脱色效果。单因素试验设定为:固定样液pH值为6.0,脱色温度为50℃,脱色时间为60 min,活性炭加入量分别为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%。固定样液pH值为6.0,脱色时间为60 min,活性炭加入量为 2.5%,脱色温度分别为 30、40、50、60℃;固定样液pH值为6.0,活性炭加入量为2.5%,脱色温度为 50 ℃,脱色时间分别为 20、40、60、80、100、120 min;固定活性炭加入量为2.5%,脱色温度为50℃,脱色时间为 80 min,样液 pH 值分别为 3.0、4.0、5.0、6.0、7.0、8.0、9.0。
1.3.3.2 正交试验
在单因素试验的基础上,选取活性炭添加量(A)、脱色温度(B)、脱色时间(C)和样液 pH 值(D)4个因素,每个因素设置3个水平,按L9(34)正交表安排试验,因素水平见表1。
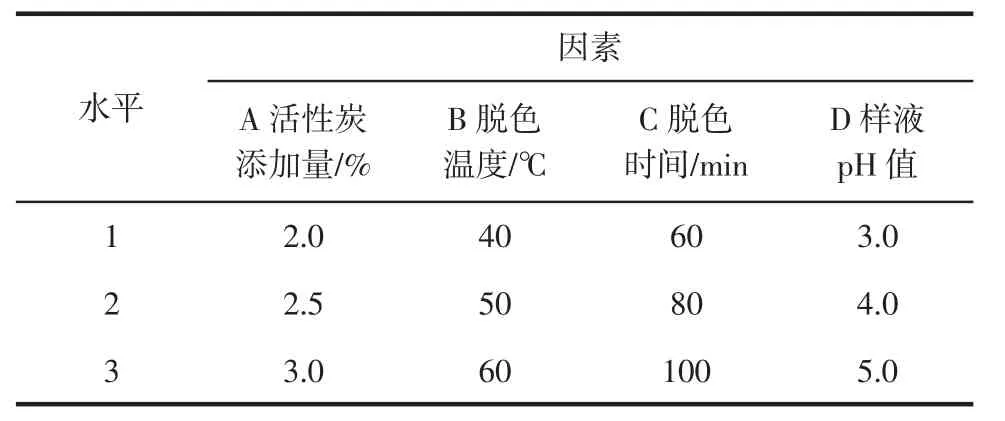
表1 正交试验因素及水平Table 1 Factors and levels of orthogonal test
1.3.4 菠萝皮渣精多糖体外抗氧化活性
1.3.4.1 DPPH·清除能力测定
将初步纯化后的菠萝皮渣粗多糖溶液经蒸馏水透析2 d,浓缩醇沉,冷冻干燥制得菠萝皮渣精多糖。取适量精多糖配制成质量浓度为 0.1、0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的溶液,各取2 mL于不同具塞试管中,每管均加入2 mL 0.2 mmol/L的DPPH溶液,摇匀,避光反应30 min,于517 nm处测定吸光度Ai。以无水乙醇代替DPPH溶液测定吸光度Aj,以蒸馏水代替多糖溶液测定吸光度A0。以不同浓度VC溶液(0.1 mg/mL~3.0 mg/mL)作阳性对照,以上试验平行测定3次,结果取平均值。清除率计算公式如下:
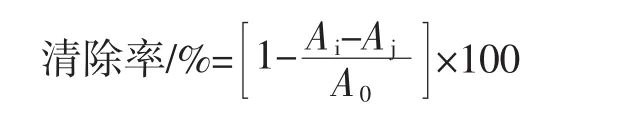
式中:Ai为不同多糖浓度下的吸收度;Aj为不同浓度多糖溶液本底吸光度;A0为空白对照吸光度。
1.3.4.2 ABTS+自由基清除能力测定
各取50 μL不同质量浓度的菠萝皮渣精多糖溶液(0.1、0.5、1.0、1.5、2.0、2.5、3.0 mg/mL),加入 4 mL ABTS+反应液,混匀,避光反应6 min,在732 nm处测定吸光度Ax,以甲醇作空白对照测定吸光度A0。以不同浓度VC溶液(0.1 mg/mL~3.0 mg/mL)作阳性对照,以上试验平行测定3次,结果取平均值。清除率计算公式如下:
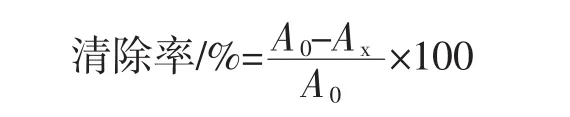
1.3.5 分析方法
1.3.5.1 多糖含量的测定
采用苯酚-硫酸法测定多糖含量,以葡萄糖作标准品,得到标准曲线为:y1=0.011 0x1-0.000 2,R2=0.999 4。式中:x1为葡萄糖浓度,y1为吸光度。线性范围为0~0.07 mg/mL。
1.3.5.2 蛋白质含量的测定
采用考马斯亮蓝G-250法测定蛋白质含量,以牛血清白蛋白作标准品,得到标准曲线:y2=0.000 7x2+0.005 7,R2=0.999 6。式中:x2为蛋白质含量,y2为吸光度。线性范围为0~1.0 mg。
1.3.5.3 脱色率的测定
将经脱蛋白后的菠萝皮渣多糖溶液在波长为200 nm~600 nm范围内进行紫外-可见光谱全波长扫描,结果表明多糖溶液在323 nm下有最大吸收峰,故选择323 nm为检测波长测定菠萝皮渣多糖溶液脱色前、后的吸光度。
1.3.6 计算公式
1.3.6.1 多糖保留率

1.3.6.2 脱蛋白率

1.3.6.3 脱色率

1.3.6.4 综合指标
比较蛋白质和色素的脱除效果,要综合考虑蛋白质脱除率(或脱色率)和多糖保留率两方面的结果,本试验采用综合评分作为蛋白质和色素脱除效果的评价指标,以指标的最大值为参照将数据进行归一化,脱蛋白率(或脱色率)和多糖保留率的权重系数各为0.5。计算公式如下:
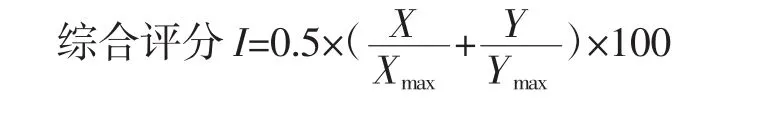
式中:X为脱蛋白率或脱色率;Y为多糖保留率,Xmax为蛋白质或色素脱除率最大值;Ymax为多糖保留率最大值。
2 结果与分析
2.1 菠萝皮渣粗多糖脱蛋白
2.1.1 盐析法
硫酸铵粉末饱和度对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图1。

图1 硫酸铵粉末饱和度对脱蛋白率和多糖保留率的影响Fig.1 Effects of saturation of ammonium sulfate powder on deproteinization and polysaccharides retention rate
由图1可知,随着硫酸铵粉末饱和度的增加,多糖保留率持续降低,而蛋白质脱除率呈先增大后减小趋势,当硫酸铵饱和度为70%时,蛋白质脱除率达到最大,此时脱蛋白率为60.45%,多糖保留率为36.78%。硫酸铵饱和度低,蛋白质沉淀不完全,蛋白质脱除率较低;硫酸铵饱和度高,盐的浓度高,所得沉淀多为蛋白酸铵,反而不利于蛋白质的沉淀,且盐浓度过高时,会增加后续脱盐难度及生产成本,同时多糖损失严重。综合考虑脱蛋白率和多糖保留率,当硫酸铵饱和度为10%时,评分值达到最大,此时蛋白质脱除率为33.55%,多糖保留率为80.79%。
2.1.2 三氯乙酸法
三氯乙酸浓度对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图2。
由图2可知,随着TCA浓度的增大,蛋白质脱除率逐渐增大,而多糖保留率持续下降。TCA浓度较低时,其只能结合多糖中的一部分蛋白质,蛋白质脱除率低;随着TCA浓度的增大,蛋白质脱除率逐渐增大,但TCA与蛋白质结合生成沉淀,会吸附部分多糖,导致多糖保留率降低[16]。综合评价表明,当TCA浓度为3%时评分值达到最大值,此时,蛋白质脱除率为69.72%,多糖保留率为73.54%。

图2 TCA浓度对脱蛋白率和多糖保留率的影响Fig.2 Effects of TCA concentration on deproteinization and polysaccharides retention rate
2.1.3 Sevag法
脱蛋白次数对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图3。

图3 脱蛋白次数对脱蛋白率和多糖保留率的影响Fig.3 Effects of deproteinization times on deproteinization and polysaccharides retention rate
由图3可知,随着脱蛋白次数的增加,蛋白质含量逐渐减少,用Sevag试剂处理1次,蛋白质脱除率为11.36%,处理7次后,蛋白质脱除率为48.18%。多糖保留率随着脱蛋白次数的增加呈逐渐下降的趋势,Sevag试剂处理1次时,多糖保留率为91.15%,处理7次后多糖保留率为76.31%。从综合指标来看,处理7次时评分达到最大值,表明用Sevag试剂处理多次后,蛋白质脱除率明显提高,但多糖损失较多,这可能是由于Sevag试剂在沉淀蛋白质的同时造成多糖的损失[17];此外,脱蛋白次数越多,重复操作过程也可能造成多糖的损失。
2.1.4 TCA-正丁醇法
TCA与正丁醇体积比对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图4。

图4 TCA与正丁醇体积比对脱蛋白率和多糖保留率的影响Fig.4 Effects of the volume of TCA and n-butanol on deproteinization and polysaccharides retention rate
由图4可知,随着TCA与正丁醇体积比的增大,蛋白质脱除率呈先增大后减小趋势,当二者体积比为1∶10时,蛋白质脱除率和综合评分值均达到最大值。此时,蛋白质脱除率为81.47%,多糖保留率为85.91%。当TCA与正丁醇体积比低于或高于1∶10时,多糖损失虽较少,但脱蛋白效果均不理想。
2.1.5 TCA-Sevag法
TCA-Sevag法脱蛋白次数对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图5。
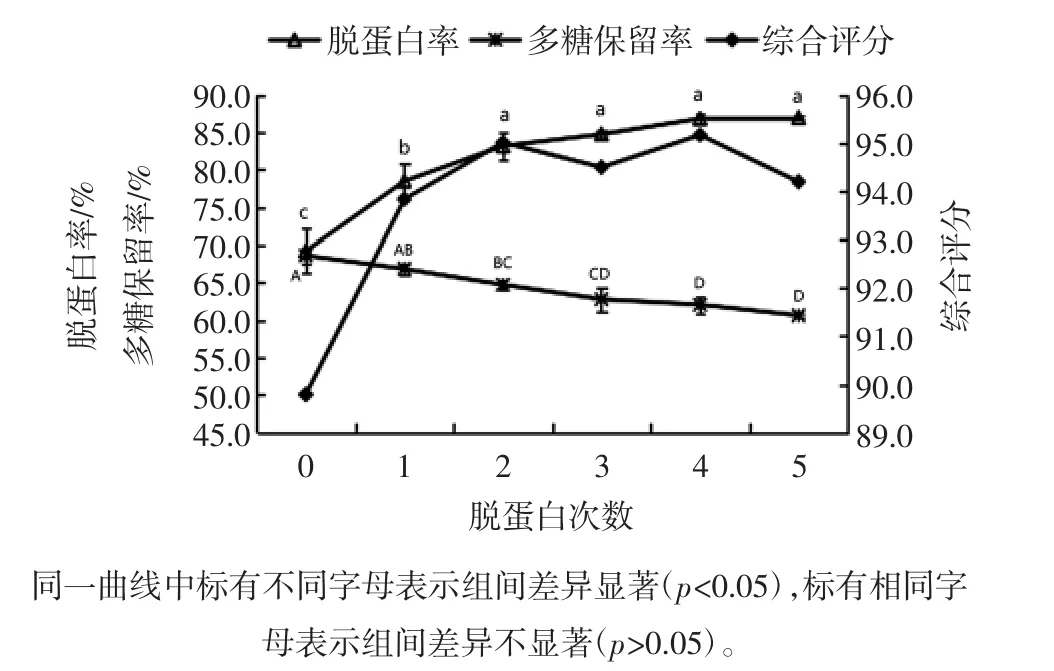
图5 TCA-Sevag法脱蛋白次数对脱蛋白率和多糖保留率的影响Fig.5 Effects of TCA-Sevag deproteinization times on deproteinization and polysaccharides retention rate
如图5可知,随着脱蛋白次数的增加,菠萝皮渣粗多糖蛋白质脱除率逐渐增大,连续操作2次后,蛋白质脱除率达到83.17%,此后继续增加重复操作次数,蛋白质脱除率增大不显著。多糖保留率随着脱蛋白次数的增加逐渐降低,在重复操作3次后,多糖保留率为62.80%。综合评价表明,重复操作4次后评分值达到最大,此时脱蛋白率和多糖保留率分别为86.86%和62.07%。
2.1.6 聚酰胺法
聚酰胺添加量对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图6。
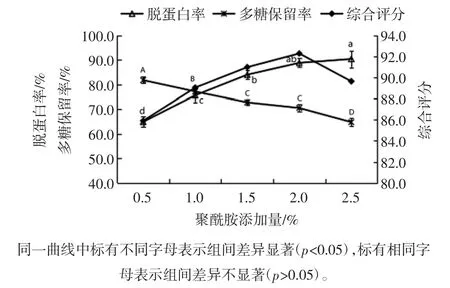
图6 聚酰胺添加量对脱蛋白率和多糖保留率的影响Fig.6 Effects of the dosage of polyamide on deproteinization and polysaccharides retention rate
由图6可知,随着聚酰胺添加量的增大,菠萝皮渣粗多糖溶液蛋白质脱除率逐渐增大,而多糖保留率呈缓慢降低趋势。当聚酰胺添加量为2.0%时,综合评分值达到最大,此时蛋白质脱除率为88.78%,多糖保留率为70.51%。
2.1.7 酶法
木瓜蛋白酶添加量对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响见图7。
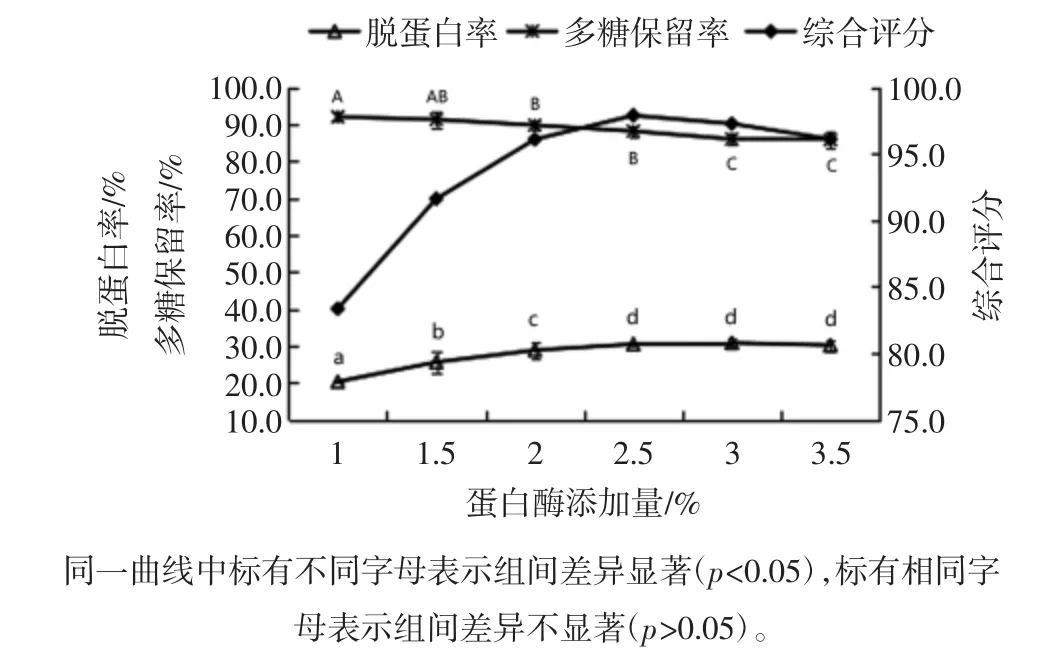
图7 木瓜蛋白酶添加量对脱蛋白率和多糖保留率的影响Fig.7 Effects of the protease dosage on deproteinization and polysaccharides retention rate
由图7可知,随着木瓜蛋白酶添加量的增加,菠萝皮渣粗多糖溶液的脱蛋白率逐渐增大,当酶用量大于2.5%时,酶用量的增加对脱蛋白率无显著影响,而多糖保留率随着酶用量的增加呈缓慢降低趋势。在底物量一定的条件下,增大酶用量,使底物与酶接触的机会增大,反应效率提高,脱蛋白率增大;但由于底物量有限,继续增加酶用量不能使反应效率持续升高[18]。综合评分表明木瓜蛋白酶添加量为2.5%时评分值达到最大,此时蛋白质脱除率为30.49%,多糖保留率为88.15%。
2.1.8 脱蛋白方法的比较
7种脱蛋白方法对菠萝皮渣粗多糖脱蛋白率和多糖保留率的影响,结果见表2。

表2 7种脱蛋白方法的比较Table 2 Comparison of seven deproteinization methods
由表2可知,聚酰胺法蛋白质脱除率最高,但多糖保留率低于盐析法、TCA-正丁醇法和酶法;TCA-正丁醇法的蛋白质脱除率和多糖保留率均较高;盐析法和酶法多糖损失虽较少,但蛋白质脱除率均较低。综合加权评分法分析表明TCA-正丁醇法的评分值最高,故后续试验采用TCA-正丁醇法对菠萝皮渣粗多糖进行脱蛋白处理。
2.2 活性炭脱色工艺研究
2.2.1 活性炭添加量对脱色效果的影响
活性炭添加量对菠萝皮渣粗多糖脱色率和多糖保留率的影响见图8。
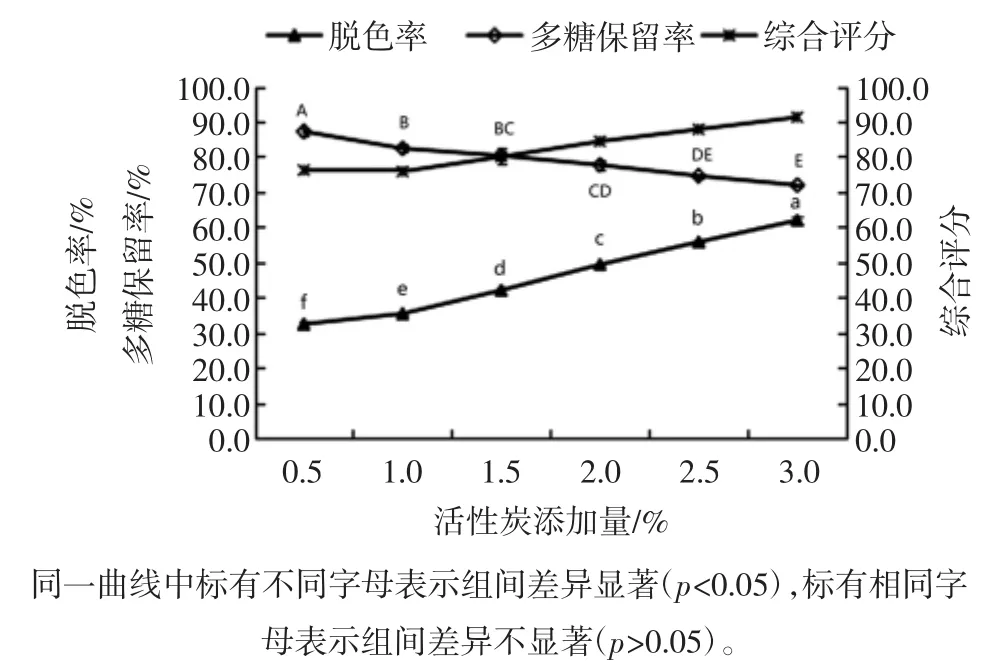
图8 活性炭添加量对脱色率和多糖保留率的影响Fig.8 Effects of amounts of active carbon on decoloration and polysaccharides retention rate
由图8可知,随着活性炭添加量的增加,脱色率呈递增趋势,且差异显著;多糖保留率随着活性炭添加量的增加缓慢降低,这可能是由于活性炭加入量过大,对多糖产生少量吸附作用所致。为了保证脱色率和多糖保留率均在较高水平,选择活性炭添加量为2.0%~3.0%来开展后续试验。
2.2.2 脱色温度对脱色效果的影响
脱色温度对菠萝皮渣粗多糖脱色率和多糖保留率的影响见图9。

图9 脱色温度对脱色率和多糖保留率的影响Fig.9 Effects of decolorating temperature on decoloration and polysaccharides retention rate
由图9可知,随着脱色温度的升高,脱色率逐渐增大,当脱色温度为50℃时,脱色率达到最大,此后继续延长脱色温度,脱色率增大不显著。这可能是由于随着温度的升高,多糖溶液的黏度降低,色素分子运动加快,进而加速了活性炭的吸附作用,直至吸附达到饱和[19]。多糖保留率随脱色温度的升高降低不显著,说明在试验温度范围内多糖损失较少。综合考虑,选择脱色温度为40℃~60℃来开展后续试验。
2.2.3 脱色时间对脱色效果的影响
脱色时间对菠萝皮渣粗多糖脱色率和多糖保留率的影响见图10。
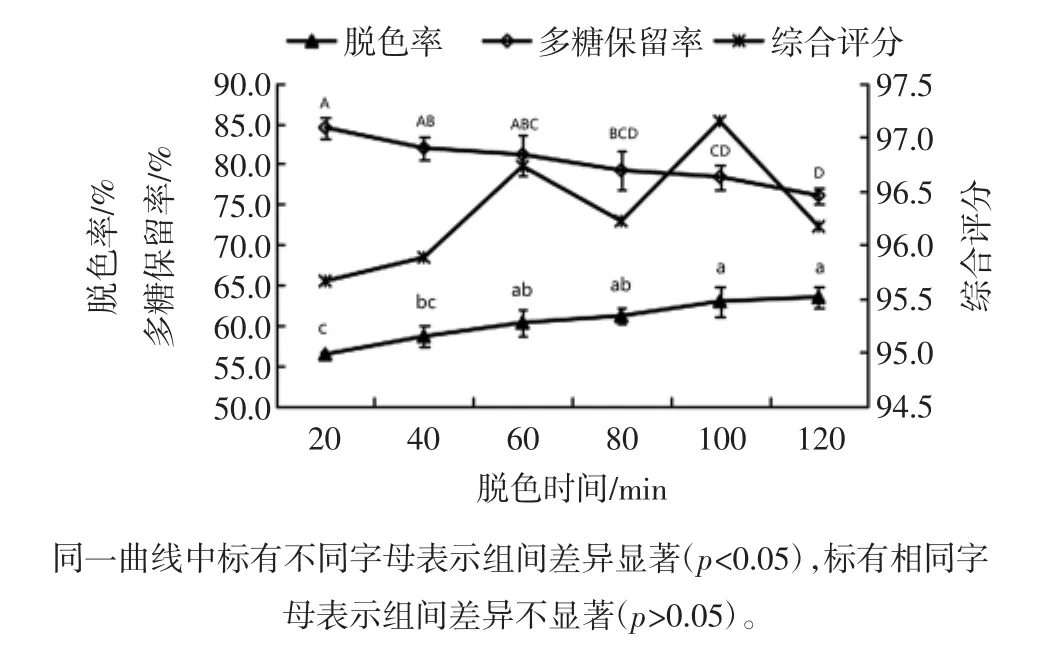
图10 脱色时间对脱色率和多糖保留率的影响Fig.10 Effects of decolorating time on decoloration and polysaccharides retention rate
由图10可知,随着脱色时间的延长,脱色率呈缓慢增大趋势,当脱色时间超过60 min后,脱色率增大不显著,这可能是由于活性炭吸附已达到饱和,吸附与解析处于相对平衡。多糖保留率随着脱色时间的延长缓慢降低,且降幅较小。综合考虑脱色率和多糖保留率,选择适宜的脱色时间为60 min~100 min。
2.2.4 样液pH值对脱色效果的影响
样液pH值对菠萝皮渣粗多糖脱色率和多糖保留率的影响见图11。
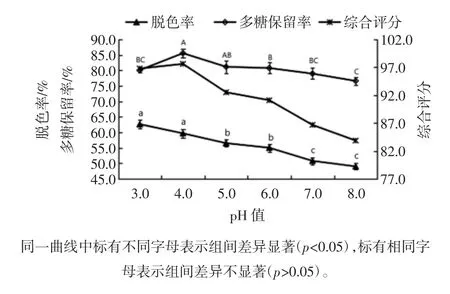
图11 样液pH值对脱色率和多糖保留率的影响Fig.11 Effects of pH value on decoloration and polysaccharides retention rate
由图11可知,样液pH值在酸性或偏酸性环境中,脱色效果较好,在中性或偏碱性环境中,脱色率明显降低,说明活性炭在偏酸性条件下吸附作用较好。而多糖保留率随样液pH值的增大呈先增大后减小趋势,当样液pH值为4.0时,多糖保留率达到最大。综合考虑脱色率和多糖保留率,确定适宜的样液pH值范围为 3.0~5.0。
2.2.5 正交试验设计及结果
正交试验及方差分析结果见表3、表4。

表3 正交试验结果Table 3 Results of orthogonal test
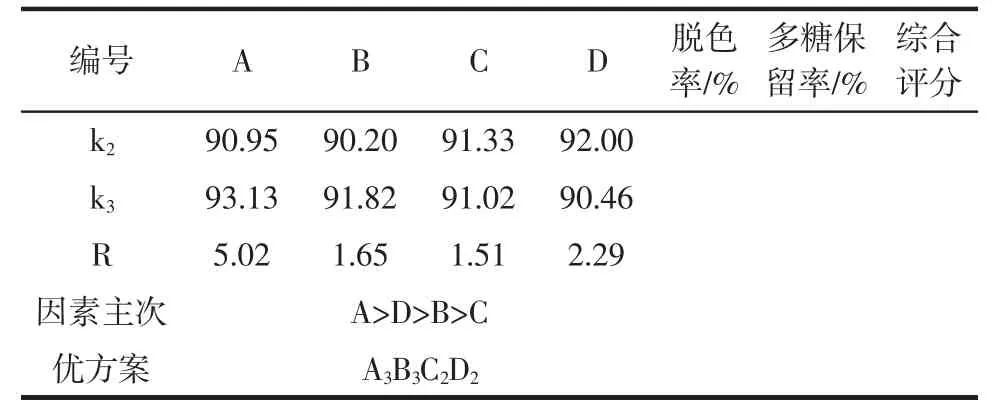
续表3 正交试验结果Continue table 3 Results of orthogonal test
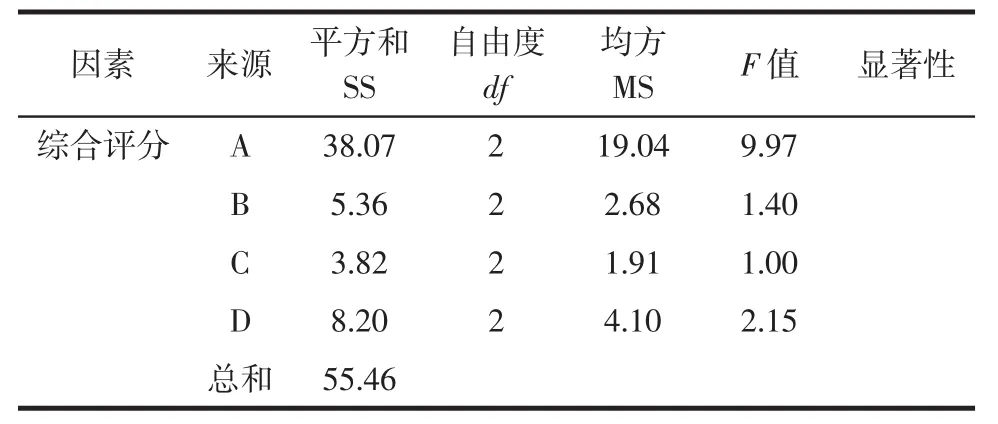
表4 方差分析和显著性检验结果Table 4 Analysis of variance and results of significance test
由表3和表4可知,影响活性炭脱色综合评分的因素大小顺序为:A>D>B>C,即活性炭添加量对脱色效果影响最大,其次为样液pH值,再者为脱色温度,脱色时间对脱色效果影响最小。活性炭脱色的最佳工艺条件为A3B3C2D2,即活性炭添加为量3.0%,脱色温度为60℃,脱色时间为80 min,样液pH值为4.0。按优化的工艺条件下进行3次验证试验,得脱色率为64.60%,多糖保留率为83.97%,表明试验优化的最佳脱色工艺条件可靠。
2.3 菠萝皮渣精多糖体外抗氧化活性分析
DPPH·能与抗氧化物提供的一个电子配对使其特征紫色消失,可根据其褪色程度来间接评价抗氧化物的抗氧化能力。菠萝皮渣精多糖对DPPH·和ABTS+·的清除效果见图12。由图12可知,菠萝皮渣精多糖对DPPH·的清除能力随着多糖质量浓度的增加逐渐增大,并呈现明显的量效关系,在3.0 mg/mL时,清除率达到83.27%,略低于同浓度VC溶液的DPPH·清除率,说明菠萝皮渣精多糖具有良好的体外抗氧化能力。此外,菠萝皮渣精多糖具有一定的清除ABTS+自由基的能力,随着多糖浓度的增加,ABTS+自由基清除率也逐渐增大。当浓度为3.0 mg/mL时,清除率达到49.12%,但低于同浓度VC溶液的ABTS+自由基清除率。
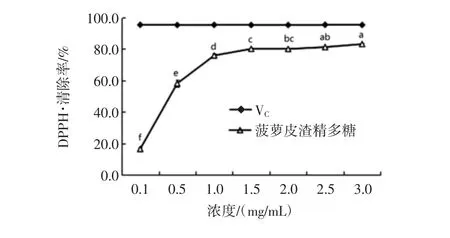
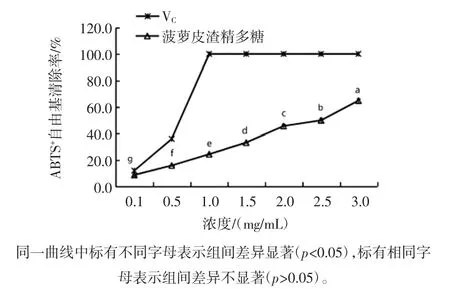
图12 菠萝皮渣精多糖对DPPH·和ABTS+自由基的清除效果Fig.12 Scavenging effects of polysaccharides from pineapple pomace on DPPH·and ABTS+radical
3 结论
本研究采用7种方法对菠萝皮渣粗多糖进行脱蛋白处理,结果表明TCA-正丁醇法的脱蛋白效果较好,其脱蛋白率为81.47%,多糖保留率为85.91%。采用活性炭对脱蛋白后的多糖溶液进行脱色处理,分别考察了活性炭添加量、脱色温度、脱色时间和样液pH值对脱色效果的影响,在单因素试验的基础上采用正交试验优化最佳脱色工艺,结果发现4个因素对脱色效果的影响主次顺序为:活性炭添加量>样液pH值>脱色温度>脱色时间。适宜的脱色工艺为活性炭添加量3.0%,脱色温度60℃,脱色时间80 min,样液pH值4.0,在此条件下,脱色率为64.60%,多糖保留率为83.97%。经初步纯化制得的菠萝皮渣精多糖对DPPH·和ABTS+自由基均有一定的清除作用,在浓度为3.0 mg/mL时,清除率分别为83.27%和49.12%。由此可见,经本研究筛选的脱蛋白、脱色方法切实可行,制得的菠萝皮渣精多糖具有良好的抗氧化活性,可为菠萝皮渣精多糖的工业化生产提供理论参考。

