耐药嗜水气单胞菌毒力与六类抗菌药物耐药元件基因研究
,,,,,,
嗜水气单胞菌是典型的人和动物(含水生动物)共患病病原菌。人肠道感染嗜水气单胞菌可导致腹泻,嗜水气单胞菌亦可导致人皮肤及软组织感染,部分免疫力低下者甚至引发败血症和腹膜炎以及腹腔脏器脓肿[1]。近年来国内有关嗜水气单胞菌的临床报道有所增加[2-5], 嗜水气单胞菌的耐药性虽然远低于革兰氏阴性肠杆菌(如肺炎克雷伯菌和大肠埃希菌及阴沟肠杆菌),但部分嗜水气单胞菌临床分离株对常用的抗菌药物有一定的耐药率[1-5]。近年国内涉及到的嗜水气单胞菌研究注重临床病例报道及耐药性分析[1-5]。李淑妃等作了嗜水气单胞菌的毒力基因研究[6],翁幸鐾等作了嗜水气单胞菌的β-内酰胺类和氨基糖苷类药物的耐药基因研究[7]。国内缺乏耐药嗜水气单胞菌的毒力与耐药元件基因的联合检测研究报道。为此,我们对收集到的10株耐药嗜水气单胞菌进行了3种毒力基因与六类抗菌药物54种耐药元件基因检测,并以1株对常用抗菌药物敏感的嗜水气单胞菌作为参照株。本研究并对全部基因的检测结果分别作样本聚类分析。
1 材料与方法
1.1菌株来源 10株耐药嗜水气单胞菌分离自2014年1月至2017年10月本院内科住院病人,其中血液3例,腹水4例,脓液3例。1株对常用抗菌药物敏感的嗜水气单胞菌亦为同期医院分离的菌株。
1.2药敏试验与AmpC酶三维试验 嗜水气单胞菌13种抗菌药物敏感性试验为K-B药敏纸片法。药敏纸片为英国Oxoid公司产品。10株耐药嗜水气单胞菌敏感试验结果见表1。1株参照株嗜水气单胞菌对该13种抗菌药物均为敏感。本文1、2、5、6、7、9号菌株AmpC酶三维试验呈阳性。
1.3菌体DNA制备 嗜水气单胞菌菌体DNA制备为非离子去污剂裂解联合蛋白酶K消化法。菌体DNA制备试剂盒裂解液A(非离子去污剂)与裂解液B(蛋白酶K)由无锡市克隆遗传技术研究所提供。挑取单个菌落放入菌体DNA制备试剂盒提供的裂解液A(非离子去污剂)与裂解液B(蛋白酶K)混合液中,然后55 ℃水浴裂解消化细菌细胞膜60 min,再95 ℃水浴灭活蛋白酶K活性10 min即为基因检测的模板液。
1.4基因检测 10株耐药嗜水气单胞菌3种毒力基因与6类抗菌药物54种耐药元件基因检测均为PCR法。54种耐药元件基因为参考近年国内外对嗜水气单胞菌耐药基因检测结果[7-9],并参照革兰氏阴性杆菌可能存在的耐药元件基因而确定。实验并设1株对13种抗菌药物均为敏感的嗜水气单胞菌作为参照株。3种毒力基因与六类抗菌药物54种耐药元件基因检测项目见表2。本研究共57种基因引物序列委托无锡新吴区新克隆数据分析工作室设计并获授权使用[7,13]。PCR扩增核心试剂盒由无锡市克隆遗传技术研究所提供。每种毒力与耐药元件基因的PCR扩增体系均为:耐热DNA聚合酶(rTaq DNA pol,日本Takara公司产品)1单位(0.2 μL), 与耐热DNA聚合酶配匹的10倍浓度缓冲液2 μL(日本Takara公司产品);P1引物2 μL(1.0 μmol/L),P2引物2 μL(1.0 μmol/L);dNTPs 2 μL (2 mmol/L);超纯水7 μL,菌株 DNA处理液4.8 μL,合计总体积20 μL。热循环为:95 ℃预变性3 min,然后95 ℃ 0.5 min→55 ℃ 1 min→72 ℃ 1 min,重复30周期,最后一轮72 ℃延长至5 min。PCR扩增产物经1%琼脂糖凝胶电泳40 min,紫外线下凝胶上出现与阳性对照分子量相同的目的条带即判别为阳性。
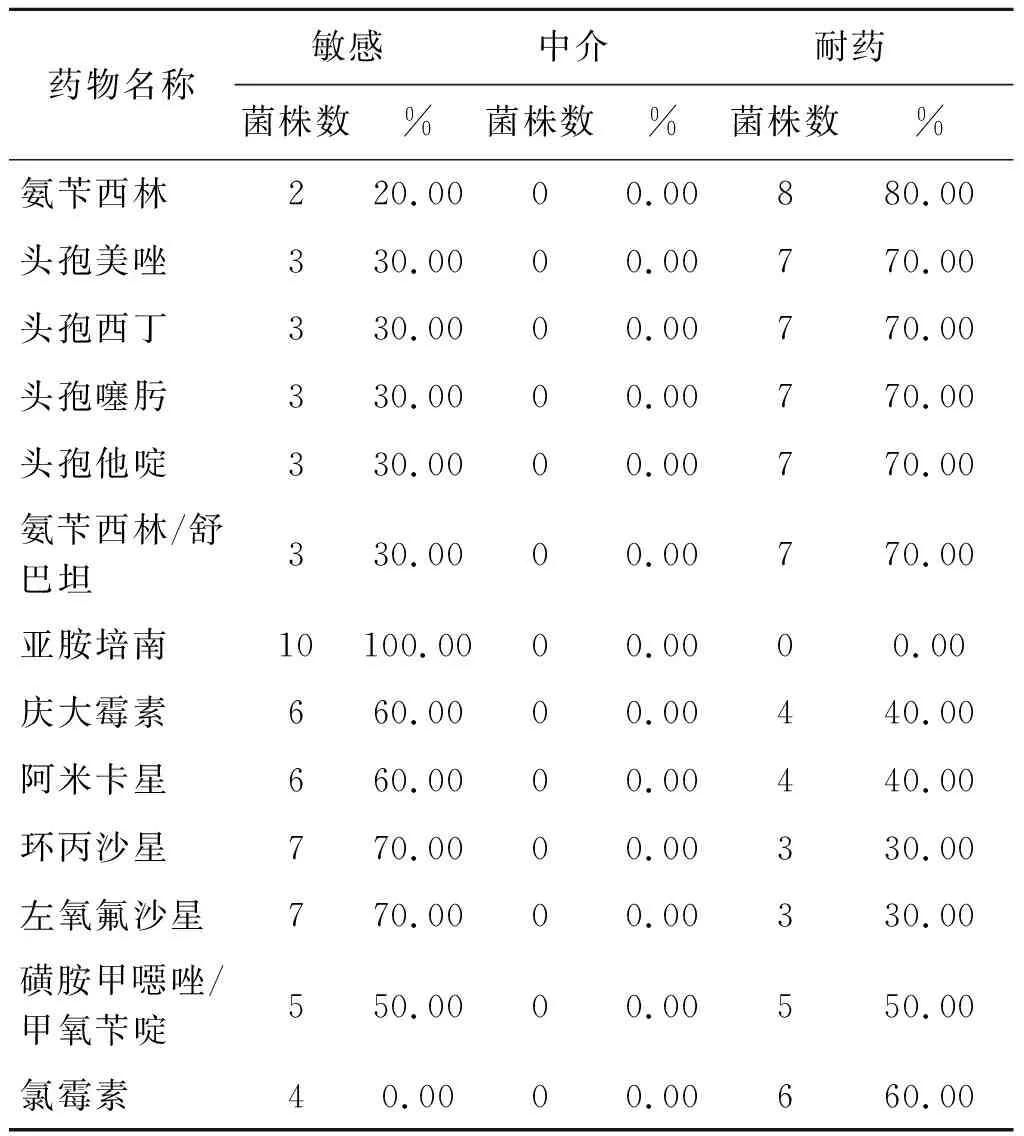
表1 10株嗜水气单胞菌13种抗菌药物敏感性试验结果Tab.1 Results of susceptibility tests of 13 antimicrobialagents from 10 Aeromonas hydrophila strains

blaOXA-2群P1:CAGGCGCYGTTCGYGATGAGTT;P2:GCCYTCTATCCAGTAATCGCC 233blaOXA-10群P1:GTCTTTCRAGTACGGCATTA;P2:GATTTTCTTAGCGGCAACTTA 822氨基糖苷类修饰酶基因(10种)aac(3)-ⅠP1:ACCTACTCCCAACATCAGCC;P2:ATATAGATCTCACTACGCGC 169aac(3)-ⅡP1:ACTGTGATGGGATACGCGTC;P2:CTCCGTCAGCGTTTCAGCTA 237aac(3)-ⅢP1:CACAAGAACGTGGTCCGCTA;P2:AACAGGTAAGCATCCGCATC 185aac(3)-ⅣP1:CTTCAGGATGGCAAGTTGGT;P2:TCATCTCGTTCTCCGCTCAT 286aac(6')-ⅠbP1:ATGACTGAGCATGACCTTGC;P2:TTAGGCATCACTGCGTGTTC 519aac(6')-ⅡP1:TTCATGTCCGCGAGCACCCC;P2:GACTCTTCCGCCATCGCTCT 178ant(3″)-ⅠP1:TGATTTGCTGGTTACGGTGAC;P2:CGCTATGTTCTCTTGCTTTTG 284ant(2″)-ⅠP1:GAGCGAAATCTGCCGCTCTGG;P2:CTGTTACAACGGACTGGCCGC 320aadA5P1:ATGGGTGAATTYTTYCCTGCACAA;P2:TCAACGCAAGATTCTCTCATTCGT 789aph(3')-ⅠP1:ATGTGCCATATTCAACGGGAAACG;P2:TCAGAAAAACTCATCGAGCATCAA 81616SrRNA甲基化酶基因(6种)armAP1:ATGGATAAGAATGATGTTGTTAAG;P2:TTATTTCTGAAATCCACTAGTAATTA 315rmtAP1:CCTAGCGTCCATCCTTTCCTC;P2:AGCGATATCCAACACACGATGG 756rmtBP1:ATGAACATCAACGATGCCCTC;P2:TTATCCATTCTTTTTTATCAAGTATAT 846rmtCP1:ATGAAAACCAACGATAATTATC;P2:TTACAATCTCGATACGATAAAATAC 744rmtDP1:ATGAGCGAACTGAAGGAAAAACTGCT;P2:TCATTTTCGTTTCAGCACGTAAAACAG 774npmAP1:TTGGGTACTGGAGACGGTAG;P2:CAGCTTTGTATTGTTCGCTC 421耐喹诺酮基因(4种)qnrAP1:CAAGAGGATTTCTCACGCCAG;P2:GAACTCTATGCCAAAGCAGTTGG 240qnrBP1:ATGRCTCTGGCAMTMGTTGGCGA;P2:CTARCCAATMAMCGCGATGCCAAG 645gnrSP1:ATGGAAACCTACMRTCAYACATAT;P2:TTAGTCAGGAWAAACAACAATACCC 657qepAP1:GCCGAACGCCGCTGCCGACAG;P2:TGCTGCTGACGCTGGCGCTC 501耐复方新诺明基因(4种)sul1P1:TAGCGAGGGCTTTACTAAGC;P2:ATTCAGAATGCCGAACACCG 300dfrA1P1:TTGTGAAACTATCACTAATGGTAG;P2:CTTGTTAACCCTTTTGCCAGA 480表2(续)基因分类基因家族引物序列(5'-3')长度/bp

dfrA12P1:ATGAACTCGGAATCAGTACGC;P2:TTAGCCGTTTCGACGCGCAT 498dfrA17P1:TTGAAAATWTCATTGATTTCT;P2:TTAGCCTTTTTTCCAAATCTGRTATGT 474耐氯霉素基因(2种)catBP1:CCSAAYATCAARGTWGGGCG;P2:GGCATGAYCATRGCCTCMGA 320cmlAP1:GTTGGCGGTACTCCCTTGCC;P2:GGCCACCTCCCAGTAGAACG 240可移动遗传元件标记基因(7种)traAP1:AAGTGTTCAGGGTGCTTCTGCGC;P2:GTCATGTACATGATGACCATTT 272IS26P1:CACATGAACCCATTCAAAGGCC;P2:TCTTTGCCCGTGGCACATGGATGAA 240IS903P1:GCAATACGCACGCTTTCAGGC;P2:ACTGCACGGTTACGGTCTGCA 240ISEcp1P1:CTTCATTGGCATTGATAAGTTAG;P2:TGTAGCATCGGTTTCCCAGTTTC 299intⅠ1P1:CCGAGGATGCGAACCACTTC;P2:CCGCCACTGCGCCGTTACCA 373intⅠ2P1:CACGGATATGCGACAAAAAGGT;P2:GTAGCAAACGAGTGACGAAATG 789intⅠ3P1:GCCTCCGGCAGCGACTTTCAG;P2:GATGCTGCCCAGGGCGCTCG 433
1.5PCR扩增产物DNA序列测定与分析 本研究抽取部分PCR扩增阳性产物委托铂尚生物技术公司(上海)作DNA序列测定,测得序列在线BLASTn比对确认(www.ncbi.nlm.nih.gov/BLASTn)。
1.6基于基因检测结果的菌株分类 10株耐药嗜水气单胞菌和1株敏感嗜水气单胞菌3种毒力基因与六类抗菌药物54种耐药元件基因检测结果,委托无锡新吴区新克隆数据分析工作室作UPGMA法样本聚类分析,以获得菌株分类结果。
2 结 果
2.1毒力与耐药元件基因检测 10株耐药嗜水气单胞菌检出毒力基因2种,耐药元件基因20种。各种基因阳性率见表3。本研究对部分PCR扩增阳性产物作DNA测序分析,图1~7分别为aerA、blaTEM、blaOXA-1群、aac(3)-Ⅱ、qnrS、catB及cmlA测序图。

注: 本表未列出检测结果为阴性基因的项目

图1 aerA PCR扩增产物测序图(经BLASTn比对确认aerA)Fig.1 aerA PCR amplification product sequencing

图2 blaTEM PCR扩增产物测序图(经BLASTn比对确认blaTEM-1)Fig.2 blaTEM PCR amplification product sequencing

图3 blaOXA-1群 PCR扩增产物测序图(经BLASTn比对确认blaOXA-1)Fig.3 blaOXA-1 group PCR amplification product sequencing

图4 aac(3)-Ⅱ PCR扩增产物测序图(经BLASTn比对确认aac(3)-Ⅱ)Fig.4 aac(3)-II PCR amplification product sequencing
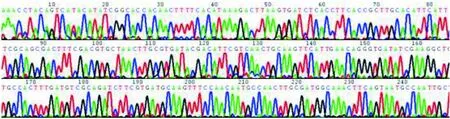
图5 qnrS PCR扩增产物测序图(经BLASTn比对确认qnrS)Fig.5 qnrS PCR amplification product sequencing

图6 catB PCR扩增产物测序图(经BLASTn比对确认catB)Fig.6 catB PCR amplification product sequencing
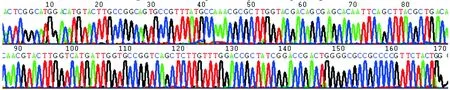
图7 cmlA PCR扩增产物测序图(经BLASTn比对确认cmlA)Fig.7 cmlA PCR amplification product sequencing

表4 10株耐药嗜水气单胞菌和1株敏感嗜水气单胞菌3种毒力基因与6类抗菌药物54种耐药元件基因检测结果经样本聚类分析后的分类状况Tab.4 Classification results of the detection results of 10 resistance genes of 10 strains of resistant Aeromonas hydrophila and 1 sensitive Aeromonas hydrophila and 54 antimicrobial elements of 6 antibiotics
2.2基因检测结果的菌株分类 对10株耐药嗜水气单胞菌和1株敏感嗜水气单胞菌3种毒力基因与六类抗菌药物54种耐药元件基因检测结果作UPGMA法样本聚类分析,由图8可见, 10株耐药嗜水气单胞菌和1株敏感嗜水气单胞菌可分为A与B 2个群。由表4 的为10株耐药嗜水气单胞菌和1株敏感嗜水气单胞菌经基因检测结果样本聚类分析后的分类状况。

注:(图中数字为耐药嗜水气单胞菌之菌株号,S为参照株)图8 10株耐药嗜水气单胞菌和1株敏感嗜水气单胞菌3种毒力基因与六类抗菌药物54种耐药元件基因检测结果样本聚类分析Fig.8 Cluster analysis of the detection results of the resistance genes of 10 strains of resistant Aeromonas hydrophila and 1 strain of sensitive Aeromonas hydrophila and 54 antimicrobial elements of six antibiotics
3 讨 论
嗜水气单胞菌广泛存在于水与土壤等自然界,人感染嗜水气单胞菌后可导致食物中毒(腹泻)等介水传染病,皮肤与软组织感染,严重者可导致败血症等。
嗜水气单胞菌之所以能导致人与动物以及水生动物(鱼、鳝鱼、甲鱼、蛙、大鲵等等)炎症性疾病是因为该菌产多种毒力因子(毒力因子由毒力基因编码)。hlyA基因表达溶血素(hemolysin)可对宿主细胞构成细胞毒性损害。aerA基因表达气溶素(aerolysin),气溶素对宿主细胞具有溶血性、细胞毒性和肠毒性。aerA基因缺失的嗜水气单胞菌毒力减弱。rtxA基因表达产物能导致宿主细胞凋亡[10]。本文对10株耐药嗜水气单胞菌进行了上述3种重要的毒力基因进行了检测,结果为hlyA基因检出率为100.00%,aerA基因检出率为20.00%, 而rtxA基因无检出。即本文10株耐药嗜水气单胞菌中,2株为同时检出hlyA与aerA基因,8株仅检出hlyA基因(见表4)。Soltan等曾报道了嗜水气单胞菌败血症患者分离株aerA基因检出为4/4(100.00%),hlyA基因检出为2/4(50.00%)。
本文10株耐药嗜水气单胞菌由表2 的13种抗菌药物敏感性试验结果可见,除对亚胺培南全为敏感外,对其它种抗菌药物的耐药率在30.00%~80.00%之间,因而本文菌株的耐药性并不低。
本文10株耐药嗜水气单胞菌共检出6种β-内酰胺酶基因(阳性率详见表3),blaAQU与blaMOX基因表达AmpC型β-内酰胺酶,10株中有5株(1、2、5、6、7号菌株)同时检出blaAQU与blaMOX基因(见表4),9号菌株仅检出blaMOX基因(见表4),这6株AmpC酶三维试验均呈阳性。本文10株耐药嗜水气单胞菌共检出5种氨基糖苷类修饰酶基因(阳性率详见表3),共有6株被检出氨基糖苷类修饰酶基因,但2株仅检出ant(3″)-Ⅰ,ant(3″)-Ⅰ型修饰酶仅能灭活链霉素(不能灭活庆大霉素与阿米卡星),因此本文6株被检出氨基糖苷类修饰酶基因的菌株只有4株菌耐庆大霉素与阿米卡星,该4株菌同时检出多种修饰酶基因(3、5、9、10号株, 见表4)。本文菌株没有检出16S rRNA甲基化酶基因,与 Moura等的报道不同[8]。另外,本文菌株耐喹诺酮基因检出qnrS与qepA,耐复方新诺明基因sul1与dfrA1,耐氯霉素基因catB与cmlA。上述3类抗菌药物的耐药基因检出率与耐药率基本一致(见表1和表4)。综上可见, 10株耐药嗜水气单胞菌共检出β-内酰胺类、氨基糖苷类、喹诺酮类、磺胺类、氯霉素类等5类抗菌药物17种获得性耐药基因。这些获得性耐药基因往往由可移动遗传元件介导,本研究检测了7种可移动遗传元件标记基因,有5株检出1~3种可移动遗传元件标记基因(见表4)。
1株敏感嗜水气单胞菌没有检出任何耐药元件基因,仅检出hlyA基因(见表4)。由基因检测结果样本聚类分析显示,它仅与8号株有较近的亲缘关系。
本文对10株耐药嗜水气单胞菌经3种毒力基因与54种耐药元件基因同步检测显示,每株至少检出1种毒力基因和2种耐药基因,这一现象在国内为首次报道。嗜水气单胞菌对抗菌药物的耐药率上升必须严密监测,国内已发现携带mcr-5基因而耐多粘菌素的嗜水气单胞菌菌株[12]。

