冬虫夏草水提物HPLC指纹图谱及模式识别分析
, , ,, ,*
(1.贵州师范大学生命科学学院,贵州贵阳 550025;2.中山大学生命科学学院,广东广州 510275;3.贵州师范学院化学与生命科学学院,贵州贵阳550018)
冬虫夏草是一种虫生子囊真菌,主产于青藏高原海拔3000~5000 m的高寒草甸地区[1],是我国传统名贵中药材,具有保肺、益肾、止血、化痰等功效,主要用于肾虚精亏,阳萎遗精,腰膝酸痛,久咳虚喘等症[2]。由于生长环境严苛,生长周期长,加之过度采挖,造成冬虫夏草资源稀缺,价格昂贵,因此市场上出现了多种混淆品,如蛹虫草、亚香棒虫草和冬虫夏草发酵菌丝体等,它们与冬虫夏草相似性较高,采用目前《中国药典》中的性状鉴别和腺苷含量测定法难以有效区分[3-4],药材误用混用现象时常发生,严重影响了冬虫夏草临床使用的安全性和有效性。因此,建立一种能有效鉴别冬虫夏草与其类似品的质量评价方法,对规范冬虫夏草药材市场十分必要。
中药HPLC指纹图谱是一种针对复杂组分的分析方法,根据物质的化学组成特征使用特定方法进行分离并测定,具有同时关注多种成分的特点,比传统单一成分测定法所得信息更多,更容易寻找到样品之间化学成分群的微小差异,从而实现药材的区分鉴定与品质评价[5]。HPLC法具有操作简便、分析速度快、稳定性好等特点,是目前的中药材指纹图谱分析最常使用的方法,采用该方法建立的标准指纹图谱目前已广泛应用多种中药材的质量评价与控制[6-7]。目前已有冬虫夏草HPLC指纹相关研究多关注冬虫夏草与其他虫草属真菌的真伪鉴别[8-11],较少开展冬虫夏草与其发酵菌丝体系统比较。
本实验拟选取19批次冬虫夏草和冬虫夏草菌丝体,建立冬虫夏草水溶性成分HPLC特征指纹,利用相似度评价法和化学模式识别法对冬虫夏草和冬虫夏草菌丝体指纹图谱进行综合评价,为冬虫夏草质量控制提供科学依据。
1 材料与方法
1.1 材料与仪器
冬虫夏草样品 采集自青藏高原典型产区,经中山大学青藏高原研究团队刘昕教授、张古忍教授鉴定为冬虫夏草(Ophiocordycepssinensis)寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体;冬虫夏草无性型中国被毛孢(Hirsutellasinensis)菌株C-YS和C-LZ 分离自青海玉树和西藏林芝自然环境生长的新鲜冬虫夏草,菌株保藏在中山大学食品与健康工程研究院;冬虫夏草菌丝体工业发酵产品“百令胶囊” 杭州中美华东制药有限公司,批号140503,购自广州市药店,样品详细信息见表1;腺苷、肌苷、胞苷、尿苷、鸟苷、胸腺嘧啶、次黄嘌呤、虫草素对照品 均购于Sigma-Aldrich公司(纯度均≥98%,批号分别为WXBB2139V,016K0037,C122106-1G,SLBD9919V,SLBC0093V,T0376-5G,074K0619,M4030V);甲醇 色谱级,德国Merck公司;实验用水 为经Millipore Simplicity system处理后的超纯水;蛋白胨、酵母提取物、琼脂粉 英国OXOID公司;葡萄糖、蔗糖 广州化学试剂厂;马铃薯 广州百佳超市;其他试剂 均为分析纯。
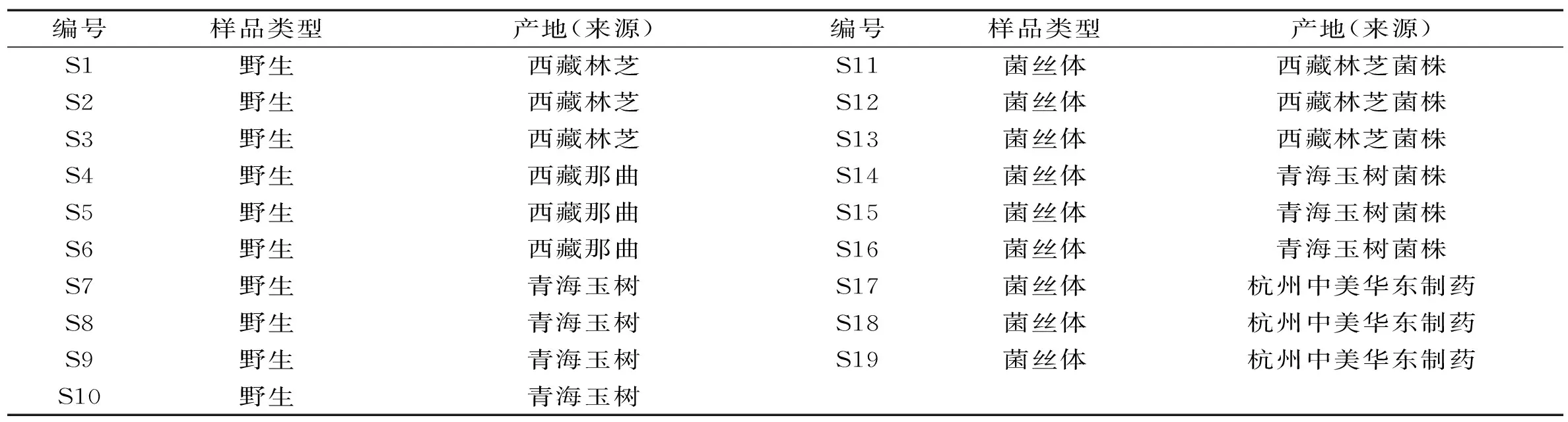
表1 冬虫夏草和冬虫夏草菌丝体样品来源Table 1 Origins of the O. sinensis and fermentation mycelium
高效液相色谱系统(1525二元泵-2996光电二极管阵列检测器(Photodiode Array Detector,PDA)) 美国Waters公司;Simplicity型超纯水系统 美国Millipore公司;5415R型冷冻高速离心机 德国Eppendorf公司;DK-8D型恒温水浴锅 上海一恒科技有限公司;SB-3200型超声波清洗器 上海新芝生物技术研究所;BP211D型密电子分析天平 德国Sartorius公司;QL-901型涡旋振荡仪 江苏海门其林贝尔公司。
1.2 实验方法
1.2.1 冬虫夏草菌丝体制备 取适量保存菌种接种到固体种子培养基(马铃薯300 g/L,葡萄糖20 g/L,蛋白胨10 g/L,酵母提取物1 g/L,琼脂粉15 g/L),于18 ℃培养30 d后,接种到液体培养基中(马铃薯300 g/L,葡萄糖20 g/L,蛋白胨10 g/L,酵母提取物1 g/L,KH2PO41 g/L,MgSO4(7H2O 0.5 g/L),120 r/min,18 ℃培养20 d即为液体种子。吸取5 mL液体种子接种到培养基(蔗糖50 g/L,蛋白胨10 g/L,酵母提取物3 g/L),120 r/min,18 ℃培养40 d。发酵结束后,使用低压抽滤法收集菌丝体。菌丝体用超纯水清洗3次以上,再经冷冻干燥后,研磨成细粉密封保存备用。
1.2.2 色谱条件 Agilent Eclipse XDB C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为甲醇(A)-0.3%乙酸溶液(B),梯度洗脱(0~10 min,0% B;10~20 min,0%~8% B,20~30 min,8%~20% B;30~40 min,20% B),流速1.0 mL·min-1,进样量20 μL,柱温25 ℃,检测波长260 nm。
1.2.3 对照品溶液制备和线性关系考察 分别取对照品腺苷、肌苷、胞苷、尿苷、鸟苷、胸腺嘧啶、次黄嘌呤、虫草素各15 mg,加入适量去离子水溶解样品,定容至25 mL,配成浓度分别为100、75、50、25、10、5、1、0.5 μg/mL 的混合对照品溶液,过0.45 μm滤膜后,按照1.2.2项下方法进行HPLC测定,每个浓度重复检测3次。以色谱峰积分面积为纵坐标,标准液浓度为横坐标,进行线性回归分析。
1.2.4 供试品溶液制备 称量已研磨成细粉的冬虫夏草和冬虫夏草菌丝体样品0.25 g,加入超纯水10 mL,称量总质量,于50 ℃,30 kHz超声提取40 min,放置至室温,用水补足损失重量,混匀,过0.45 μm滤膜,即得。
1.2.5 方法学考察
1.2.5.1 精密度实验 取S4号冬虫夏草供试品,按照1.2.4项下方法制备供试品溶液,按照1.2.2项下的方法连续进样6次,记录HPLC指纹图谱,计算各共有峰相对峰面积和相对保留时间的RSD值。
1.2.5.2 稳定性实验 取S4号冬虫夏草供试品,按照1.2.4项下方法制备供试品溶液,分别在0、2、6、12、18、24 h后按照1.2.2项下的方法进行检测,记录HPLC指纹图谱,计算各共有峰相对峰面积和相对保留时间的RSD值。
1.2.5.3 重复性实验 取S4号冬虫夏草供试品,按照1.2.4项下方法制备供试品溶液,平行6次试验,按照1.2.2项下的方法分别进样记录每份样品的HPLC指纹图谱,计算各共有峰相对峰面积和相对保留时间的RSD值。
1.2.5.4 加样回收率实验 取已知胞苷、尿苷、肌苷、鸟苷和腺苷含量的冬虫夏草供试品(S4号)6份,加入超纯水9 mL,再加入200 μg/mL混合对照品溶液1 mL,按1.2.4项下方法制备供试液,按1.2.2项下的色谱条件进行测定,计算加样回收率。
1.3 数据处理
采用中药《中药色谱指纹图谱相似度评价系统》(2004 A版)进行冬虫夏草指纹图谱相似度计算。采用SPSS 22.0软件进行系统聚类分析和t检验,采用SIMCA-P 13.0软件进行主成分分析。
2 结果与分析
2.1 线性关系考察
根据不同浓度混合对照品色谱峰积分面积计算得到胞苷、尿苷、肌苷、鸟苷和腺苷的线性回归方程分别为y=38761x+2403,y=44565x+3085,y=32631x+2924,y=52077x+1884.6和y=88285x+5120,各待测成分的线性相关系数均大于0.999,表明在浓度为0.5~100 μg/mL范围内曲线线性关系良好。
2.2 方法学考察
精密度实验所得图谱相似度均大于0.999,各共有峰的相对保留时间RSD为0.21%~1.00%,相对峰面积RSD为0.87%~2.99%;稳定性实验所得图谱相似度均大于0.999,各共有色谱峰相对保留时间RSD为0.38%~0.97%,相对峰面积RSD为0.99%~3.04%;重复性实验所得图谱相似度均大于0.995,各共有峰的相对保留时间RSD为0.29%~1.05%,相对峰面积RSD为1%~3.16%;加样回收率实验结果显示,胞苷、尿苷、肌苷、鸟苷和腺苷的加样回收率分别为101.48%±2.89%,103.36%±1.43%,103.96%±2.45%,107.23%±2.92%和104.67%±2.38%,RSD分别为2.84%,1.38%,2.36%,2.72%和2.27%。结果表明仪器的精密度良好,方法重现性较高,供试品溶液在24 h内保持稳定,符合指纹图谱的要求。
2.3 冬虫夏草HPLC指纹图谱的建立及相似度评价
2.3.1 指纹图谱建立与共有峰标定 取10批冬虫夏草样品,按照1.2.4项下方法制备供试品溶液,再按照1.2.2项下的方法进行检验,记录其色谱图,导入《中药色谱指纹图谱相似度评价系统》(2004 A版),样品匹配色谱图见图1。以S4号样品的HPLC图谱作为参照图谱,采用中位数法生成冬虫夏草对照指纹图谱,共获得18个共有峰,并指定出其中5个共有峰,分别为胞苷(5号峰),尿苷(9号峰),肌苷(12号峰),鸟苷(13号峰)和腺苷(14号峰),见图2。每批样品共有峰面积均占总色谱峰面积的90%以上,满足指纹图谱分析要求。以分离度较好、峰面积较大且保留时间适中的9号峰为参照峰,分别计算10批冬虫夏草共有指纹峰的相对保留时间和相对峰面积,结果显示各批样品共有峰相对保留时间RSD为0.424%~5.572%,相对峰面积RSD为18.858%~116.12%,见表2、表3。
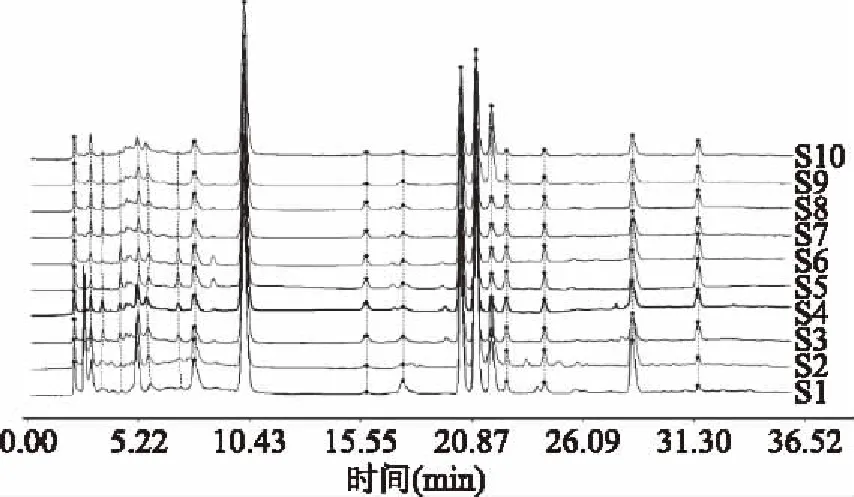
图1 10批冬虫夏草样品的HPLC指纹谱Fig.1 HPLC fingerprints of 10 batches of O. sinensis
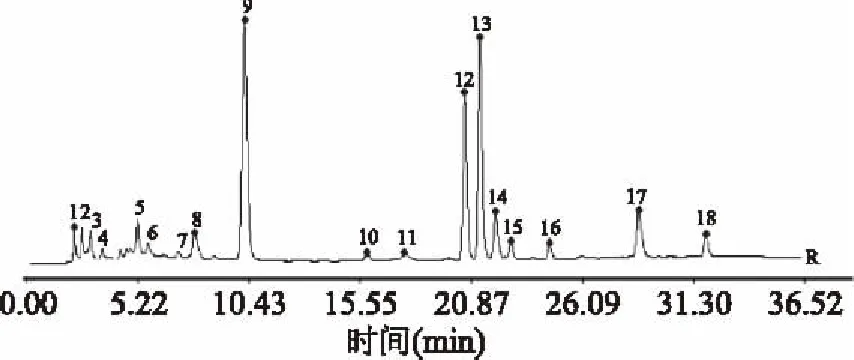
图2 冬虫夏草HPLC 对照指纹谱Fig.2 Common mode of HPLC fingerprints of O. sinensis注:5.胞苷;9.尿苷(参照峰);12.肌苷;13.鸟苷;14.腺苷。
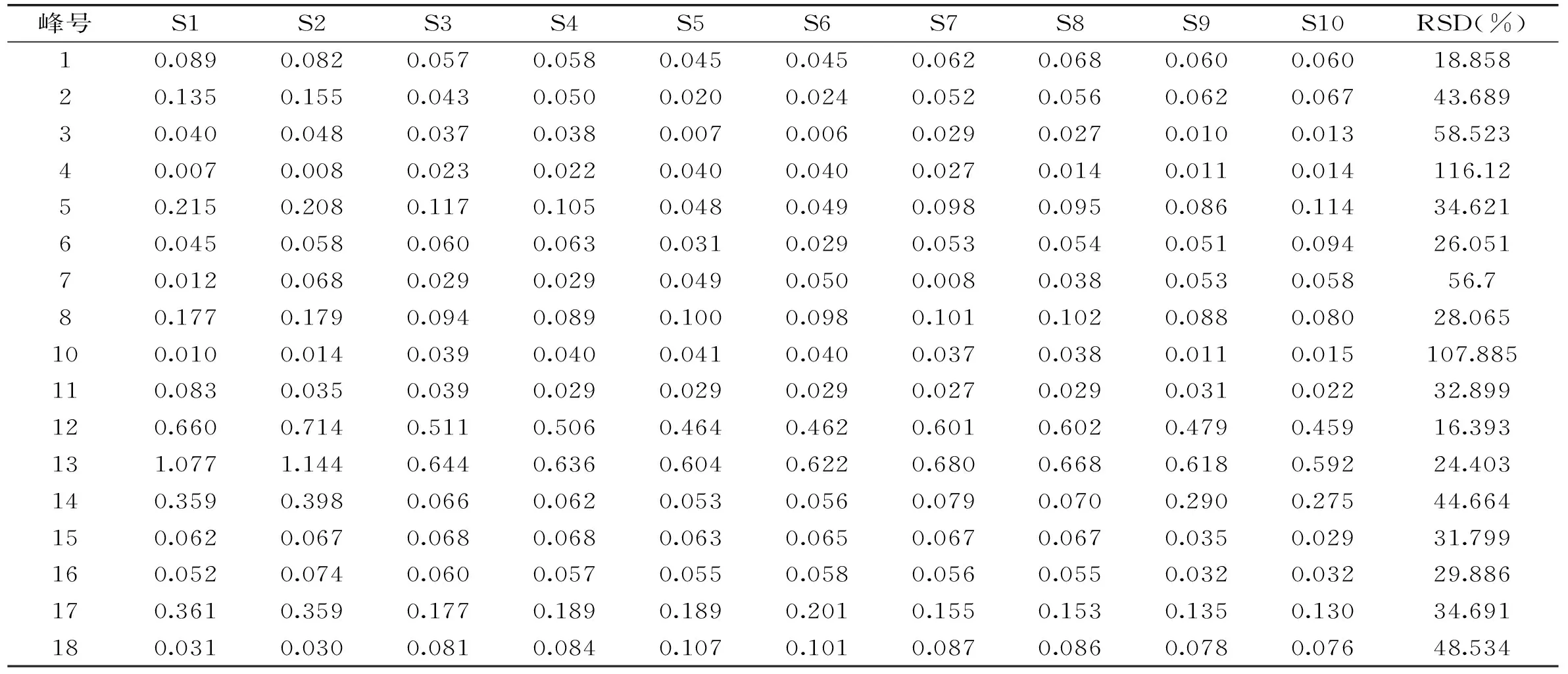
表2 10批冬虫夏草HPLC指纹图谱中共有峰相对峰面积Table 2 Relative peak area of common peaks in 10 batches of O. sinensis
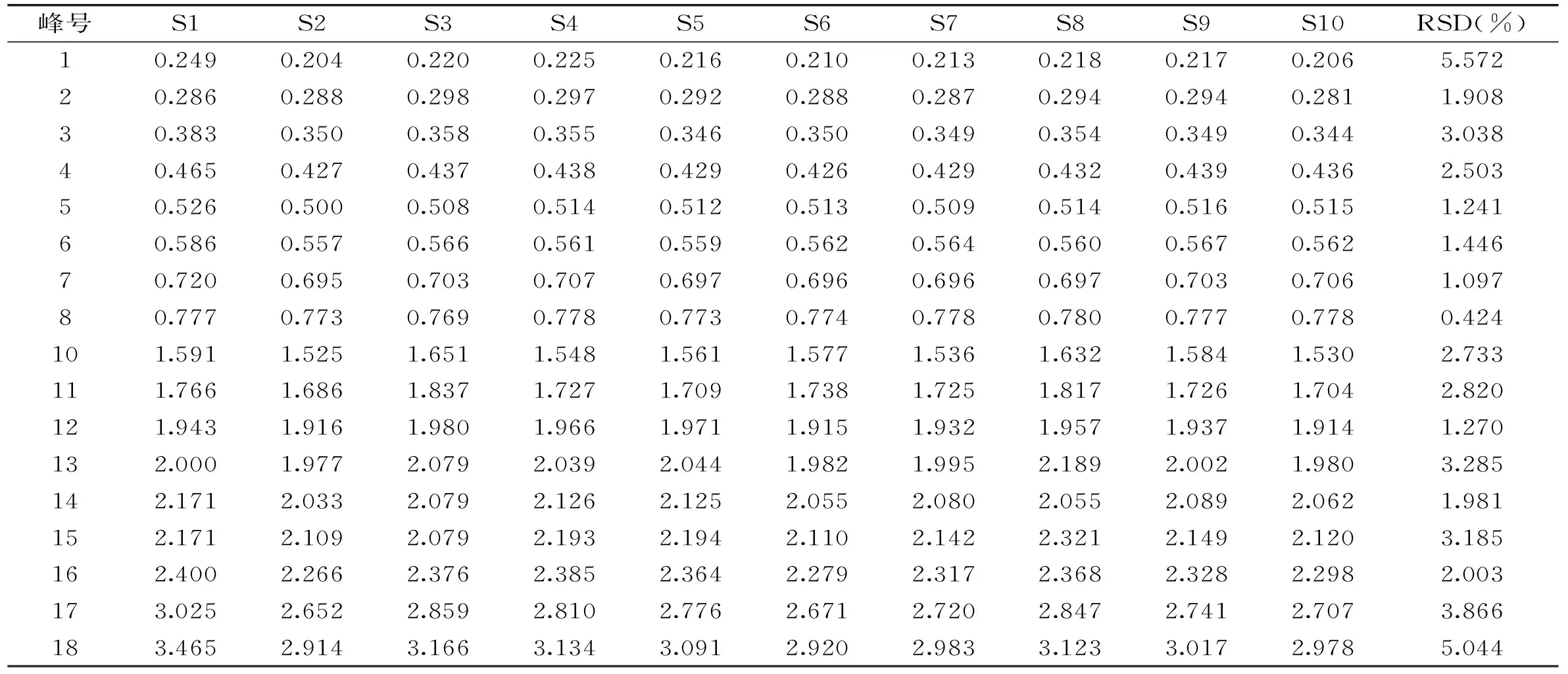
表3 10批冬虫夏草 HPLC 指纹图谱中共有峰相对保留时间Table 3 Relative retention time of common peaks in 10 batches of O. sinensis
2.3.2 指纹图谱相似度评价 取9批不同来源的冬虫夏草菌丝体样品,按照1.2.4项下方法制备供试品溶液,再按照1.2.2项下的方法进行检验,记录样品色谱图,导入《中药色谱指纹图谱相似度评价系统》(2004 A 版),以冬虫夏草对照指纹为参照谱进行多点校正,匹配后共获得9个共有峰,共指认出其中5个共有峰,分别为胞苷、尿苷、肌苷、鸟苷和腺苷,图3为匹配后色谱图。9批冬虫夏草菌丝体中主要色谱峰为尿苷、鸟苷和腺苷,而冬虫夏草中含量较高的肌苷微量存在于菌丝体中,表明肌苷可能是冬虫夏草区别于菌丝体的特征性成分。以4号峰为参照峰计算得到9批冬虫夏草菌丝体共有指纹峰相对峰面积RSD为26.162%~65.246%,见表4。采用中药色谱指纹图谱相似度评价系统计算19批冬虫夏草及其菌丝体的相似度,结果见表5。与对照指纹图谱相比,10批冬虫夏草的相似度为0.964~0.993,而9批冬虫夏草菌丝体的相似度为0.563~0.693,表明冬虫夏草菌丝体与冬虫夏草水溶性成分存在较大差异,根据指纹图谱特征可进行有效区分。
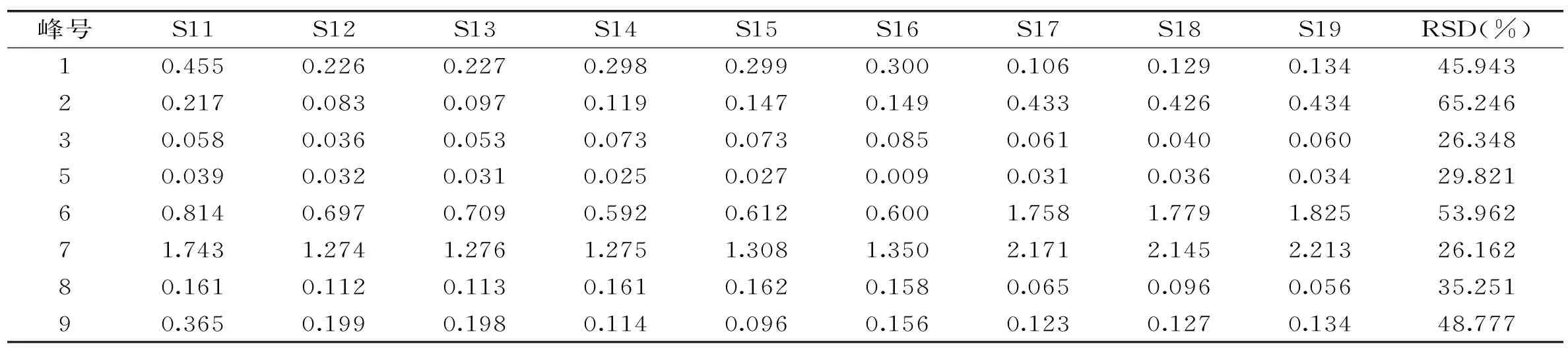
表4 9批冬虫夏草菌丝体 HPLC 指纹图谱中共有峰相对峰面积Table 4 Relative peak area of common peaks in 9 batches of cultivated mycelium
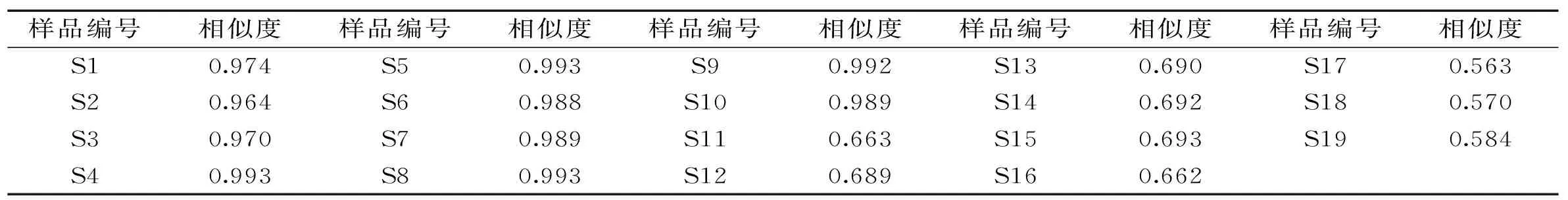
表5 冬虫夏草及冬虫夏草菌丝体样品相似度评价结果Table 5 Similarities of fingerprints of 19 batches O. sinensis and cultivated mycelium
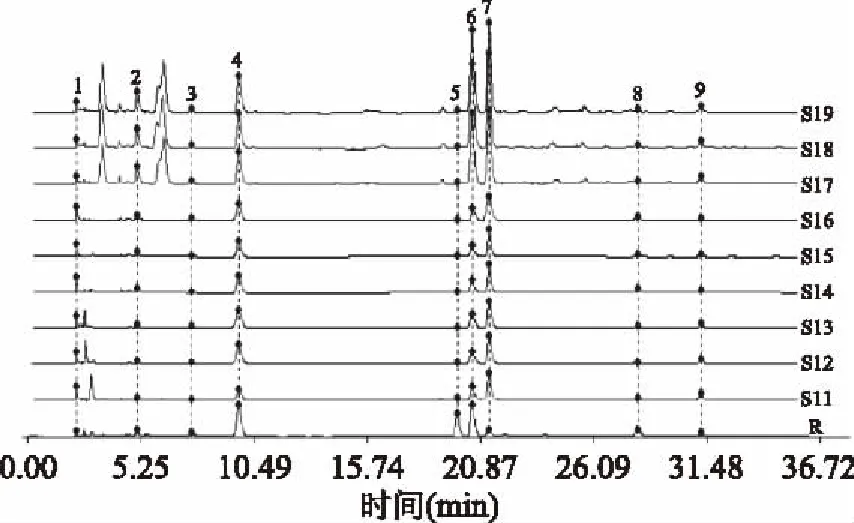
图3 9批冬虫夏草菌丝体的HPLC指纹谱Fig.3 HPLC fingerprints of 9 batches of cultivated mycelium注:2.胞苷;4.尿苷(参照峰);5.肌苷;6.鸟苷;7.腺苷。
2.3.3 含量测定结果 按照外标法计算19批样品中胞苷、尿苷、肌苷、鸟苷和腺苷含量,结果见表6。将所有样品分为冬虫夏草和菌丝体两个组进行独立样本t检验,结果显示冬虫夏草中肌苷和尿苷含量显著高于冬虫夏草菌丝体,腺苷含量显著低于冬虫夏草菌丝体,胞苷和鸟苷含量在两组样品之间无显著差异。
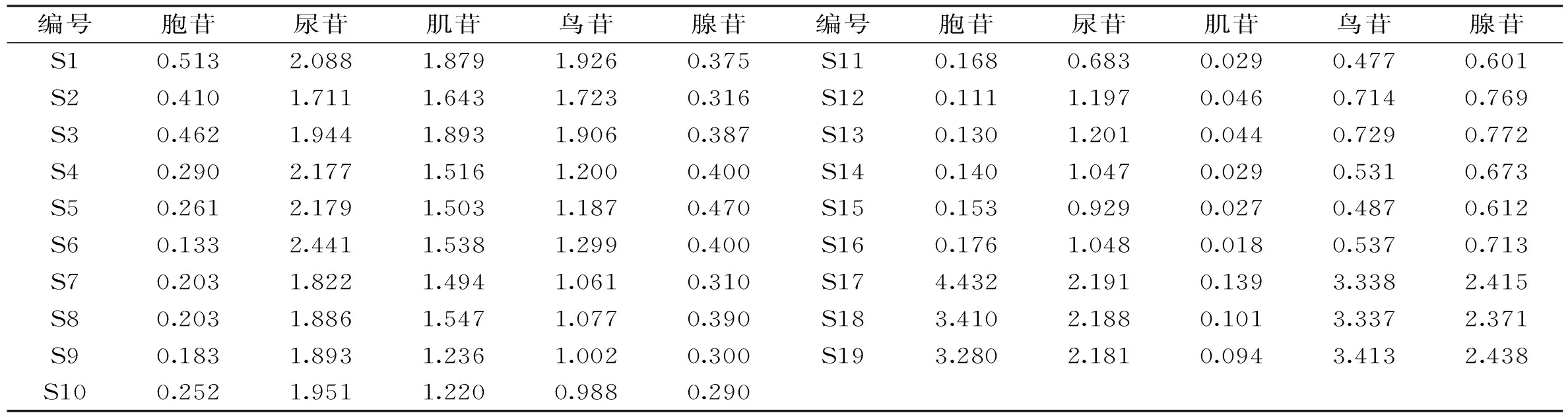
表6 19批冬虫夏草和冬虫夏草菌丝体中胞苷、尿苷、肌苷、鸟苷和腺苷含量测定结果(mg/g)Table 6 Determination results of cytidine,uridine,inosine,guanosine and adenosine in 19 batches of samples(mg/g)
2.4 模式识别分析
2.4.1 主成分分析 利用SIMCA-P 13.0软件,以冬虫夏草和冬虫夏草菌丝体色谱图中的18个共有峰积分面积为变量对样品进行主成分分析。前3个主成分方差贡献率分别为56.6%,26.6%和7.53%,累积方差贡献率达90.7%,因此提取前3个主成分对样品进行分析,结果见图4。冬虫夏草与冬虫夏草菌丝体在主成分得分图上分为3类,冬虫夏草单独为1类(S1~S10),S11~S16号冬虫夏草菌丝体为1类,S17~S19号发酵产品百令胶囊为1类。
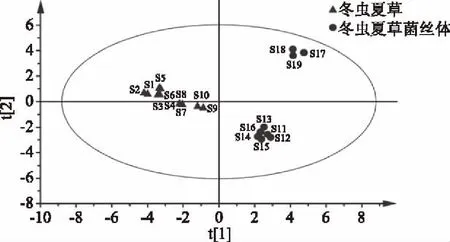
图4 冬虫夏草和冬虫夏草菌丝体主成分得分图Fig.4 PCA score scatter plot of O. sinensis and cultivated mycelium
2.4.2 聚类分析 运用SPSS 22.0软件,以冬虫夏草和冬虫夏草菌丝体色谱图中的18个共有峰积分面积为变量,进行Z得分标准化处理后,采用组间平均数联结法,以欧氏距离为样品亲疏关系度量标准进行聚类分析,结果见图5。当距离为16时,所有样品分为3类,其中冬虫夏草为1类(S1~S10),实验室培养冬虫夏草菌丝体为1类(S11~S16),工业发酵菌丝体产品为1类(S17~S19)。聚类分析结果与主成分分析结果基本一致,能够实现基于指纹特征的样品分类。
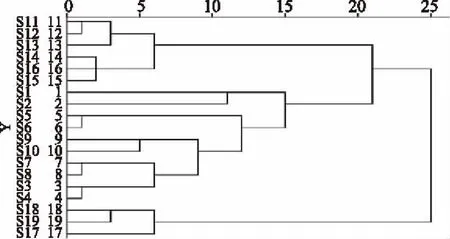
图5 冬虫夏草和冬虫夏草菌丝体聚类分析树状图Fig.5 Dendrogram of cluster analysis of O. sinensis and cultivated mycelium
3 结论
本研究采用HPLC指纹图谱结合相似度评价、化学模式识别方法对不同来源冬虫夏草进行分析,对19批冬虫夏草和冬虫夏草菌丝体进行综合评价,从化学层面揭示了冬虫夏草与其发酵菌丝体之间的内在品质差异,为冬虫夏草质量评价提供一种有效方法。不同产地批次冬虫夏草指纹一致性较高,表明所含化学成分基本相同;冬虫夏草与冬虫夏草菌丝体指纹相似度较低,共有成分中肌苷、腺苷和尿苷含量差异显著,它们可能是导致两组样品区分的重要特征成分。本研究只对冬虫夏草水溶性指纹中核苷类成分进行了指认,而提取物中其他化合物的表征和其对冬虫夏草质量的影响,有待进一步研究探讨。

