基于聚乙二醇/水体系的菠萝蜜果皮多糖提取及其抗氧化活性研究
,,,,
(海南大学食品学院,海南海口 570228)
菠萝蜜(ArtocarpusheterophyllusLam.)又称木菠萝、树菠萝等,属于桑科木菠萝属。被誉为“热带水果皇后”的菠萝蜜是华南地区主要的热带水果之一。热带地区菠萝蜜种植面积已经超过20万亩[1]。在菠萝蜜的加工和生产中,副产物果皮(约42%)多作为废弃物丢弃[2]。废弃果皮不仅浪费资源,还可能对环境造成破坏。菠萝蜜果皮活性物质的研究多集中在多酚类化合物和总黄酮上[3-4]。菠萝蜜果皮中活性物质的应用潜力和发展价值还未被充分挖掘。近年来,植物多糖因具有抗炎、抗病毒、抗肿瘤、降血糖和抗氧化等作用成为研究热点。而当前关于菠萝蜜果皮多糖的研究甚少,且提取方法较为单一,主要以酸提取法为主[5-6],且存在提取时间较长、耗能高和酸碱试剂对环境造成的污染等问题。
不同于双水相体系使用的高分子量聚乙二醇(Da≥6000)[7],低分子量(Da≤1000)的聚乙二醇(polyethylene glycol,PEG)/水体系作为绿色溶剂,它与水和有机溶剂均有很好的相溶性,良好的生物降解能力、完全无卤和非挥发性等优点[8-9],受到国内外研究者广泛关注。此外,PEG/水体系在超声波中有较好的能量耗散,且在酸性、氧化还原体系和高温中具有较高的稳定性。因此,PEG/水体系可以作为一种安全、有效和温和的萃取溶剂[10]。低分子量(Da≤1000)PEG/水体系已经在石榴皮和银耳等天然产物的多糖提取中取得了较好的效果[11-13]。此外,超声-微波协同提取法(ultrasound-microwave assisted extraction,UMAE)充分结合了微波的高能作用和超声波的空化作用,已经广泛应用于多糖提取上[14-15]。
本文旨在研究超声-微波协同低分子量(Da<1000)PEG/水体系提取菠萝蜜果皮多糖的效果,并与纯水作提取溶剂进行比较分析,初步探究PEG/水体系对多糖提取效果的影响。为提取菠萝蜜果皮多糖提供新方法,充分发挥废弃菠萝蜜果皮价值,探索解决食品加工中废弃物污染问题。
1 材料与方法
1.1 材料与仪器
菠萝蜜果皮品种 为马来西亚1号由海南大学百果园水果市场提供;不同分子量聚乙二醇、葡萄糖分析标准品 麦克林试剂有限公司;水杨酸钠1,1-二苯基-2-三硝基苯肼(DPPH) 源叶生物有限公司;三氯甲烷纯度≥99%、丙酮纯度≥99.5%、无水乙醇纯度≥99.7%、三氯化铁纯度≥99%、抗坏血酸纯度≥99.7%、苯酚纯度≥99%、铁氰化钾纯度≥99.5% 西陇化工股份有限公司;所用试剂 均为分析纯(AR)。
IKA A11分析用研磨机 艾卡仪器设备有限公司;CW-2000型超声-微波协同萃取仪 上海新拓微波溶样测试技术有限公司;FDU-2100冷冻干燥机 埃朗科(上海)国际贸易有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂;L500型离心机 湖南湘仪有限公司;TU-1810型紫外可见分光光度计 北京普析有限责任公司;PL303电子天平 梅特勒-托利多(上海)有限公司。
1.2 实验方法
1.2.1 原料的预处理 菠萝蜜果皮洗净后60 ℃烘干、粉碎后过60目筛。取适量果皮粉在75 ℃下,使用80%乙醇回流5 h除去糖类杂质,于55 ℃,48 h下烘干后备用。
1.2.2 菠萝蜜果皮多糖提取工艺 多糖提取工艺参考文献[16]并作适当修改。萃取仪在工作模式下,超声波频率和功率自动固定为40 kHz和50 W。取适量果皮粉于250 mL超声-微波协同萃取仪玻璃容器中,分别以PEG/水体系和纯水作为提取溶剂,按设定条件提取菠萝蜜果皮中的多糖。提取完成后冷却至室温,提取液4800 r/min离心15 min,上清液浓缩后加入4倍体积的无水乙醇(终浓度为80%),在4 ℃下静置沉淀12 h,4000 r/min离心12 min后弃去上清液,所得沉淀用95%(v/v)乙醇和丙酮洗涤数次,冷冻干燥后得到菠萝蜜果皮多糖JFP-P(PEG/水体系作提取溶剂)和JFP-W(纯水作提取溶剂)。
1.2.3 超声-微波协同提取菠萝蜜果皮多糖单因素实验 以菠萝蜜果皮粉末为原料,分别研究PEG分子量、PEG浓度、微波功率、提取时间、料液比对多糖得率的影响。提取基本条件为:PEG-200/水体系、浓度0.3 g·mL-1、微波功率65 W、提取时间30 min、料液比1∶40 (g/mL)。各因素水平为:PEG分子量200、400、600、800 Da;PEG浓度0.1、0.2、0.3、0.4、0.5 g·mL-1;微波功率45、55、65、75、85 W;提取时间10、20、30、40、50 min;料液比1∶20、1∶30、1∶40、1∶50、1∶60 (g/mL)。
1.2.4 响应面法试验设计 在单因素实验的基础上,分别以PEG-200/水体系浓度、微波功率、提取时间和料液比为自变量,以多糖得率为响应值,采用Design-Expert 8.0.6软件进行响应面分析,对超声-微波协同提取工艺参数进行优化,试验因素及水平见表1。
1.2.5 菠萝蜜果皮多糖得率的计算 以葡萄糖为标准品,采用苯酚-硫酸法测定多糖含量[17]。按照下式计算菠萝蜜果皮多糖得率:

1.2.6 菠萝蜜果皮多糖体外抗氧化活性测定
1.2.6.1 DPPH自由基清除活性 参考Li等[18]的方法加以改进,4 mL不同浓度多糖样品液(0.25、0.5、1.0、1.5、2 mg/mL)分别混合1 mL 0.2 mmol/L的DPPH自由基甲醇溶液,混合物在室温下剧烈摇动后,在室温下保持30 min,于517 nm波长测定吸光度。抗坏血酸作为阳性对照,清除活性计算如下:
DPPH自由基清除率(%)=[1-(A1-A0)/A2]
式(1)
式中,A0为样品的吸光度(不含DPPH溶液的样品);A1为样品液混合DPPH的吸光度;A2为DPPH溶液的吸光度。
1.2.6.2 羟基(OH)自由基清除活性 参考Sun等[19]的方法加以改进,1 mL不同浓度多糖样品液(0.25、0.5、1.0、1.5、2 mg/mL)分别加入6 mmol/L硫酸亚铁溶液1 mL,6 mmol/L水杨酸-乙醇溶液1 mL,和6 mmol/L过氧化氢溶液1 mL后立即混匀,37 ℃水浴1 h,在536 nm处测定吸光度(A0),以抗坏血酸为阳性对照。
OH自由基清除率(%)=[1-(A0-A1)/A2]×100
式(2)
式中,A1为蒸馏水替代过氧化氢溶液的吸光度值,A2为蒸馏水代替多糖样品液的吸光度值。
1.2.6.3 还原力的测定 参考Lin等[20]的方法稍作修改,1 mL不同浓度多糖样品液(0.25、0.5、1.0、1.5、2 mg/mL)分别加入1%铁氰化钾1 mL和磷酸盐缓冲液(0.2 mol/L,pH6.6)1 mL,充分混匀后,50 ℃水浴20 min,加入10%三氯乙酸1 mL,5000 r/min离心10 min,收集1 mL上清液,加入蒸馏水1 mL和0.1%的氯化铁1 mL,混合后室温下静置10 min,在700 nm处测定吸光度,抗坏血酸作阳性对照,蒸馏水作空白对照。
1.2.7 菠萝蜜果皮多糖红外光谱分析 将响应面优化工艺所得多糖JFP-P和JFP-W分别与溴化钾固体粉末混匀,研磨后压片,在4000~500 cm-1内进行红外光谱扫描。
1.2.8 菠萝蜜果皮多糖紫外光谱分析 将响应面优化工艺所得多糖JFP-P和JFP-W分别配制成1 mg/mL溶液,使用紫外分光光度计在波长200~700 nm范围内扫描。
1.3 数据处理
采用Design-Expert 8.0.6、SPSS 17.0和Origin 9.0软件对数据进行处理分析和作图。
2 结果与分析
2.1 超声-微波协同提取菠萝蜜果皮多糖单因素实验结果
2.1.1 PEG分子量对多糖得率的影响 如图1所示,实验表明PEG-200/水体系作为提取溶剂时,多糖得率最高,与纯水作溶剂相比提高29.09%。PEG具有的-OH基团能够加强与多糖的相互作用,从而促进多糖在PEG/水体系中的溶解性。随着PEG分子量的继续增加,多糖得率表现出下降趋势。这可能是由于低分子量的PEG-200比高分子量的PEG具有较强的极性和较低的粘度,低粘度的溶液有利于按照相似相溶的原理进行传质[21]。这与提取金钗石斛多糖时,200 Da在不同分子量的PEG/水体系中得率最高的报道相近[22]。

图1 PEG分子量对菠萝蜜果皮多糖得率的影响Fig.1 Effect of molecule weight of PEG on polysaccharide yield
2.1.2 PEG-200浓度对多糖得率的影响 PEG-200的浓度决定提取溶液的极性和粘度,两者都会影响多糖得率。由图2可知,PEG浓度从0.1~0.3 g·mL-1时,果皮多糖得率表现出上升趋势,当浓度为0.3 g·mL-1时,多糖得率达到最大值15.21%。这可能是由于增加浓度,有利于更多的多糖溶出;PEG改变溶液的耗散因子,有利于提高能量传递速度和提取效率[23]。当超过0.3 g·mL-1后,多糖得率出现下降趋势。推测原因是溶液粘度随着PEG浓度的增加而增大,导致粘度过高得率下降。因此,PEG-200提取菠萝蜜果皮多糖的最佳浓度为0.3 g·mL-1。
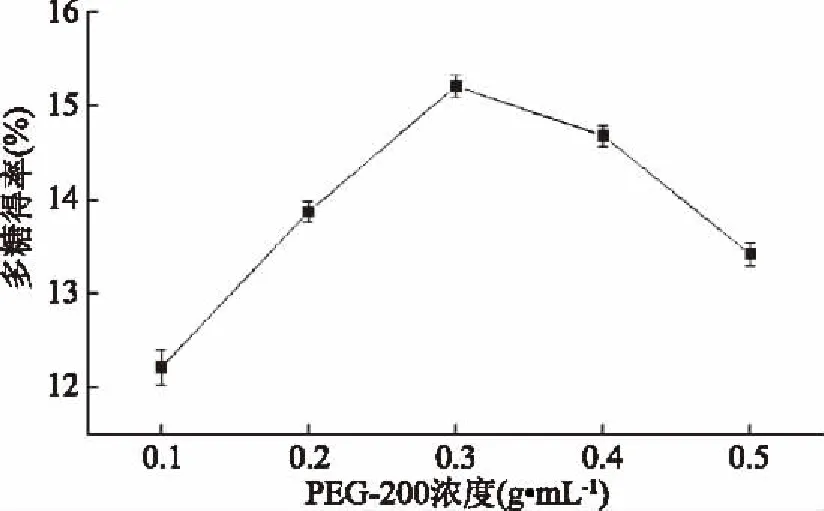
图2 PEG-200浓度对菠萝蜜果皮多糖得率的影响Fig.2 Effect of concentration of PEG-200 on polysaccharide yield
2.1.3 微波功率对多糖得率的影响 微波功率是影响菠萝蜜果皮多糖得率的重要因素之一。如图3所示,随着微波功率增加,多糖得率随之增加。当功率增加到65 W时,多糖得率达到最大值。这是由于在一定范围内增加微波功率有利于温度上升,温度升高提高了组织的空化率,使分离介质与颗粒的接触面积增大[24]。微波超过65 W时,温度过高,空化泡数量减少同时空泡破裂对样品的影响减弱[25],多糖得率下降。因此,微波功率为65 W时较为适宜。
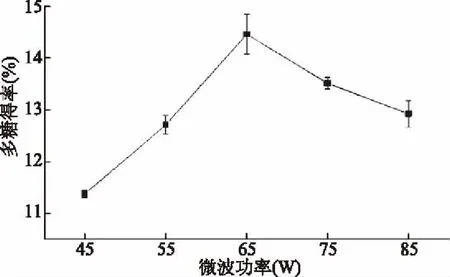
图3 微波功率对菠萝蜜果皮多糖得率的影响Fig.3 Effect ofmicrowavepoweron polysaccharide yield
2.1.4 提取时间对多糖得率的影响 多糖得率也受到提取时间的影响,这涉及到溶剂渗透到干粉状样品的程度,以及多糖最终从原料中转移出的量[26]。图4可知,提取时间为30 min时多糖得率优于其它提取时间,即在30 min时菠萝蜜果皮粉末与PEG水溶液达到浓度平衡。超声波和微波作用时间过长,可能会使多糖分子链裂解使得多糖得率下降[27]。由此,提取时间30 min较为适宜。

图4 提取时间对菠萝蜜果皮多糖得率的影响Fig.4 Effect ofextraction time on polysaccharide yield
2.1.5 料液比对多糖得率的影响 如图5所示,多糖得率随着料液比的减少而呈现上升趋势,在料液比为1∶40 (g/mL)时多糖得率达到最大值14.67%,当料液比值小于1∶40 (g/mL)时多糖得率出现下降。原因可能是在1∶20~1∶40 (g/mL)范围内,溶质与溶剂之间作用力变小,溶质与溶剂间浓度差增大,有利于多糖的溶出,多糖得率增加[28]。当料液比值小于1∶40 (g/mL)时,由于多糖的扩散量是一定的,后续减小料液比并不会促进多糖的扩散,且超声波和微波对样品的作用程度相对变小。因此选择料液比为1∶40 (g/mL)。

图5 料液比对菠萝蜜果皮多糖得率的影响Fig.5 Effect ofsolid-liquid ratio on polysaccharide yield
2.2 菠萝蜜果皮多糖超声-微波协同提取的响应面分析
2.2.1 响应面试验结果 由单因素实验结果确定响应面试验的因素及水平编码,根据Box-Behnken试验设计原理,在不同提取条件下研究自变量PEG-200/水体系浓度(X1)、微波功率(X2)、提取时间(X3)、料液比(X4)对菠萝蜜果皮多糖得率(Y)的相互影响,同时优化提取工艺参数。对试验数据进行多元回归分析,得出提取条件与多糖得率之间的二次回归方程:

表2 Box-Behnken试验设计与结果Table 2 Scheme and result of Box-Behnken design


表3 回归模型方差分析Table 3 Analysis of varlance for the fitted quadratic polynomial model
回归系数线性项(X1、X2、X3、X4)的p值均小于0.001,说明均对菠萝蜜果皮多糖得率有极显著影响,并由F值的大小得出对多糖得率的影响从大到小依次为:X1>X2>X3>X4。在α=0.001水平上一次项和二次项均具有极显著性。交互项X1X4差异显著(p<0.05),其余交互项均不具有显著性(p>0.05),表明菠萝蜜果皮多糖得率响应值的变化十分复杂,并非简单的线性关系,而是二次关系。
2.2.2 响应面各因素交互作用分析 由图6可知,X1X4响应曲面坡度陡峭,两变量等高线呈椭圆形,表明两因素交互作用显著。其余因素间的交互作用并不显著。4个试验因素中PEG-200/水体系浓度(X1)和微波功率(X2)对菠萝蜜果皮多糖得率影响最大,随着二者的延长,果皮多糖得率呈现上升趋势。提取时间(X3)和料液比(X4)对多糖得率得影响较弱。

图6 两因素交互作用对菠萝蜜果皮多糖得率影响的响应面分析Fig.6 Response surface plots showing the interactive effects of four extraction parameters on polysaccharide yield
2.2.3 菠萝蜜果皮多糖提取最佳工艺条件的确定及验证试验 将上述多元回归方程优化后得出Box-Behnken试验最佳提取工艺条件为PEG-200/水体系浓度0.34 g·mL-1,微波功率68.22 W,提取时间31.69 min,料液比1∶41.23 (g/mL)。考虑到试验中的可操作性,调整为PEG-200/水体系浓度0.34 g·mL-1,微波功率68 W,提取时间32 min,料液比1∶42 (g/mL)。
在上述优化条件下,做3次菠萝蜜果皮多糖提取试验,多糖得率为15.65%±0.29%,与回归方程预测值15.89%接近且相对误差为1.51%,表明本试验所得多元回归方程应用在菠萝蜜果皮提取多糖上是准确的和可靠的。在多糖得率上比使用纯水作为提取溶剂提高30.31%。相比以纯水作为溶剂的传统热水提取法[29],该体系有效利用低分子量(Da<1000)PEG含有的羟基基团加强与多糖间的相互作用,促进目标多糖在体系中溶解,同时辅助以超声-微波协同作用具有省时、耗能少和多糖得率高的优点。当前,低分子量PEG/水体系提取天然产物中的多糖主要使用高速逆流色谱(HSCCC,High Speed Countercurrent Chromatography)进一步纯化。Zhou等[30]使用HSCCC从基于PEG-400/水体系提取的石榴皮多糖中分离出三个多糖纯化组分。菠萝蜜果皮多糖均一组分及其性质有待课题组进一步研究。
2.3 菠萝蜜果皮多糖体外抗氧化能力比较
2.3.1 DPPH自由基清除能力 DPPH自由基清除法已被广泛用于评价天然化合物的抗氧化活性。分别使用纯水和PEG/水体系提取所得多糖对DPPH自由基的清除能力如图7所示,在0.25~2.0 mg/mL的浓度范围内,JFP-P和JFP-W对DPPH自由基的清除能力分别为21.26%~69.28%和22.25%~69.72%,两种多糖均有较强的DPPH自由基清除能力。在5个试验浓度中JFP-P对DPPH自由基的清除率都略低于JFP-W。通过Bonferroni多重比较分析,两种多糖清除DPPH自由基的能力在总体上不存在显著性差异(p>0.05)。
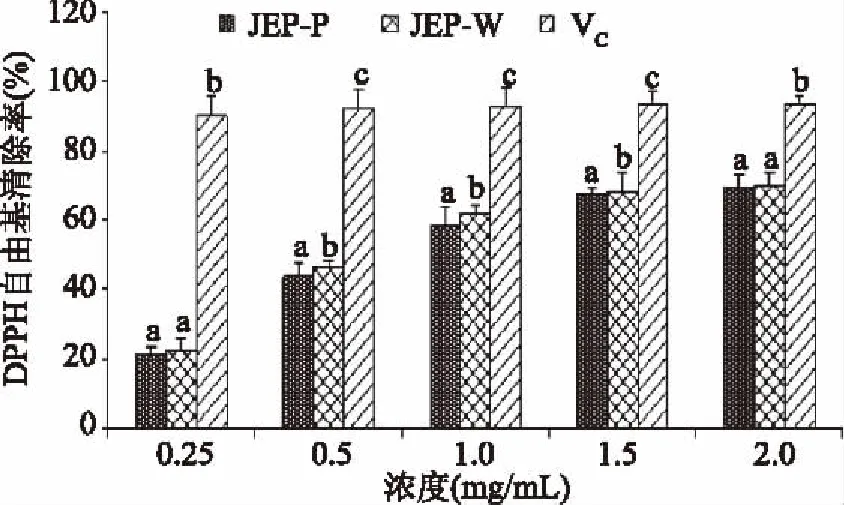
图7 菠萝蜜果皮多糖对DPPH自由基的清除能力Fig.7 Scavenging effect of polysaccharide from jackfruit peel on DPPH radical注:相同质量浓度不同小写字母表示差异显著(p<0.05);图8、图9同。
2.3.2 OH自由基清除能力 OH自由基是造成生物分子过氧化损伤的重要因素之一。在0.25~2.0 mg/mL的范围内,两种多糖清除OH自由基的能力随浓度的增加而上升,呈现剂量关系。当多糖浓度在0.25~1.0 mg/mL时,JFP-P和JFP-W清除OH自由基的能力呈现上升趋势,在之后的浓度中JFP-P和JFP-W 对OH自由基清除率增加缓慢。JFP-P对OH自由基清除率在0.25 mg/mL时略高于JFP-W,但随着浓度的升高清除自由基的能力弱于JFP-W。通过Bonferroni多重比较分析,两种多糖清除OH自由基的能力在总体上不存在显著性差异(p>0.05)。通常,使用极性提取溶剂可以得到更高水平的生物聚合物多糖,在抗氧化活性方面能够表现出更强的清除超氧阴离子、OH自由基及DPPH自由基能力和更高的还原能力[31]。试验中JFP-P和JFP-W清除DPPH自由基和OH自由基的能力在总体上均不存在显著性差异(p>0.05)。该结果与使用PEG-200/水体系和纯水分别结合超声波法提取金钗石斛多糖后,比较两种多糖清除自由基的能力所得结论相近[22]。
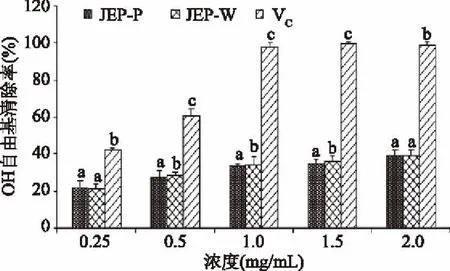
图8 菠萝蜜果皮多糖对OH自由基的清除能力Fig.8 Scavenging effect of polysaccharide from jackfruit peel on hydroxyl radical
2.3.3 还原力 还原力可以作为表征天然产物抗氧化活性的指标之一,吸光度值大小可以直接指示还原能力。如图9所示,两种多糖在浓度范围内,还原能力随浓度的增加呈现上升趋势,且表现出剂量依赖性,但都明显低于抗坏血酸。当浓度在0.25~1.0 mg/mL时,JFP-P的还原力略高于JFP-W,当浓度超过1.0 mg/mL后,JFP-W表现出略高的还原力。通过Bonferroni多重比较分析,两种多糖在还原力方面总体上不存在显著性差异(p>0.05)。这与其他文献报道的结果一致,即植物多糖对DPPH自由基和OH自由基有较强的清除活性,但是还原力相对较低[32]。
2.4 菠萝蜜果皮多糖的红外光谱分析
如图10所示,JFP-P和JFP-W的红外光谱具有一定的相似性。3600~3200 cm-1的吸收峰(JFP-P:3426.89 cm-1,JFP-W:3414.17 cm-1)是由O-H伸缩振动产生的。2930 cm-1的吸收峰(JFP-P:2930.18 cm-1,JFP-W:2930.92 cm-1)是由C-H伸缩振动产生的。上述两个吸收峰均是多糖类物质特征吸收峰[33]。此外,1749 cm-1处的吸收峰是羰基中碳氧双键非対称伸缩振动产生,表明多糖含有羧基基团,存在糖醛酸[34]。1680~1600 cm-1相对较强的吸收峰是由于结合水的存在[35-36]。C-H的面内弯曲振动在1470~1300 cm-1之间。1200~950 cm-1的强吸收峰归因于醚键(C-O-C)和吡喃糖环中存在的羟基[37]。基于低分子量PEG/水体系提取多糖的结构与生物活性间的关系仍有待深入探究。
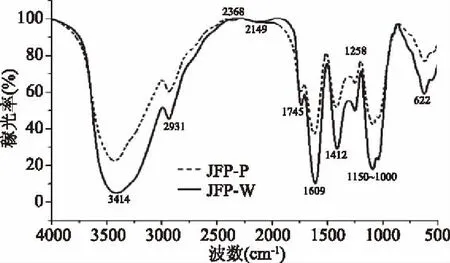
图10 菠萝蜜果皮多糖的红外光谱Fig.10 IR of polysaccharide from jackfruit peel
2.5 菠萝蜜果皮多糖的紫外光谱分析
如图11所示,经200~700 nm扫描后,在260 nm和280 nm处都未出现吸收峰,表明JFP-P和JFP-W均不含核酸和蛋白质。

图11 菠萝蜜果皮多糖的紫外光谱Fig.11 UV spectraof polysaccharide from jackfruit peel
3 结论
低分子量(Da<1000)PEG/水体系可以应用于提取菠萝蜜果皮多糖,其优化工艺条件为PEG-200/水体系浓度0.34 g·mL-1,微波功率68 W,提取时间32 min,料液比1∶42 (g/mL),在该条件下多糖得率达15.65%±0.29%,比使用纯水作为提取溶剂提高30.31%。同时多糖具有一定的清除DPPH自由基和OH自由基能力以及还原力。红外光谱和紫外光谱表明:菠萝蜜果皮多糖具有典型的多糖特征吸收峰且不含核酸和蛋白质。该工艺为菠萝蜜果皮多糖进一步纯化,以及探究PEG/水体系对多糖构效关系的影响奠定了基础,同时进一步扩大了低分子量(Da<1000)PEG/水体系提取天然产物中多糖的应用范围。

