超声预处理对金枪鱼皮胶原ACE抑制肽消化稳定性的影响及消化产物的分离纯化、鉴定
, ,,,,
(西南大学食品科学学院,重庆 400715)
金枪鱼是一种重要的经济鱼类,在全世界有很高的渔获量,因口感细腻、营养丰富深受消费者的喜爱。金枪鱼加工过程往往会产生占总重50%~70%左右的下脚料,这些下脚料一般加工为饲料或鱼饵,经济价值不高,还会造成一定的环境污染[1]。目前,金枪鱼皮已被许多学者用于制备明胶[2-3]、胶原[4-5]和生物活性肽[6-7]等。
金枪鱼皮含有丰富的胶原蛋白,三螺旋区域富含脯氨酸(Pro)和羟脯氨酸(Hyp),是制备ACE抑制肽的良好来源[8-9]。但胶原蛋白有特殊的三螺旋结构存在,三条肽链紧密地结合在一起,很难被金属蛋白酶以外的酶酶解[10]。因此,如何破坏三螺旋结构,暴露肽链酶切位点是ACE抑制肽提取的关键步骤,通常需要对原料进行适当预处理。常采用的预处理方法有热处理[11]、酸处理[12]、碱处理[13],这些方法操作复杂且耗时较长。超声作为一种绿色能源可用于原料预处理,任晓峰等[14]研究了玉米醇溶蛋白制备ACE抑制肽,结果表明,扫频超声处理提高了ACE抑制肽制备效率和ACE抑制肽的活性。Uluko等[15]研究了从牛奶中提取ACE抑制肽的工艺,通过超声预处理牛奶后,得到的ACE抑制肽分子量更小,活性比传统方法的更高。
本课题组研究了从猪皮胶原蛋白制备ACE抑制肽的工艺,表明超声处理可改变胶原蛋白构象特点,有利于ACE抑制肽的释放[16]。黄丹丹等[17]研究证明对于结构较哺乳动物胶原蛋白简单的大目金枪鱼皮,采用单纯超声波预处理(功率30%(195 W)、工作/间歇时间为5 s/10 s)即可促进胶原ACE抑制肽的高效释放。但其水解时间短,所获水解液分子量较大,因此有必要对水解液的消化稳定性进行进一步研究,初步判断此方式可以在消化后仍具有明显ACE抑制活性。
本研究拟对超声预处理金枪鱼皮后,酶解得到的ACE抑制肽的消化稳定性进行评价,并筛选其中高活性水解液进行ACE抑制肽的分离纯化和结构鉴定,旨在明确经胃肠消化后高ACE抑制活性多肽的一级结构及其来源,为超声预处理是否可以提高三螺旋区活性肽的释放效率提供理论依据。
1 材料与方法
1.1 材料与仪器
金枪鱼鱼皮 山东省中鲁远洋(烟台)食品有限公司;ACE作用底物(ABZ-Gly-Phe(NO2)-Pro) Bachem公司;胰蛋白酶(>250 unit/mg) Amresco公司;蛋白酶K(酶活为40 unit/mg)、胰凝乳蛋白酶(1200 unit/mg) 索莱宝生物科技公司;胃蛋白酶(3000 unit/mg)、ACE、葡聚糖凝胶G-15(Sephadex G-15)、细胞色素C、抑肽酶(1300 unit/mg)、杆菌肽、谷胱甘肽 Sigma公司;乙腈、三氟乙酸 成都市科龙化工试剂厂 色谱纯;其他试剂 均为化学纯。
QL-901型漩涡混合器 海门市其林贝尔仪器制造有限公司;5804R型台式离心机 德国Eppendorf公司;FD-1-50型真空冷冻干燥机 北京博医康实验仪器有限公司;0.5 m×26 mm、1 m×10 mm层析柱 上海琪特分析仪器有限公司;BT1-100E型恒流泵 上海琪特分析仪器有限公司;BSZ-100-LCD型自动部分收集器 上海琪特分析仪器有限公司;日立LC-2000型半制备液相色谱 日立高新技术公司;Q Exactive型质谱仪 Thermo Finnigan公司;上样柱 Thermo scientific EASY column(2 cm×100 μm 5 μm-C18),分析柱 Thermo scientific EASY column(75 μm×100 μm 3 μm-C18)。
1.2 实验方法
1.2.1 金枪鱼皮酶解液的制备 称取2 g金枪鱼皮,加入0.1 mol/L pH7.5的磷酸盐缓冲液,进行超声预处理,超声预处理条件[17]:料液比为1∶15 (g/mL),超声温度为30 ℃,超声功率为195 W,工作/间歇时间为5 s/10 s,超声时间分别为0、1、5、20、40 min。未处理组不经超声预处理。
金枪鱼皮经超声预处理后,按酶底比1 mg/g (W/W)加入蛋白酶K,置于37 ℃水浴恒温振荡器中分别酶解5、30、60 min,90 ℃水浴15 min灭酶,冷却;6000 r/min离心15 min,用0.45 μm滤膜过滤上清液,即为酶解液,冷冻干燥制成冻干粉备用。
1.2.2 体外模拟消化 模拟胃消化道酶系:将金枪鱼皮酶解液冻干粉复溶于蒸馏水中配成3%(V/V)的溶液,用1 mol/L的盐酸调节pH为2.0,加入胃蛋白酶(添加量为冻干粉的4%),在摇床中恒温(37 ℃)孵育2 h。沸水浴5 min灭酶,快速冷却,离心15 min(9000 r/min),得到上清液,取10 mL上清液用于ACE抑制率测定,剰余上清液冷冻干燥备用。
模拟肠消化道酶系:金枪鱼皮酶解液经过胃消化道酶系消化2 h后,用0.9 mol/L的NaHCO3调节反应体系pH为5.0,再用1 mol/L NaOH调节pH为7.5,加入胰蛋白酶、胰凝乳蛋白酶(添加量为冻干粉的4%),在摇床中恒温(37 ℃)孵育4 h。沸水浴5 min灭酶,快速冷却,离心15 min(9000 r/min),得到上清液,取10 mL上清液用于ACE抑制率测定,剰余上清液冷冻干燥备用。
1.2.3 酶解物分子量分布的测定 取5 mg消化液冻干样品溶于2 mL流动相中,采用HPLC法分析其多肽分子量分布的情况[18]。色谱柱:TSK gel G2000 SWXL凝胶色谱柱(7.8 mm×300 mm);流动相:30%乙腈(含0.1%(v/v)三氟乙酸);流速:0.5 mL/min等度洗脱;检测波长:220 nm;柱温:30 ℃;上样量:10 μL。
相对分子质量校准标准品:细胞色素C(Mw=12384 Da)、抑肽酶(Mw=6511.44 Da)、杆菌肽(Mw=1422.69 Da)、谷胱甘肽(Mw=612.63 Da)。
1.2.4 ACE抑制活性的测定 参照Sentandreu等[19-20]的方法,略有改动。取50 μL经体外模拟消化后的上清液于96孔黑色微量滴定板反应孔中,加入6 mU/mL ACE溶液50 μL后,将微量酶标板置于荧光酶标仪中,振荡10 s,于37 ℃下反应10 min,之后再向微量滴定板每个反应孔中加入200 μL 0.45 mmol/L ACE底物反应液(ABZ-Gly-Phe(NO2)-Pro),于37 ℃开始动力学测定,在1 h内每隔1 min测量一次荧光值,其中荧光激发波长、吸收波长分别为360、415 nm。所有样品均需重复3次。
式中:α表示荧光吸收值与测定时间回归曲线的斜率。其中,阳性对照组用pH8.3 Tris缓冲液代替酶解液,阴性对照组、空白对照组用Tris缓冲液替代ACE溶液。
1.2.5 IC50值的测定 称取适量消化液冻干样品配制成不同浓度的溶液,按照ACE抑制率测定方法测定抑制活性,以浓度为横坐标,ACE抑制率为纵坐标作图,通过图形计算出IC50值。
1.2.6 Sephadex G-15分离纯化ACE抑制肽的分离纯化 将60 g Sephadex G-15凝胶颗粒溶于5~10倍量去离子水中,充分溶胀后反复漂洗,去除表面悬浮小颗粒。凝胶悬液沿玻璃棒缓慢灌入柱中,恒流泵与层析柱相连接,用洗脱液冲洗柱子过夜使柱床稳定。
试验前期对分离条件进行筛选,确定分离条件为:洗脱速度为0.5 mL/min,洗脱剂为蒸馏水,层析柱规格为1 m×10 mm。对经胃肠消化的酶解液进行分离,样品浓度为100 mg/mL,加样量为1 mL,使用洗脱液进行洗脱,每5 min收集一管,共收集70~80管。于280 nm检测。对收集到的每个洗脱峰进行冷冻干燥处理,测定其ACE抑制率并计算IC50值。
1.2.7 反相高效液相色谱(RP-HPLC)分离纯化ACE抑制肽 试验前期对分离条件进行初探,此时色谱条件:ZORBAX SB-C18(4.6 mm×250 mm)色谱柱;样品浓度为10 mg/mL,进样量10 μL;柱温30 ℃;检测波长280 nm。最后确定半制备RP-HPLC流动相条件为:0~50 min 0%~30%乙腈梯度洗脱。
在上述分离条件的基础上,进行半制备放大试验,按照公式“放大倍数=(制备柱内径/分析柱内径)2×(制备柱柱长/分析柱柱长)”得到放大倍数为4.35,保持样品浓度、流动相比例不改变,进样量、流速按比例放大。半制备时色谱条件:色谱柱为ZORBAX 300 SB-C18(9.4 mm×250 mm);流速为4.35 mL/min;样品浓度为10 mg/mL;进样量为43.5 μL;柱温为30 ℃;检测波长为280 nm。确定半制备分离条件后,对Sephadex G-15分离获得的ACE抑制肽进一步分离纯化,多次重复进样,洗脱时间相同的组分峰进行合并,冷冻干燥后测定其ACE抑制率并计算IC50值。
1.2.8 液相色谱-串联质谱(LC-MS/MS)测定ACE抑制肽氨基酸序列 采用LC-MS/MS法分析RP-HPLC纯化获得的ACE抑制肽[21]。色谱分析:使用FASP酶解处理样品,毛细管高效液相色谱A液为纯水(含0.1%甲酸),B液为乙腈(0.1%甲酸),色谱柱以95%的A液平衡后,样品由自动进样器上样至Trap柱,洗脱过程为:0~50 min,4%~50% B;50~54 min,50%~100% B;54~60 min,100% B。
质谱分析:采用Q-exactive质谱仪进行测序,毛细管温度为200 ℃,检测方式为正离子,多肽和多肽的碎片的质量电荷比采集,每次全扫描后采集10个碎片图谱,数据搜索为Mascot 2.2软件。具体如下:先用正离子和自动获得数据模式采集数据,一级质谱(MS)扫描范围为1~1000 Da,再对其主峰进行二级质谱(MS/MS),质谱峰图和数据用 Flex Analysis 3.4 软件进行处理,并采Biotools的Rapi De Novo Squencing、Mascot squnence Query和Mascot MS/MS Ion Search进行氨基酸序列分析。
1.3 数据分析
采用Excel 2007、SPSS 18.0、Origin 8.0对数据进行处理,采用origin 8.0作图,显著性分析采用SPSS 18.0,选择Duncans法进行比较。
2 结果与分析
2.1 超声预处理对ACE抑制肽体外模拟消化后小分子含量的影响
本课题组研究大目金枪鱼制备ACE抑制肽的工艺时,发现采用采用单纯超声波预处理(时间为20 min、功率30%(195 W)、工作/间歇时间为5 s/10 s)可促进胶原ACE抑制肽的高效释放[17]。在前期研究上,首先比较了超声0、20 min对制备得到的ACE抑制肽经体外模拟消化后的影响。将超声0、20 min并在不同酶解时间条件下所制备的金枪鱼皮酶解液进行体外模拟消化,经计算消化液3 kDa以下分子含量如图1所示。各组酶解液经胃消化后3 kDa以下分子量增多;经胃肠消化后,基本完全被分解为小分子肽,3 kDa以下分子百分含量达到95%以上,这些3 kDa以下的小分子肽在小肠内直接被小肠上皮细胞吸收利用发挥其生理功效[22],说明经胃肠道消化的金枪鱼皮酶解液易于消化吸收。
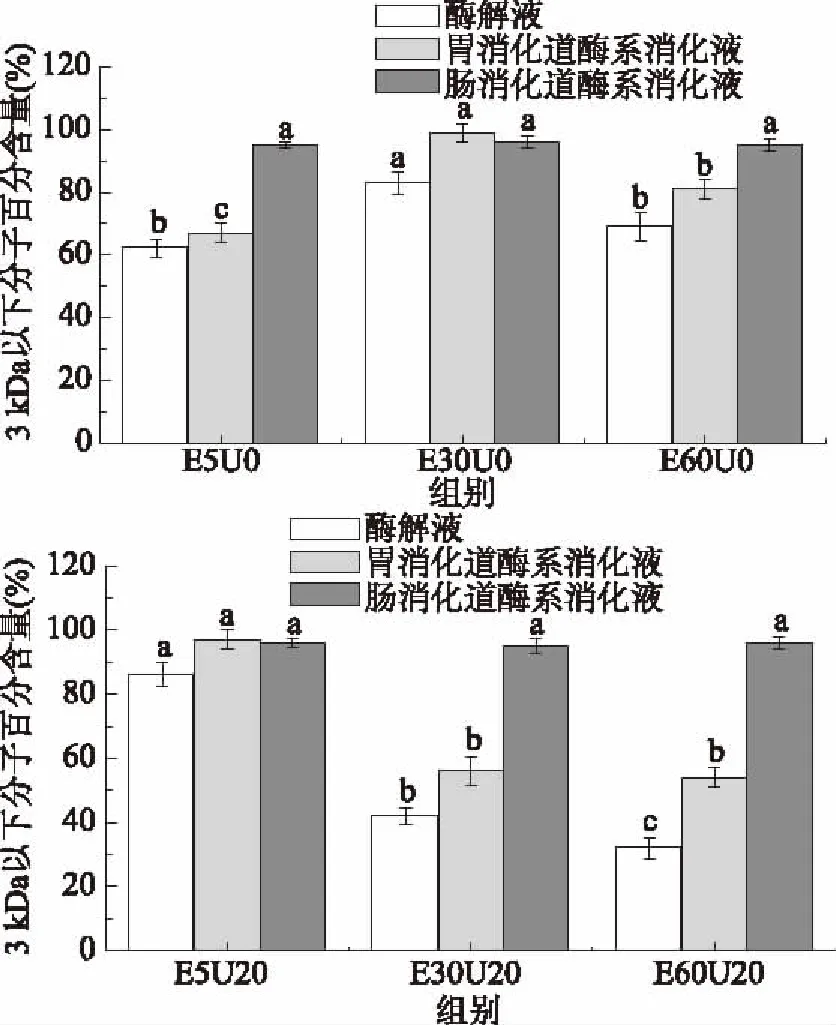
图1 超声预处理0、20 min对酶解液体外模拟消化的3 kDa以下分子含量的影响Fig.1 The effect on the molecular weight(under 3 kDa)distribution of tuna skin hydrolysate by ultrosonic pretreatmentfor 0,20 min before and after gastrointestinal digestion注:E表示酶解时间,U表示超声预处理时间,如E5U0表示酶解5 min,超声预处理0 min;图中不同字母表示不同酶解时间样品间差异显著(p<0.05),下同。
2.2 超声预处理对ACE抑制肽体外模拟消化后的ACE抑制活性的影响
对超声0、20 min并在不同酶解时间条件下所制备的金枪鱼皮酶解液进行体外模拟消化,消化液ACE抑制活性如图2所示。超声预处理组和未处理组酶解液经过胃肠道模拟消化后呈现相同变化规律,但E5U20组酶解液消化后ACE抑制活性明显优于E5U0组,说明超声预处理不仅利于短时酶解快速释放ACE抑制肽,也利于酶解液在体内发挥ACE抑制活性功效。超声预处理金枪鱼皮后,酶解5 min酶解液即有较高的ACE抑制率,经体外消化后ACE抑制率达到80%以上,说明超声预处理能有效缩短酶解时间,快速释放活性肽。从经济成本角度考虑,后期实验以酶解5 min作为研究基础,分析不同超声预处理时间对酶解液的体外模拟消化的影响。
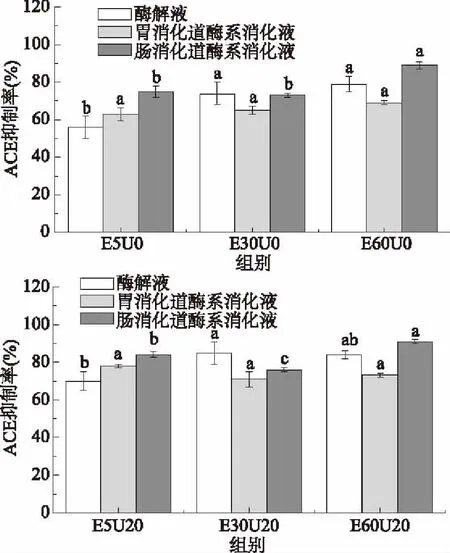
图2 超声预处理0、20 min对酶解液体外模拟消化的ACE抑制率变化的影响Fig.2 The effect on ACE inhibitory activity of tuna skin hydrolysate by ultrosonic pretreatment for 0,20 min before and after gastrointestinal digestion
2.3 超声预处理时间对ACE抑制肽体外模拟消化的小分子量和ACE抑制活性的影响
对超声时间为0、1、5、20、40 min,酶解时间为5 min的条件制备的金枪鱼皮酶解液进行体外模拟消化,结果如图3所示。经胃肠消化后,各组酶解液3 kDa以下分子百分含量均达到95%以上,酶解液都保留了ACE抑制活性,说明酶解液中ACE抑制肽对胃肠消化有一定的抗性作用。各组酶解液的ACE抑制率均有所增加,说明酶解液中ACE抑制肽一方面可以抵制消化酶的水解,另一方面可被消化酶降解释放ACE抑制肽,因此口服这些酶解液就可能发挥降血压作用。根据显著性分析,E5U20和E5U40组胃肠消化后的酶解液中3 kDa以下分子百分含量与ACE抑制率与其他组相比有明显提高,为进一步分析ACE抑制肽的一级结构特征,将经胃肠消化的E5U20、E5U40的酶解液进一步分离纯化。
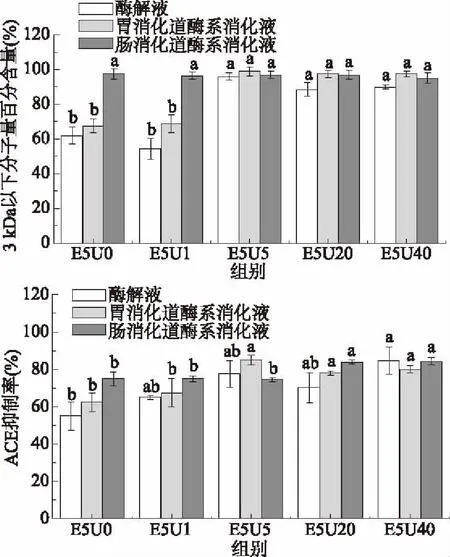
图3 酶解5 min对金枪鱼皮酶解液体外模拟消化的3 kDa以下分子含量和ACE抑制率变化的影响Fig.3 The effect on the molecular weight(under 3 kDa)distribution and ACE inhibitory activity of tuna skin hydrolysateby enzyme for 5 min before and after gastrointestinal digestion
2.4 Sephadex G-15分离纯化结果及分离纯化后各组分IC50值
对E5U20、E5U40体外消化冻干粉进行分离纯化,将E5U20分离出的三个组分标记为G1、G2、G3;E5U40分离出的三个组分标记为F1、F2、F3,结果如图4所示,分别收集各组分峰,冷冻干燥备用。
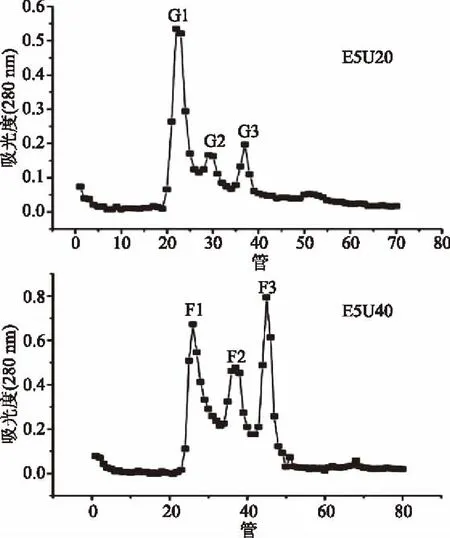
图4 E5U20和E5U40的洗脱曲线Fig.4 The elution profile of E5U20 and E5U40
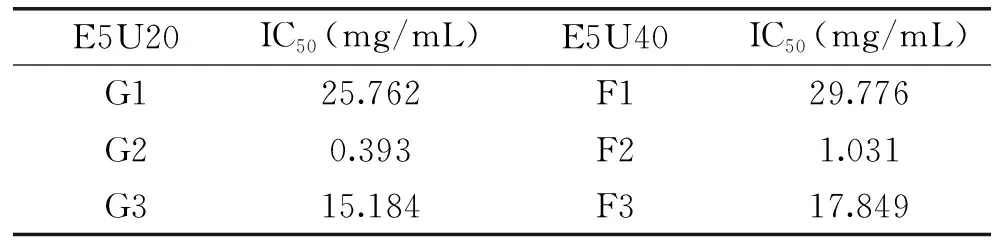
表1 Sephadex G-15分离E5U20、E5U40组分的IC50值Table 1 The IC50 of components separated E5U20 and E5U40 by Sephadex G-15
根据Sephadex G-15凝胶分离原理,这些组分分子量均小于1500 Da,ACE抑制肽多由2~12个氨基酸残基组成,分子量小于1500 Da[23-24]。E5U20的三个组分中G1的分子量最大,G2分子量次之,G3分子量最小,同理E5U40组三个组分分子量大小的顺序为F1>F2>F3。由表可知,E5U20组分离的样品G2的IC50值最小,其次是G3,G1最大,这说明该方法使样品得到较好的分离;E5U20组整体组分比E5U40组ACE抑制率效果好,因此,选用E5U20组G2进一步分离纯化。
2.5 半制备RP-HPLC分离纯化结果及分离纯化后各组分IC50值
对E5U20组G2进一步进行分离纯化,结果如图5所示。G2分离得到8个峰,多次收集这8个组分,冷冻干燥备用。
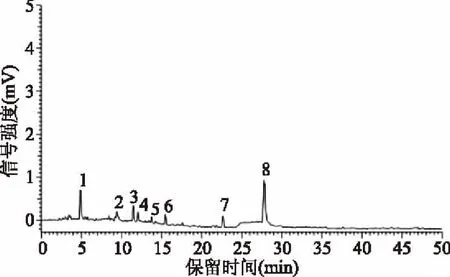
图5 半制备液相色谱分离纯化图谱Fig.5 Chromatogram of separated by semi-preparing RP-HPLC
由RP-HPLC分离出的8个峰的IC50值见表2,峰3的IC50值最低,抑制活性最强,相比Sephadex G-15分离得到的G2的IC50值有明显提高,反向高效液相色谱分离能达到较好的分离效果。进一步收集峰3进行质谱分析鉴定氨基酸序列结构。

表2 半制备分离纯化F2后各组分峰IC50值Table 2 The IC50 of components F2 separated by semi-preparing RP-HPLC
2.6 ACE抑制肽氨基酸序列鉴定
经过分析鉴定,峰3的多肽序列为GPSGPPGP,分子量为665.32,IC50值为153.31 μmol/L,来源于金枪鱼皮胶原蛋白α1肽链第842~849的位置,具有典型三螺旋G-X-Y结构特点,该序列目前尚未见报到。
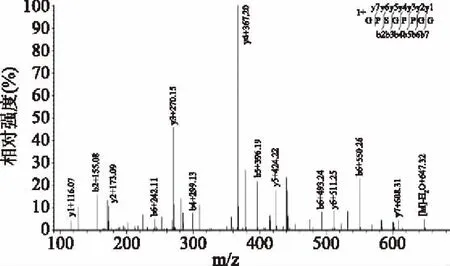
图6 峰3活性肽序列分析二级图谱Fig.6 The secondary sequence profile of the purified peak3
根据ACE抑制肽的构效特点,多肽C末端三位中任一位置为Pro时,多肽具有降血压活性[25],贾俊强[26]通过收集整理270种不同序列的降血压肽,指出甘氨酸(Gly)在N端出现的频率达到8%,Pro在C端出现的频率最高为23%,Mizuno[27]指出ACE抑制活性高的多肽具有X-Pro或X-Pro-Pro的结构特征。本试验分离纯化的多肽N端氨基酸为G,C端氨基酸为P,含有三组GP结构,符合降血压肽的构效特点。
3 结论
超声预处理的金枪鱼皮酶解液经模拟消化后,小分子多肽含量达到90%以上,且均保持较高的ACE抑制活性,说明金枪鱼皮具有良好的胃肠消化抗性,可用于口服降压药的开发利用。超声预处理20 min和40 min的酶解液消化产物的ACE抑制活性显著高于其他组(p<0.05),说明超声预处理利于酶解液在体内发挥ACE抑制活性功效,可以用于金枪鱼皮胶原ACE抑制肽的高效制备。
超声20 min酶解5 min样品经过Sephadex G-15,RP-HPLC分离出高ACE抑制活性多肽,最后通过质谱法测得序列为GPSGPPGP,分子量大小为665.32 Da,IC50值为153.31 μmol/L,来源于α1肽链第842~849的位置,具有典型的三螺旋结构特点,符合高ACE抑制活性多肽的构效特点,目前尚无该氨基酸序列的报道。

